黄蒲通窍胶囊改善Wilson 病铜负荷大鼠的认知损害:基于抑制内质网应激介导的凋亡途径
2024-04-13张笑颜谢道俊
张笑颜,王 谢,王 杰,邵 楠,蔡 标,谢道俊
安徽中医药大学1中西医结合学院,2第一临床医学院,3护理学院,安徽 合肥 230012;4安徽中医药大学第一附属医院脑病中心,安徽 合肥230031
认知损害是Wilson病(WD)的常见并发症,其症状包括记忆缺陷和执行功能受损[1-3]。目前普遍认为,ATP7B基因突变引起的铜代谢异常导致铜在大脑中过度积累,是WD认知功能障碍的主要原因[4,5]。作为一种罕见的遗传疾病,一旦患病,将给社会和家庭带来严重的负担。WD认知损害的病理机制复杂,目前尚未阐明。在所有病理因素中,神经元凋亡被认为是WD认知损害发展的一个重要过程。据报道,高铜环境可导致大鼠突触敏感性降低,导致学习记忆障碍[6-8],其原因可能与氧化应激和炎症诱导的神经元死亡有关[9-11]。黄蒲通窍胶囊(HPTQ)是安徽中医药大学第一附属医院的院内制剂,对认知障碍具有显著疗效。课题组前期研究发现,HPTQ可以通过调节钙信号通路降低磷酸化Tau表达水平及激活CREB/BDNF/TrkB信号通路抑制海马神经元凋亡来改善大鼠的认知损害[12,13]。上述研究证实HPTQ具有神经保护能力,但其对WD认知损害的潜在疗效和作用机制仍有待进一步探索。
内质网(ER)是真核细胞中蛋白质合成、加工和折叠的关键场所。研究发现,内质网应激(ERS)介导的神经元凋亡是认知障碍发展的内在因素[14],高铜环境会诱导错误折叠的蛋白质积累及ERS的发生,并触发葡萄糖调节蛋白78(GRP78)异常升高,激活CHOP蛋白及下游的caspase-12途径,最终介导细胞凋亡的发生[15-17]。课题组前期研究发现,HPTQ能抑制Aβ25-35诱导的原代培养海马神经元阿尔茨海默病(AD)细胞模型的凋亡[18];动物实验证实,GRP78在AD模型大鼠海马中的表达增加,并与神经元凋亡数量呈正相关[19]。但是,HPTQ能否通过调控ERS介导的凋亡途径抑制神经元凋亡进而改善WD认知损害尚未见报道。
为此,本研究通过铜负荷饮食构建WD铜负荷大鼠模型,观察HPTQ 对模型大鼠认知功能的影响,并从ERS介导的凋亡角度探讨其可能的作用机制,旨在为HPTQ治疗WD认知损害提供科学的实验依据。
1 材料和方法
1.1 动物
60只3月龄SPF级雄性SD大鼠,体质量180~200 g,购自济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)20190003。将所有大鼠置于动物笼中,4只/笼。养殖环境:相对湿度(50±10)%,室温22±2 ℃,12 h光照/12 h暗循环调节。实验方案经安徽中医药大学实验动物伦理委员会批准(No.AHUCM-rats-2022052)。
1.2 药物
黄蒲通窍胶囊(安徽中医药大学第一附属医院,皖药制字Z20080006);硫酸铜(CuSO4·5H2O),含量≥99%(上海国药集团化学试剂有限公司);青霉胺片(上海信谊药厂有限公司,国药准字H31022286)。
1.3 试剂
铜离子(Cu)测定试剂盒(南京建成生物工程研究所);BCA 蛋白定量试剂盒(上海碧云天生物技术有限公司);GRP78、CHOP、caspase-12、cleaved caspase-9、cleaved caspase-3、β-actin抗体(Affinity Bioscience);山羊抗兔二抗(Abbkine);ECL 化学发 光试剂 盒(Biosharp);TUNEL检测试剂盒、苏木素染液(ebiogo);PrimeScript™RT试剂盒(TAKARA);Novostart SYBR qPCR SuperMix Plu荧光染料(novoprotein)。
1.4 仪器
Morris水迷宫分析系统(深圳市瑞沃德生命科技有限公司);多功能酶标仪(上海沛欧分析仪器有限公司);超薄切片机(德国徕卡公司);数码相机(德国蒙斯特公司);电泳仪(Bio-Rad);全自动化学发光图像分析系统(上海天能生命科学有限公司,型号:Tanon 5200)。
1.5 造模、分组与给药
60只SD大鼠按随机数字表法均分为对照组、模型组、黄蒲通窍低剂量组(HPTQ-L)、黄蒲通窍中剂量组(HPTQ-M)、黄蒲通窍高剂量组(HPTQ-H)、青霉胺组(PCA);各给药组给予含铜(1 g/kg)饲料和含铜(0.185%)水造模12周[20];参考课题组前期研究[21,22],第9周起,给药组每日分别给予不同剂量HPTQ(0.47、1.41、4.23 g/kg)及PCA(0.09 g/kg)灌胃,对照组每日给予等量生理盐水灌胃。
1.6 大鼠肝铜、24 h尿铜水平检测
取新鲜肝脏组织,洗净匀浆,离心后取上清;或取24 h尿液,避光孵育,按说明书操作,在酶标仪600 nm波长处记录光度值。
1.7 Morris水迷宫
将圆形泳池均分为4个区域,逃生平台置于目标象限中间。前4天,大鼠在不同的象限出发进行空间训练。第5天,将大鼠从对侧象限游到逃生平台的时间记录为逃避潜伏期。第6天,取下平台,记录大鼠从对侧象限起自由游动90 s内穿越平台次数。
1.8 HE染色
4%多聚甲醛固定脑组织,石蜡包埋切片,脱蜡和脱水后,进行HE染色,在光学显微镜下观察海马CA1区神经元形态学变化。
1.9 TUNEL染色
石蜡切片在脱蜡和再水化后,用蛋白酶K在37 ℃下孵育,然后用PBS漂洗3次。TUNEL检测试剂盒用于染色。使用抗荧光猝灭密封剂密封薄膜,并通过数字切片扫描仪扫描荧光切片。
1.10 免疫荧光染色
石蜡切片脱蜡后透膜5 min,室温封闭1 h,在含一抗GRP78(1∶100)的PBST溶液中4 ℃孵育过夜。使用荧光二抗37 ℃避光孵育30 min,清洗后用抗荧光淬灭剂(含DAPI)封片,使用数字切片扫描仪扫描荧光切片。
1.11 Western blot 检测海 马组织GRP78、CHOP、caspase-12、cleaved caspase-9、cleaved caspase-3 蛋白表达
提取新鲜海马组织总蛋白,使用BCA法测定蛋白浓度。10%、12%SDS-PAGE电泳分离总蛋白,转膜(120V、1.5 h)后快速封闭20 min,加入兔抗大鼠一抗GRP78(1∶1000)、CHOP(1∶1000)、caspase-12(1∶1000)、cleaved caspase-9(1∶1000)、cleaved caspase-3(1∶1000),4 ℃孵育过夜,洗膜后使用山羊抗兔IgG(1∶20 000)孵育2 h,洗膜后加入ECL曝光并拍照,分析各蛋白相对表达量。
1.12 RT-qPCR检测海马组织GRP78、CHOP、caspase-12、caspase-9、caspase-3基因表达
提取大鼠海马组织总RNA,采用PrimeScript™RT试剂盒将RNA 逆转录为模板cDNA。采用Novostart SYBR qPCR SuperMix Plu进行qPCR 反应。反应条件设置为95 ℃预变性1 min,95 ℃变性20 s,60 ℃退火1 min,40 个循环,收集荧光信号,结果采用2-ΔΔCT计算mRNA 的相对表达量。引物由生工生物工程(上海)股份有限公司设计合成,引物序列见表1。
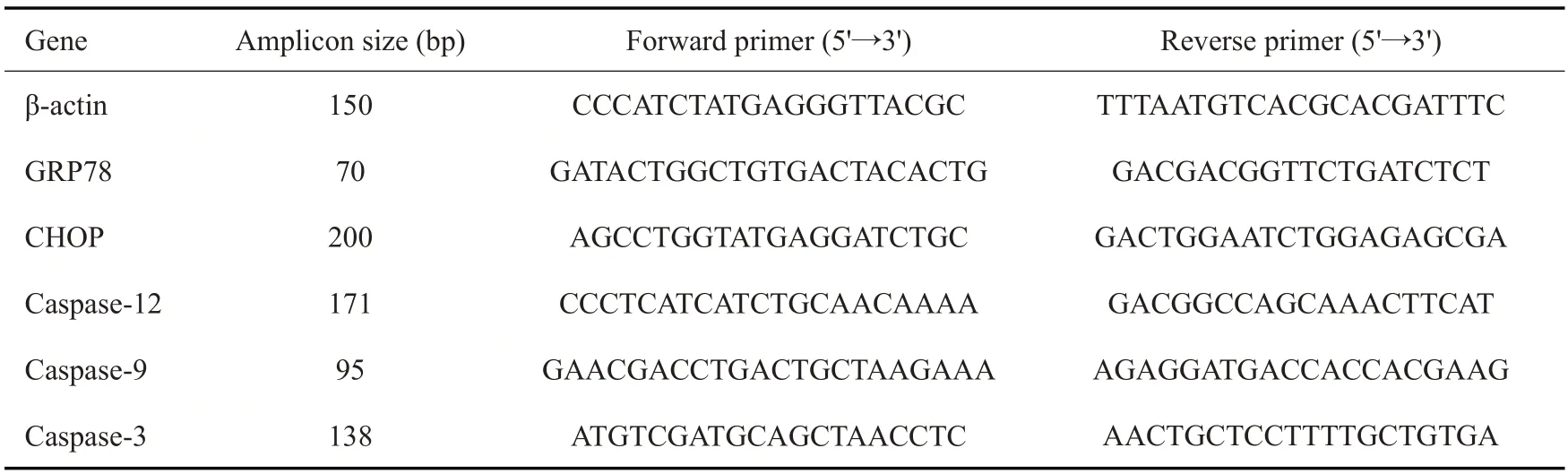
表1 RT-qPCR引物序列Tab.1 Primer sequences for RT-qPCR
1.13 统计学方法
SPSS 26.0软件用于数据分析,计量资料用均数±标准差表示。多组间样本比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HPTQ对各组大鼠肝铜、24 h尿铜水平的影响
与对照组比较,模型组大鼠肝铜、24 h尿铜水平明显升高(P<0.01);与模型组比较,HPTQ-L、HPTQ-M、HPTQ-H 和PCA 大鼠肝铜水平明显降低(P<0.01),24 h尿铜水平明显升高(P<0.01,图1)。

图1 各组大鼠肝铜、24 h尿铜水平比较Fig.1 Liver and 24-h urinary copper levels in each group(Mean±SD,n=6).**P<0.01 vs Control group;##P<0.01 vs Model group.
2.2 HPTQ对各组大鼠学习记忆能力的影响
与对照组比较,模型组大鼠逃避潜伏期明显延长(P<0.01),穿越平台次数明显减少(P<0.01)。与模型组比较,HPTQ-L、HPTQ-M、HPTQ-H和PCA组大鼠逃避潜伏期明显缩短(P<0.05或P<0.01),HPTQ-M和PCA组大鼠穿越平台次数明显增多(P<0.01,图2)。

图2 各组大鼠学习记忆能力比较Fig.2 Learning and memory abilities of the rats in each group (Mean±SD, n=6).**P<0.01 vs Control group;#P<0.05,##P<0.01 vs Model group.
2.3 HPTQ对各组大鼠海马组织CA1区病理变化的影响
对照组大鼠神经细胞结构完整,形态规则,细胞核大而圆,染色均匀。模型组大鼠细胞结构疏松,排列紊乱,细胞质深染,核边界不清,神经元变性和萎缩。各治疗组大鼠海马组织CA1区神经元的病理变化均有不同程度的减少,其中HPTQ-M和PCA组改善效果最为显著(图3)。
2.4 HPTQ对各组大鼠海马CA1区凋亡水平的影响
与对照组比较,模型组大鼠TUNEL阳性神经元数量明显增加(P<0.01,图4);与模型组比较,HPTQ-L、HPTQ-M、HPTQ-H和PCA大鼠TUNEL阳性神经元数量明显减少(P<0.01,图4)。
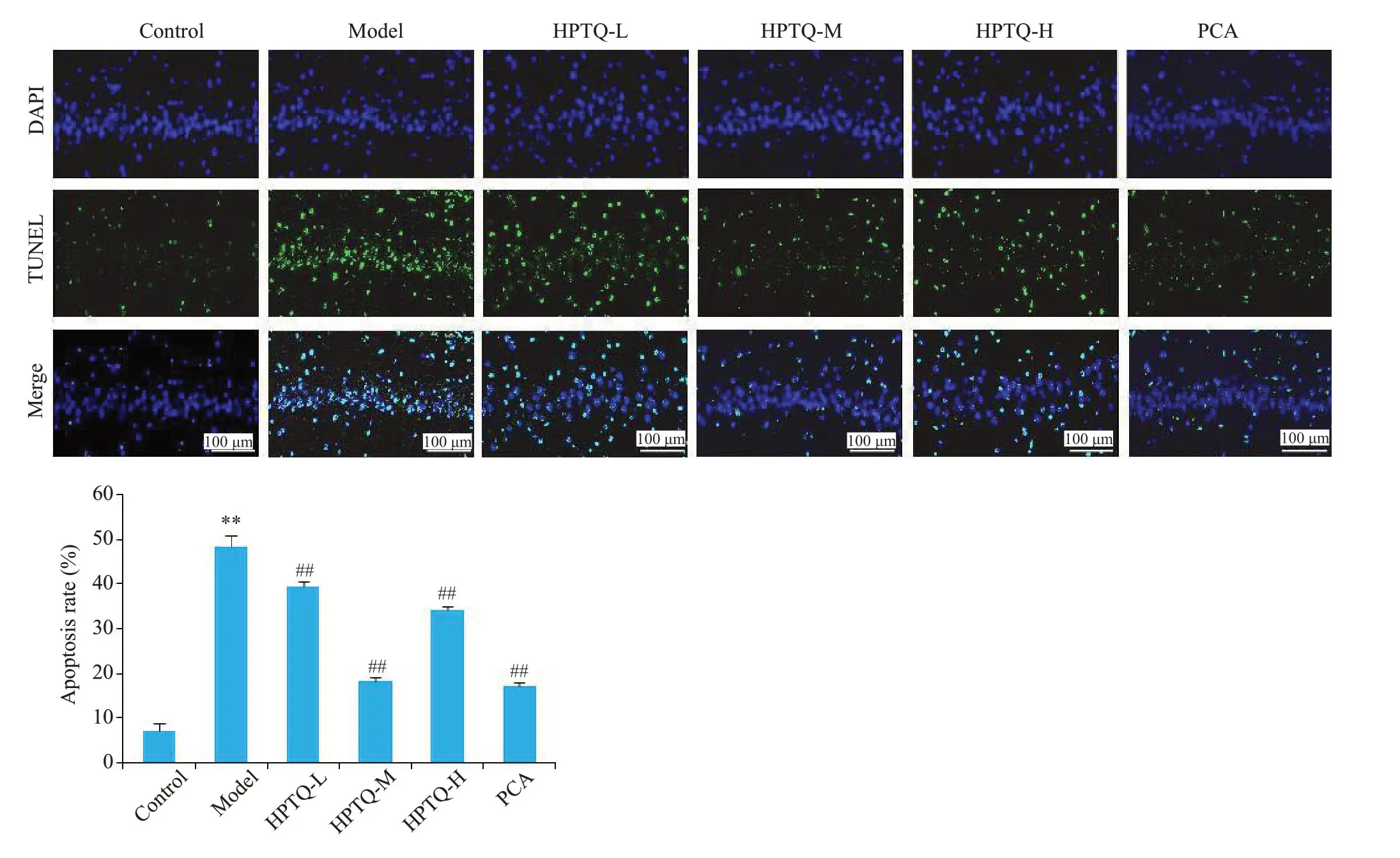
图4 各组大鼠神经元凋亡率比较Fig.4 Apoptosis of the neurons in hippocampal CA1 region in each group(Mean±SD,n=3).**P<0.01 vs Control group;##P<0.01 vs Model group.
2.5 HPTQ对各组大鼠海马CA1区GRP78荧光表达的影响
与对照组比较,模型组大鼠海马CA1区GRP78绿色荧光明显增加。与模型组比较,HPTQ-M和PCA组大鼠海马CA1区GRP78绿色荧光明显减少(P<0.01,图5)。

图5 各组大鼠海马GRP78荧光表达比较Fig.5 Fluorescence intensity of GRP78 in the hippocampus in each group(Mean±SD,n=3).**P<0.01 vs Control group;#P<0.05,##P<0.01 vs Model group.
2.6 HPTQ 对各组大鼠海马组 织GRP78、CHOP、caspase-12、cleaved caspase-9、cleaved caspase-3蛋白表达的影响
与对照组比较,模型组大鼠海马组织GRP78、CHOP、caspase-12、cleaved caspase-9、cleaved caspase-3蛋白表达水平明显升高(P<0.01);与模型组比较,HPTQ-M、PCA大鼠海马组织GRP78、CHOP、caspase-12、cleaved caspase-9、cleaved caspase-3蛋白表达水平明显降低(P<0.05或P<0.01,图6)。
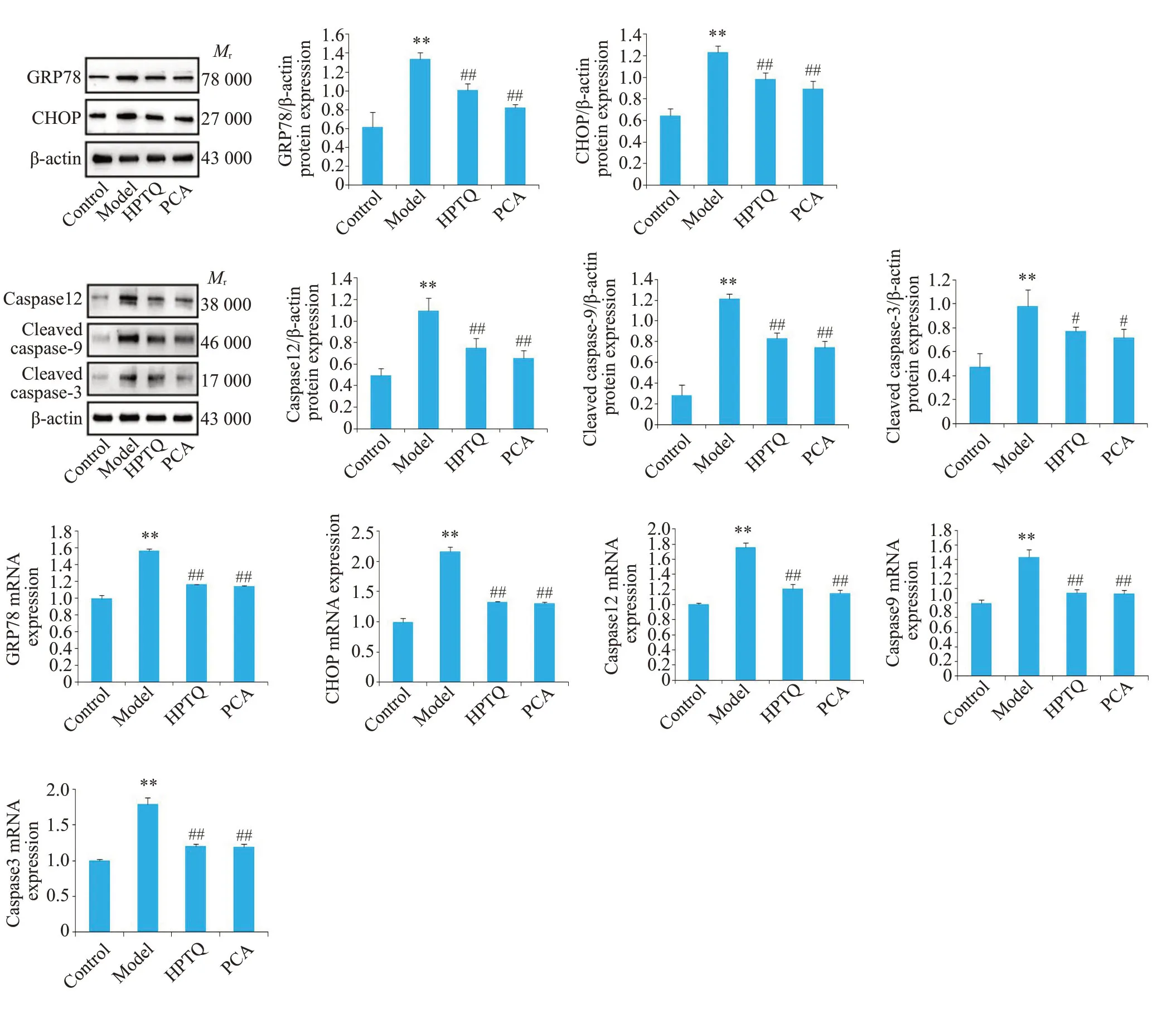
图6 各组大鼠海马ERS介导的凋亡途径关键蛋白、基因表达水平比较Fig.6 Expressions of key genes at the mRNA and protein levels in ERS-mediated apoptosis pathway in the hippocampus in each group of rats(Mean±SD,n=3).**P<0.01 vs Control group;#P<0.05,##P<0.01 vs Model group.
2.7 HPTQ 对各组大鼠海马组织GRP78、CHOP、caspase-12、caspase-9、caspase-3基因表达的影响
与对照组比较,模型组大鼠海马组织GRP78、CHOP、caspase-12、caspase-9、caspase-3基因表达水平明显升高(P<0.01);与模型组比较,HPTQ-M、PCA大鼠海马组织GRP78、CHOP、caspase-12、caspase-9、caspase-3基因表达水平明显降低(P<0.01,图6)。
3 讨论
神经元凋亡是认知障碍的病理特征。铜是维持人体正常生理功能的重要元素之一,但过量的铜可能具有神经毒性。许多研究者关注了过量铜对认知功能的损害,饮用含铜(CuSO4·5H2O)水会引起小鼠神经元丢失,体内注射CuCl2会导致大鼠海马体铜过载,影响大鼠的学习记忆能力[8,23]。在WD中,由于ATP7B功能丧失引起的铜排泄障碍,则会导致过量铜在体内堆积,给肝、脑、肾等器官造成巨大伤害[24]。铜负荷大鼠是模拟WD的经典动物模型,能很好地反映WD引起的肝、脑等器官的病理变化。既往研究表明,WD铜负荷大鼠模型出现了肝铜、24 h尿铜水平升高,以及空间学习和记忆障碍,表明该模型能在一定程度上模拟WD认知障碍的疾病特征[9,20]。为了证实铜对大鼠学习记忆的影响及其可能的机制,我们首先建立了WD铜负荷大鼠模型。结果表明,WD铜负荷大鼠肝铜和24 h尿铜水平升高,表明该动物模型已成功制备。此外,Morris水迷宫实验显示模型组大鼠逃避潜伏期明显延长,穿越平台次数显著减少,表明WD铜负荷大鼠模型出现了认知损害现象。
中医学认为,本病病机属先天不足,脾肾气虚,脑髓失养,加之铜毒内侵,痰瘀互结,上阻清窍,治法当为益气补肾,化痰祛瘀[25]。HPTQ由人参、大黄、石菖蒲、益智仁、川芎、何首乌6味中药组成。课题组前期研究发现,HPTQ能改善AD模型大鼠的认知功能,其活性成分大黄酚对改善WD认知损害有积极作用[21,22]。本研究结果表明,HPTQ能降低模型组大鼠肝铜水平,提高24 h尿铜水平,缩短逃避潜伏期,增加穿越平台次数,改善海马神经元损伤,说明HPTQ可促进模型组大鼠体内铜的排出,改善认知损害,提示HPTQ对WD铜负荷大鼠模型具有神经保护作用。
ERS诱导的细胞凋亡是一种新型的细胞凋亡方式,研究发现铜过载[26,27]。此外,课题组在之前的研究中也发现ERS的激活会引起大鼠神经元丢失并导致学习、记忆功能的损伤[28]。GRP78被认为是ERS发生的标志蛋白,在ERS的早期会迅速增加[29]。随后,伴随未折叠蛋白反应的延长会引起CHOP蛋白的上调及caspase-12、caspase-9、caspase-3激活,并启动半胱天冬酶家族的经典细胞凋亡途径,致使细胞凋亡[30,31]。
本研究结果显示,模型组大鼠海马CA1区TUNEL阳性神经元数量及GRP78绿色荧光明显增加,而HPTQ显著减少了TUNEL阳性神经元数量及GRP78绿色荧光的表达,其中以HPTQ-M效果最好。基于此,本研究选择HPTQ-M 作为最适给药浓度,进行机制探讨。Western blot结果显示,HPTQ显著降低了模型组大鼠海马组织ERS 介导的凋亡途径中关键靶点GRP78、CHOP、caspase-12、cleaved caspase-9、cleaved caspase-3的蛋白表达水平;RT-qPCR结果也显示,HPTQ显著降低了模型组大鼠海马组织GRP78、CHOP、caspase-12、caspase-9、caspase-3的基因表达水平。因此,本研究表明HPTQ 可以逆转WD 铜负荷大鼠模型海马组织中ERS介导的神经元凋亡。
综上所述,本研究通过体内实验探究HPTQ对WD铜负荷大鼠模型的神经保护作用及调控机制。结果显示,HPTQ能够通过抑制ERS介导的凋亡途径减少大鼠神经元凋亡,改善WD铜负荷大鼠模型认知损害。本研究初步揭示了HPTQ对WD认知损害的治疗作用,为HPTQ的临床治疗提供了理论支持。
