束缚应激通过激活Rho/ROCK通路诱导大鼠杏仁核血脑屏障的损伤
2024-04-13许光明高安迪
许光明,高安迪,丛 斌
1中央司法警官学院法医学教研室,河北 保定 071000;2河北医科大学法医学院//河北省法医学重点实验室,河北石家庄050017
应激是机体对外界刺激做出的非特异性-神经内分泌反应,适度应激有利于机体的生存,但是强烈或持久的应激会损害与情绪认知功能(如恐惧、焦虑等)相关的脑区[1,2],这很可能与多种神经退行性疾病和精神疾病的发生发展相关[3]。杏仁核是一个对应激极为敏感的脑区,在恐惧、焦虑相关的情绪调节中发挥着关键作用[4]。有研究证实,束缚应激能够引起杏仁核谷氨酸能椎体神经元的萎缩、凋亡,从而导致精神障碍和行为改变[5-7]。
血脑屏障(BBB)是一个主要由脑微血管内皮细胞(BMVEC)构成,并与神经元、星形胶质细胞和周细胞相互作用的特殊动态系统[8,9],对血液和脑组织之间的物质交换施加精确的调控,保护大脑免受有毒物质的侵害[10]。血脑屏障能够维持脑内稳定的微环境,为脑组织提供氧气、葡萄糖等能量物质,对保证中枢神经系统的正常功能至关重要[11]。本课题组前期研究表明,束缚应激可引起大鼠杏仁核血脑屏障的通透性升高和结构的损伤,但其内在机制尚不明确[12]。
Rho/ROCK信号通路是调控细胞骨架结构的关键通路,在血脑屏障通透性的调节过程中起着极其重要的作用,其主要机制是调节肌动蛋白骨架在内皮细胞的聚集状态,发挥分子开关作用,从而参与细胞形态的维持、粘附与迁移、平滑肌收缩等生物学行为[13,14]。Rho/ROCK信号通路的激活能够诱导内皮细胞骨架的重新分布,导致血管内皮通透性增加,屏障功能减弱[15-17]。但Rho/ROCK信号通路在束缚应激诱导血脑屏障损伤过程中的作用如何,未见报道。因此,本研究旨在对Rho/ROCK信号通路在束缚应激诱导血脑屏障损伤过程中的作用及机制进行深入研究,为揭示应激反应导致中枢神经系统疾病发生发展的机制提供依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 本实验所用SPF 级雄性SD 大鼠60只,体质量240±15 g,1.5月龄,由北京维通利华实验动物技术有限公司提供[许可证号:SCXK(京)2016-0006]。本实验所有操作经过河北医科大学实验动物福利伦理委员会批准(审批编号:IACUC-Hebmu-P-2020121)。在恒温(23±2 ℃),湿度50%条件下饲养,自由进食、进水,12 h光暗循环节律,大鼠在新环境中适应性饲养7 d后开始进行实验。
1.1.2 主要试剂与仪器 法舒地尔溶液(TCI);兔抗Claudin5(Millipore);鼠抗GAPDH、兔抗ROCK2、兔抗MLC2(Abcam);鼠抗RhoA(Santa Cruz);鼠抗p-MLC2(Cell Signaling Techology);兔抗Occludin(Thermo);兔抗ZO-1(GenTex);Rho Activation Assay Biochem Kit(Cytoskeleto);10×PBS(北京索莱宝科技有限公司);BCA 法蛋白定量试剂盒(杭州联科生物试剂有限公司);抗体稀释液(北京中杉生物试剂有限公司);激光共聚焦显微镜(Leica);高速组织研磨器(北京天根生物科技有限公司);Trans-Blot Turbo全能型蛋白转印系统(BIO-RAD);Azure C500 激光成像系统(Azure Biosystems);DYY-III2型电泳仪(北京市六一仪器厂);低温高速离心机(Thermo)。
1.2 方法
1.2.1 大鼠束缚应激模型及分组 束缚应激模型采用圆柱形亚克力管,长20 cm,内径5.5 cm,筒身两侧有通气孔,筒两端有可移动阀门。以大鼠钻入其中不能自由移动和转身为宜。60 只大鼠随机分为4 组,15 只/组。Control组:每日禁食水6 h(8:00~14:00),其余时间正常喂养;Stress组:每日束缚应激6 h(8:00~14:00),持续14 d,其余时间正常喂养;Stress+Fasudil组:每日束缚应激6 h(8:00~14:00),束缚前0.5 h 给予腹腔注射Fasudil溶液(1 mg/100 g),持续14 d,其余时间正常喂养;Fasudil组:每日给予腹腔注射Fasudil溶液(1 mg/100 g),然后禁食水6 h(8:00~14:00),其余时间正常喂养。
1.2.2 高架十字迷宫实验(EPM)造模完成后24 h检测大鼠行为学变化,EPM距离地面50 cm,设备由两个开放臂、两个闭合臂、中央平台3部分组成。设备上方安装有视频监控进行实时录像,并对大鼠实验过程中的各项指标进行分析。具体实验步骤:将大鼠放在EPM中央平台上,头部朝向其中一个闭合臂,开始记录大鼠行动5 min,其间大鼠进行自由探索。记录大鼠在开放臂和闭合臂运动的各项指标及轨迹。每只大鼠测试完成后,清除其排泄物,并用酒精擦拭开放臂和闭合臂以减少组间影响。所有大鼠测试完成后,分析进入开放臂次数百分率[%,进入开放臂次数/(进入开放臂次数+进入闭合臂次数)×100%]和开放臂停留时间百分率[%,开放臂停留时间/(开放臂停留时间+闭合臂停留时间)×100%]。
1.2.3 ELISA法检测血清皮质酮(CORT)和S100B的含量 采用ELISA试剂盒分别测定血清CORT和S100B水平。大鼠造模完成后经腹腔注射2%的戊巴比妥钠(40 mg/kg)麻醉,打开大鼠腹腔,经腹主动脉穿刺取血,将血液样品在10 000 r/min、4 ℃下离心5 min,血清采集于1.5 mL EP管中,在-80 ℃低温保存,用于CORT和S100B的检测。
1.2.4 伊万思蓝(EB)检测血脑屏障通透性 采用EB渗漏法测定法舒地尔(Fasudil)和束缚应激对血脑屏障通透性的影响。大鼠尾静脉注射2%的EB(4 mL/kg),2 h后腹腔注射2%的戊巴比妥钠(40 mg/kg)进行麻醉,然后打开胸腔,经右心房灌注200 mL 37 ℃生理盐水,立即取出脑组织,快速分离双侧杏仁核,称重后放入预冷的EP管中,置于冰上;每个标本中均加入200 μL预冷的0.01 mol/L PBS缓冲液,用电动研磨器研磨成匀浆,然后加入200 μL60%的三氯乙酸,震荡混匀,冰上静置30 min,4 ℃离心机10 000g离心20 min;最后收集上清液,用酶标仪检测610 nm的吸光度,并计算出各组EB的含量,以ng/mg表示。
1.2.5 免疫荧光染色检测紧密连接蛋白表达 大鼠腹腔注射2%的戊巴比妥钠(40 mg/kg)进行麻醉,37 ℃下经右心房灌注100 mL生理盐水,再灌注250 mL含4%多聚甲醛的0.01 mol/L PBS缓冲液,然后取出脑组织置于4%多聚甲醛中固定24 h;将脑组织制作成石蜡切片,60 ℃烘烤50 min,脱蜡至水后进行微波抗原修复,0.01 mol/L PBS缓冲液清洗3次,内源性过氧化物酶阻断剂溶液中室温孵育30 min;0.01 mol/L PBS缓冲液清洗3次,0.2%Triton-X100室温孵育25 min,然后用山羊血清在37 ℃孵育40 min以阻断非特异性结合位点,并用兔抗Claudin-5(1∶100)、兔抗Occludin(1∶100)、兔抗ZO-1(1∶100)、鼠抗CD-31(1∶200)在4 ℃下孵育过夜;次日用荧光二抗(Dylight-488羊抗兔1∶200,Dylight-594羊抗鼠1∶200)37℃孵育1 h;0.01 mol/L PBS缓冲液清洗3次,最后用含DAPI的抗荧光淬灭封片剂封片,激光共聚焦显微镜采集图像并进行分析。
1.2.6 Pull-Down 实验 根据RhoA活化测定生化试剂盒说明,通过Pull-Down实验评估RhoA活性。取等量的杏仁核组织总蛋白(300~800 μg),加入15 μL珠子,混匀并置于旋转摇床上,4 ℃孵育1 h;5000 g,4 ℃离心1 min,以沉淀珠子;去除90%的上清,再加入500 μL Wash Buffer 对珠子快速进行清洗;5000 g,4 ℃离心1 min,以沉淀珠子;除去绝大部分上清,每管中均加入20 μL 2×Laemmli sample buffer彻底重悬珠子,将珠子样品放入100 ℃加热模块中煮沸变性5 min;得到的样品用于后续SDS-PAGE凝胶中电泳和Western blot分析。
1.2.7 Western blot 检测紧密连接蛋白和Rho/ROCK通路蛋白的表达 大鼠腹腔注射2%的戊巴比妥钠(40 mg/kg)进行麻醉,打开大鼠腹腔,经腹主动脉穿刺取血后立即处死,并快速取出脑组织置于冰上,参照第六版[18]大鼠脑立体定位图谱,快速分离双侧杏仁核,称重后放入预冷的EP管中,加入裂解液混合物100 μL/100 mg,用电动研磨器研磨成匀浆,冰上静置30 min使其充分裂解,4 ℃高速离心机12 000 g/min,离心10 min,收集上清,即为杏仁核组织总蛋白。将收集的总蛋白用BCA 蛋白测定试剂盒计算蛋白浓度,然后按照常规Western blot法进行蛋白定量实验,其中一抗孵育如下:(GAPDH (1∶2000),ZO-1(1∶1000),Claudin-5(1∶500),Occludin(1∶500),RhoA(1∶100),ROCK2(1∶1000),MLC2(1∶1000),p-MLC2(1∶1000)),4 ℃冰箱过夜,二抗孵育如下:荧光二抗(1∶10000稀释)37 ℃避光孵育1 h;最后用Azure C500激光成像系统采集图像。
1.2.8 透射电子显微镜检测超微结构的改变 大鼠腹腔注射2%的戊巴比妥钠(40 mg/kg)进行麻醉,心脏灌注37 ℃生理盐水150 mL(0.9%NaCl),再灌注含有2%多聚甲醛和2.5%戊二醛的0.1 mol/L磷酸盐缓冲液(PBS,pH=7.4);灌注后取出脑组织,并分离双侧杏仁核,用4%戊二醛固定4 h;用1/15 mol/L磷酸盐缓冲液洗涤3次,10 min/次,用1%四氧化锇在4 ℃下固定2 h;然后用1/15 mol/L磷酸盐缓冲液再次洗涤3次,10 min/次,并用丙酮梯度逐渐增加的方式脱水;用包埋液和丙酮浸泡组织,用纯树脂37 ℃孵育24 h,60 ℃孵育48 h,完成聚合;随后用莱卡UC-7超微切片机将样品切成50 nm的超薄切片,乙酸铀酰染色40 min,柠檬酸铅染色30 min。最后,用透射电子显微镜(Hitachi H7500)观察和采集图像。
1.3 统计学分析
采用SPSS23.0进行统计学分析,所有数据以均数±标准差表示。当方差齐时,采用单因素方差分析进行多组间比较,并采用Tukey post hoc test进行两两比较;当方差不齐时,多组比较采用Kruskal-Wallis检验,并采用Dunn's multiple comparison test 进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 血清CORT的改变和EPM检测结果
ELISA结果显示,与Control组相比,Stress组(P<0.001)和Stress+Fasudil(P<0.001)组血清CORT水平显著升高(图1A)。EPM 结果显示,与Control 组比较,Stress组(P<0.001)和Stress+Fasudil组(P<0.001)大鼠开放臂停留时间百分率和大鼠进入开放臂次数百分率均明显降低(图1B~D)。
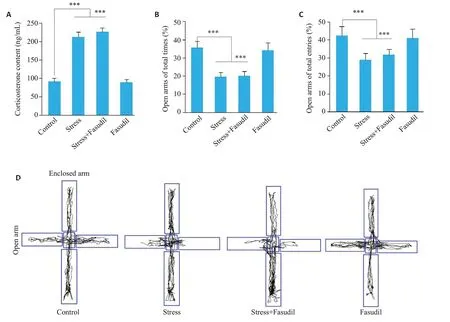
图1 束缚应激和法舒地尔对大鼠血清CORT和焦虑样行为的影响Fig.1 Effect of restraint stress and fasudil on serum CORT level and anxiety-like behavior of SD rats.A:Comparison of serum CORT levels among the 4 groups.B:Comparison of EPM ratio of time spent in the open arms time versus the total time.C:Comparison of EPM ratio for open arms entries versus the total entries.D:EPM movement track of the rats in each group.***P<0.001,n=15.
2.2 Fasudil 抑制束缚应激诱导的血脑屏障通透性的增加
与Control 组相比,Stress 组EB 的含量显著增加(P<0.01),而与Stress组相比,Stress+Fasudil组EB含量显著降低(P<0.01,图2A);同时,Stress组血清S100B的含量显著高于对照组(P<0.01),而Stress+Fasudil组血清S100B的含量显著低于Stress组(P<0.05,图2B)。
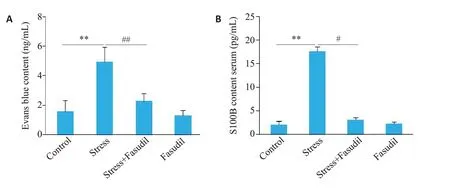
图2 法舒地尔对束缚应激大鼠杏仁核血脑屏障通透性的影响Fig.2 Effect of fasudil on BBB permeability in the amygdala in rats with restraint stress.A:Quantitative analysis of Evans Blue(EB)leakage in the amygdala.B:Comparison of serum S100B levels among the 4 groups.**P<0.01,#P<0.05,##P<0.01(n=15).
2.3 Fasudil抑制束缚应激诱导的血脑屏障紧密连接蛋白的表达降低
Western blot结果显示:与Control组相比,Stress组Claudin-5(P<0.01)、Occludin(P<0.01)、ZO-1(P<0.001)的表达水平显著降低,而与Stress 组相比,Stress+Fasudil组紧密连接蛋白Claudin-5(P<0.05)、Occludin(P<0.001)、ZO-1(P<0.01)的表达水平明显上调(图3)。免疫荧光染色结果显示:Stress 组紧密连接蛋白Claudin-5(P<0.05)、Occludin(P<0.05)、ZO-1(P<0.01)的免疫荧光强度显著低于Control组,而与Stress组相比,Stress+Fasudil组紧密连接蛋白Claudin-5(P<0.05)、Occludin(P<0.05)、ZO-1(P<0.01)的免疫荧光强度显著升高(图4)。
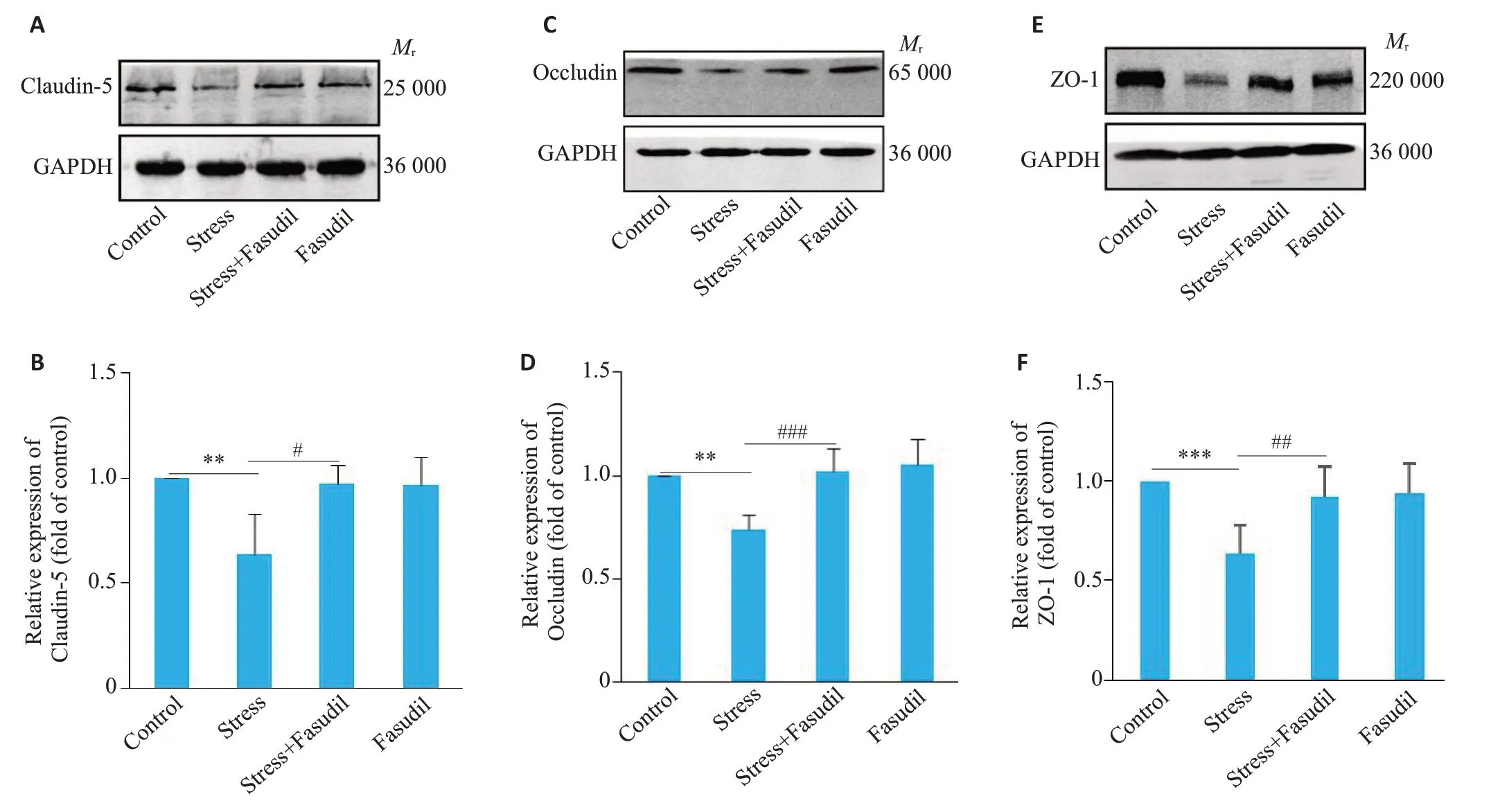
图3 大鼠杏仁核紧密连接蛋白的Western blot和灰度分析Fig.3 Western blotting for tight junction proteins in the amygdala of the rats.A,C,E:Western blot of claudin-5,occludin and ZO-1.B,D,F:Gray scale analysis of the proteins.**P<0.01,***P<0.001,#P<0.05,##P<0.01,###P<0.001(n=15).
2.4 束缚应激诱导Rho/ROCK信号通路的激活
Pull-Down和Western blot实验结果显示:Stress组RhoA-GTP蛋白(P<0.001)和ROCK2蛋白(P<0.001)表达水平均显著高于Control 组,而与Stress 组相比,Stress+Fasudil组RhoA-GTP 蛋白(P<0.05)和ROCK2蛋白(P<0.001)表达水平又显著降低(图5A~D)。Stress组p-MLC2表达水平显著高于Control组(P<0.05),束缚应激引起了MLC2的磷酸化,而给予Fasudil处理后,束缚应激大鼠的MLC2磷酸化水平显著降低(P<0.05,图5E、F)。
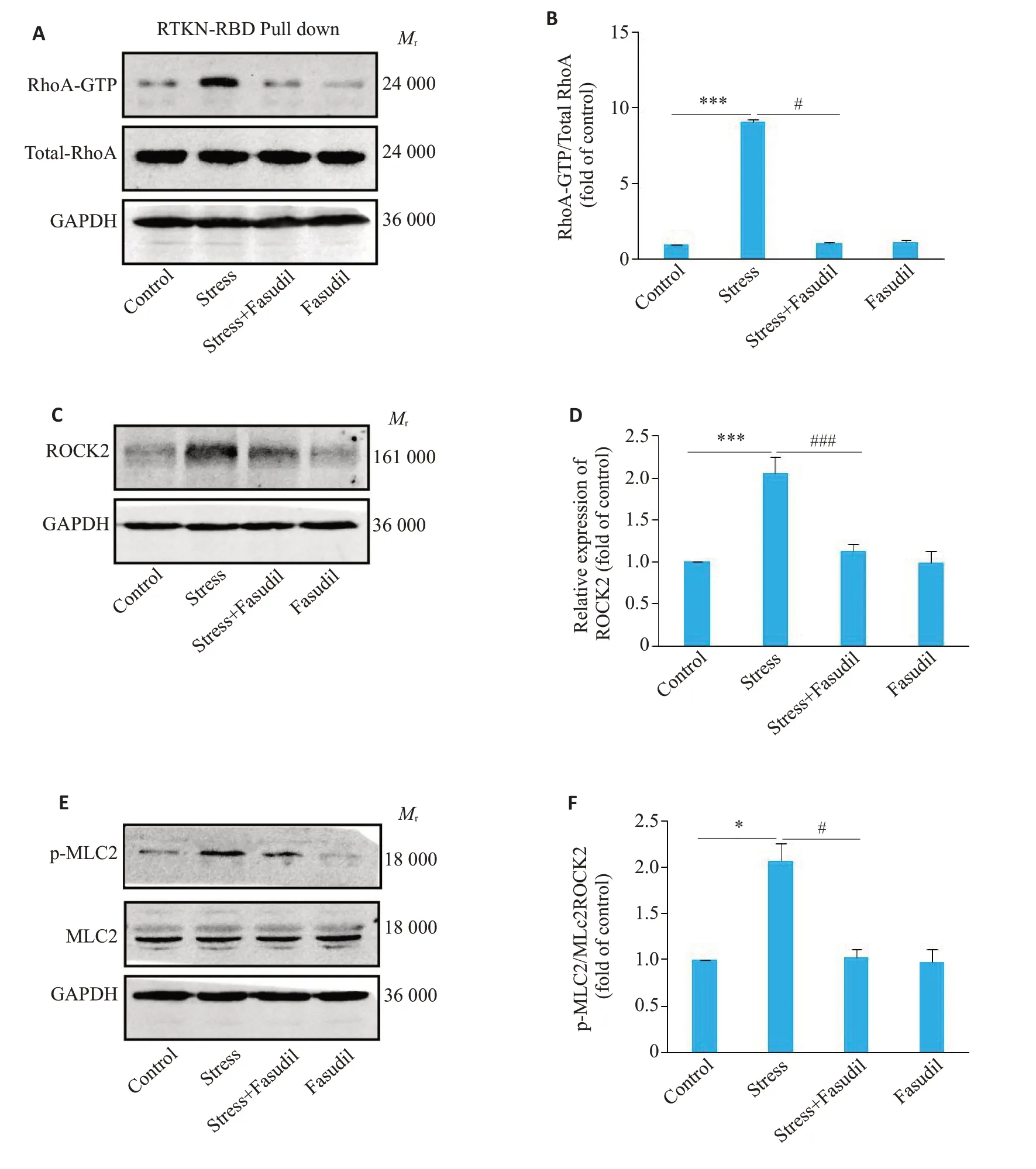
图5 束缚应激诱导大鼠杏仁核Rho/ROCK信号通路的激活Fig.5 Restraint stress induces activation of the Rho/ROCK signaling pathway in the amygdala of rats.A, C, E: Western blots Rho/ROCK signaling pathway proteins in the 4 groups. B, D, F: Gray scale analysis of RhoA-GTP,ROCK2 and p-MLC2.*P<0.05,***P<0.001,#P<0.05,###P<0.001(n=15).
2.5 透射电镜检测脑微血管超微结构的改变
透射电镜结果显示(图6),Control组微血管管腔光滑,基膜完整,紧密连接呈现出高密度影,表明血脑屏障结构完整。与Control组相比,Stress组大鼠的微血管超微结构发生显著改变,基底膜出现增厚或溶解现象,紧密连接的间隙明显增大,管腔膜光滑度降低,存在突起和粗糙现象。而给予Fasduil处理的Stress+Fasudil组和Fasudil组,微血管的形态结构都趋于正常。

图6 大鼠杏仁核血脑屏障透射电镜图Fig.6 Transmission electron microscopy of the BBB in the amygdala of the rats(E,brain microvascular endothelial cells;P,pericytes;IBM,intact basal membrane;DBM,dissolved basal membrane;TBM,thickened basal membrane;TJ,tight junction).Black arrows indicate intact tight junctions,red arrows indicate discontinuous or open tight junctions,black pentagrams indicates smooth luminal membrane,and red pentagrams indicates luminal membrane protrusions(scale bar=500 nm).
3 讨论
应激对中枢神经系统的损伤一直是国内外学者聚焦的研究重点,适度应激能够为机体提供保护作用,但是持续的慢性应激能够引起中枢神经系统疾病的发生[19,20],强烈的急性应激甚至可以直接引起中枢神经系统的紊乱[21]。很多研究报道应激能够通过内质网应激和氧化应激通路[22,23],引起中枢神经系统的损伤,也有学者认为炎症反应是应激引起中枢神经系统损伤的关键因素[24]。近期研究显示,应激能够诱导大鼠血脑屏障的形态学改变[25]和小鼠的脑血管体积减少,血脑屏障通透性增加[26],本室最新研究也证实应激可引起大鼠血脑屏障的结构和功能的损伤,这与文献报道是一致的[12]。血脑屏障的损伤很有可能是应激引起中枢神经系统损伤的又一重要因素。然而,应激导致血脑屏障破坏的机制尚不完全清楚,故本研究进一步探讨应激引起血脑屏障损伤的内在机制。
Rho/ROCK信号通路能够调节血管内皮细胞通透性,参与多种病理生理过程,在血脑屏障损伤过程中发挥着关键作用[16]。RhoA蛋白主要功能是与细胞骨架的动力与形态相关,其有两种状态,即GDP 结合态和GTP 结合态,只有当RhoA 蛋白与GTP 结合时,Rho/ROCK通路才会被激活,因此,RhoA-GTP蛋白表达增加提示Rho/ROCK通路被激活。ROCK(Rho激酶)是研究最为详细的RhoA蛋白下游靶效应分子之一[27],通过对肌球蛋白轻链(MLC)直接磷酸化,在介导RhoA下游肌动蛋白细胞骨架重排中发挥重要作用。研究最为广泛的ROCK亚型主要是ROCK1和ROCK2,ROCK1广泛表达于非神经组织,包括心脏、肺和骨骼肌,而ROCK2主要表达于脑组织[28]。RhoA 与GTP 结合后激活下游的ROCK,上调磷酸化肌球蛋白轻链(p-MLC)水平[29],使内皮细胞骨架重新分布,导致血管内皮通透性增加,屏障作用减弱[30,31]。综上,Rho/ROCK信号通路的激活主要表现为RhoA-GTP蛋白以及ROCK2蛋白的表达水平增加,同时,MLC2的磷酸化水平增加。因此,本研究通过Pull-down实验将GTP结合态的RhoA蛋白分离,然后对RhoA-GTP蛋白、ROCK2蛋白以及MLC2的磷酸化水平进行定量分析,结果显示Stress组的RhoA-GTP蛋白、ROCK2蛋白以及p-MLC2的含量均显著高于对照组,表明应激提高了RhoA-GTP蛋白和ROCK2蛋白的表达水平,并且MLC2磷酸化水平显著升高,这充分证明束缚应激激活了Rho/RCOK信号通路。
Fasudil是Rho/ROCK信号通路的特异性抑制剂,能够有效阻断Rho/ROCK通路的激活[32]。本研究通过腹腔注射Fasudil,阻断大鼠杏仁核Rho/ROCK通路的激活,并对杏仁核血脑屏障的损伤情况进行检测,以明确束缚应激是否通过激活Rho/ROCK通路,导致了杏仁核血脑屏障的损伤。我们首先检测了EB的渗漏情况以及血清S100B的含量,探讨Fasudil对束缚应激大鼠杏仁核血脑屏障通透性的影响。结果发现,Stress组EB的含量和血清S100B 水平显著高于Control 组,而与Stress 组相比,Stress+Fasudil 组又显著降低,表明Fasudil能够抑制束缚应激诱导的大鼠杏仁核血脑屏障通透性的升高。其次,通过检测血脑屏障紧密连接蛋白的表达变化发现,与Control组相比,Stress组紧密连接蛋白的表达水平显著降低,而与Stress组相比,Stress+Fasudil组紧密连接蛋白的表达水平又明显上调,这充分证明Fasudil能够抑制束缚应激引起的杏仁核血脑屏障紧密连接蛋白表达水平的降低,从而保护了血脑屏障的结构。最后,用透射电镜技术对血脑屏障的超微结构进行了检测,结果显示Control 组微血管管腔完整,Stress组大鼠的微血管超微结构发生了显著改变,而给予Fasduil处理的Stress+Fasudil组和Fasudil组,微血管的形态结构均较为正常,该结果使我们更为直观的观察到束缚应激引起血脑屏障超微结构出现了不同程度的形态学改变,而Fasudil能够抑制血脑屏障超微结构的损伤。上述结果均证实,Fadusil能够抑制束缚应激引起的大鼠杏仁核血脑屏障结构和功能的损伤。同时,大鼠注射Fasudil后,Stress+Fasudil组RhoA-GTP、ROCK2以及p-MLC2 的表达也显著低于Stress 组,充分证明Fasudil抑制了束缚应激引起的Rho/ROCK通路的激活。
本研究通过构建大鼠束缚应激模型,并从血脑屏障的结构和功能两方面展开深入研究,首次证实Rho/ROCK信号通路介导了束缚应激诱导大鼠杏仁核血脑屏障结构和功能的损伤,这为应激诱导血脑屏障损伤的研究提供了新的思路和参考,可能是未来中枢神经系统疾病治疗的新策略之一。
