抑制dmPAG 区谷氨酸能神经元可减轻创伤后应激障碍小鼠的过度防御反应
2024-04-13李言响郭永馨曹福羊郭舒婷薛丁豪周志康郝新宇
李言响,郭永馨,曹福羊,3,郭舒婷,薛丁豪,周志康,郝新宇,仝 黎,傅 强
1解放军总医院第一医学中心麻醉科,北京 100853;2解放军陆军第七十一集团军医院麻醉科,江苏 徐州 221004;3解放军总医院第六医学中心麻醉科,北京100048
创伤后应激障碍(PTSD)是由创伤性事件引起的一种精神障碍类疾病,主要症状表现为闪回、逃避、警觉性增高、消极情绪和负面认知等[1]。PTSD的患病率在一般人群中为6%~8%,患者若缺乏治疗会导致社会功能严重受损,如药物滥用、焦虑抑郁、自杀率升高等[2,3]。因此,迫切需要研究PTSD 的发病机制,寻找有效的治疗方案。
已有研究发现,丘脑皮质环路调控PTSD后过度防御反应,抑制高阶丘脑到额叶联合皮质的神经通路可降低PTSD 小鼠的防御反应[4]。恐惧记忆消退障碍是PTSD发病的主要诱发因素,这和中脑功能密切相关,然而中脑是否介导PTSD后过度防御反应尚待进一步探索[5,6]。背内侧中脑导水管周围灰质(dmPAG)调节先天性恐惧,以爆发放电模式参与恐惧情绪的调节,啮齿类动物暴露于捕食者的威胁之下dmPAG激活诱发逃跑行为[7,8],而dmPAG是否参与PTSD过度防御反应的调控尚未研究清楚。
谷氨酸能神经元的活动是PTSD病理生理学的重要机制之一。已有研究证实,基底外侧杏仁核谷氨酸能神经元参与恐惧调控,下丘脑前区、腹侧被盖区谷氨酸能神经元参与防御行为调控[9-11]。明确dmPAG区谷氨酸能神经元的作用机制,有利于拓展PTSD的治疗策略。
本研究通过构建单效长时程应激模型(SPS)模拟PTSD的生理和情绪状态[12],特异性激活或抑制dmPAG区谷氨酸能神经元,验证其在防御行为中的作用,从而证实了dmPAG可能是PTSD过度防御反应的关键脑区。
1 材料和方法
1.1 实验动物
8周龄雄性C57BL/6小鼠,体质量22~24 g,购自斯贝福(北京)生物科技有限公司,饲养于解放军总医院第一医学中心麻醉科实验室。室温22±2 ℃,湿度40%±10%,12 h/12 h光照/黑暗循环,所有动物自由进食和饮水。实验操作符合《实验动物和动物实验管理条例》,根据本研究所动物实验指南进行,方案得到了动物实验伦理委员会的批准(SQ2022268)。
1.2 实验试剂与材料
七氟醚(百特),戊巴比妥钠(Merck),CNO(枢密);实验所用病毒:rAAV2/9-CaMKII-mCherry、rAAV2/9-CaMKII-hM3Dq-mCherry、rAAV2/9-CaMKII-hM4DimCherry(和元);5%驴血清(白鲨生物),Triton X-100(索莱宝),PBST(阳光英锐),Glu 一抗(GTX66489,GeneTex),c-fos一抗(ab208942,Abcam),免疫荧光二抗(Alexa Fluor488,山羊抗兔IgG,abcam;cy3,驴抗小鼠IgG,赛维尔),DAPI(索莱宝)。立体定位仪(RWD68046),微量注射泵(哈佛仪器泵11 Elite),微量注射器(汉密尔1701RN),荧光共聚焦显微镜(奥林巴斯FV1000)。
1.3 实验动物分组
将84只雄性C57BL/6J小鼠随机分为12组,7只/组。研究PTSD后过度防御反应时,CON组不作处理,PTSD组SPS造模,14 d后进行行为学实验和免疫荧光染色。通过立体定位技术向小鼠dmPAG区注射病毒,实现对该脑区谷氨酸能神经元活性的特异性调控。研究激活dmPAG区谷氨酸能神经元对防御行为影响的实验中,分为CON NS组、CON mCherry 组、PTSD mCherry 组和PTSD hM3Dq 组,CON NS 组不造模,CON mCherry 组注射mCherry 对照病毒但不造模,PTSD mCherry 组注射mCherry 对照病毒并在2 周后SPS造模,PTSD hM3Dq组注射携带hM3Dq基因片段的腺相关病毒并在2周后SPS造模,造模后14 d进行行为学实验。研究抑制dmPAG区谷氨酸能神经元对防御行为影响的实验中,分为CON NS 组、CON mCherry组、PTSD mCherry组和PTSD hM4Di组,CON NS组不造模,CON mCherry组注射mCherry对照病毒但不造模,PTSD mCherry组注射mCherry对照病毒并在2周后SPS造模,PTSD hM4Di组注射携带hM4Di基因片段的腺相关病毒并在2周后SPS造模,造模后14 d进行行为学实验(图1)。
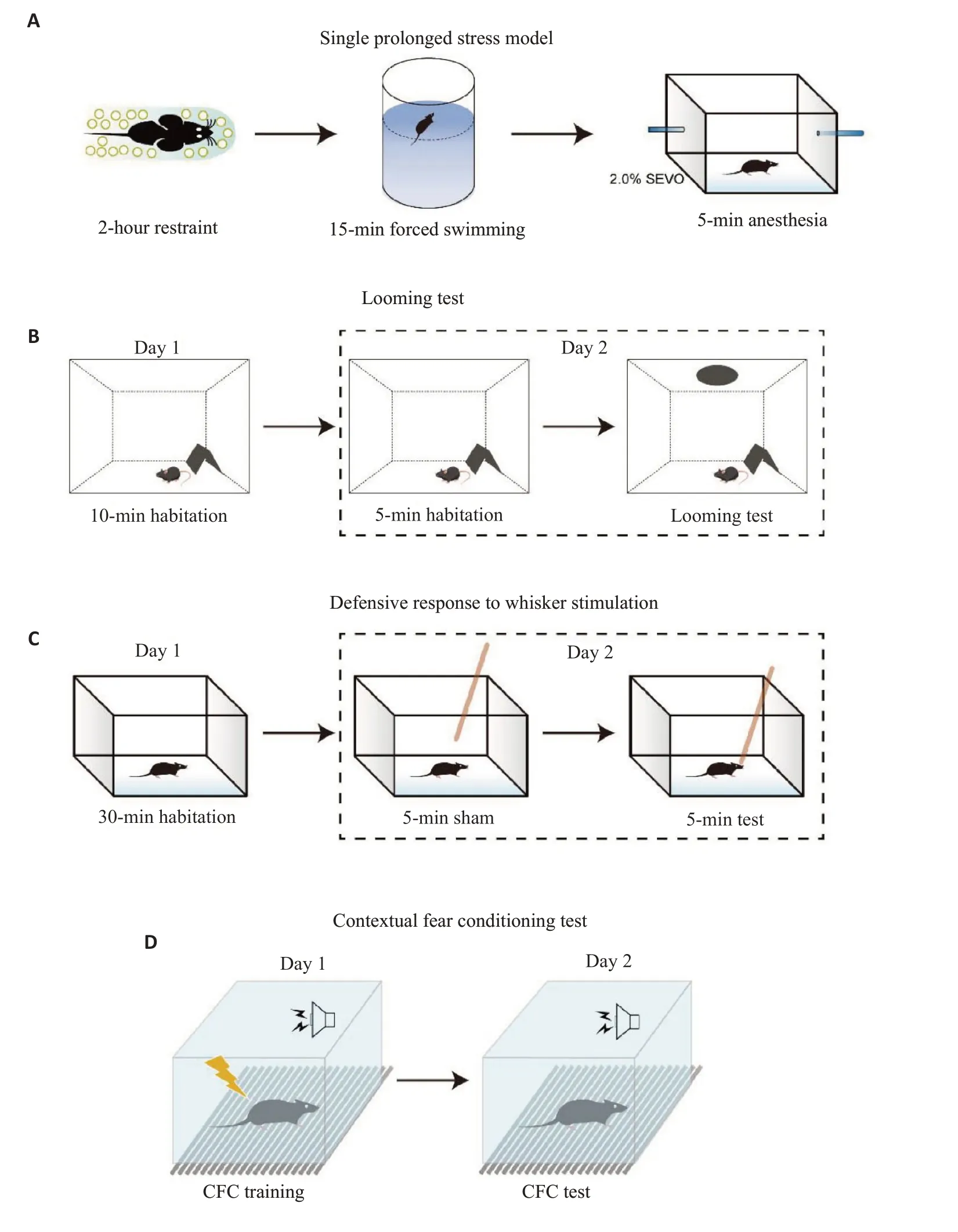
图1 SPS造模流程及行为学实验示意图Fig.1 Schematic illustration of protocols of post-traumatic stress disorder (PTSD) modeling and behavioral tests of the mice.A: PTSD modeling of the mice with single prolonged stress(SPS). B: Looming test. C: Test of defensive responses to whisker stimulation. D: Contextual fear conditioning(CFC)test.
1.4 SPS模型构建
动物在50 mL离心管中束缚2 h,离心管留有多个通气孔。随后进行15 min的强迫游泳,水温23±1 ℃。动物休息15 min后2%七氟醚吸入麻醉,保证动物刺激足底无反应,静默14 d后进行防御相关行为学测试[13]。
1.5 行为学测试
1.5.1 视觉本能恐惧实验 测试箱顶部放置一液晶显示屏,箱内放置一个可供动物躲避的巢穴。小鼠移动到巢穴对角象限时,通过显示屏给予looming刺激,记录动物的回巢潜伏期和刺激后1min内躲藏于巢穴的时间。
1.5.2 触须刺激实验 笼框内用木棍刺激小鼠的触须并用摄像机记录,每只小鼠重复测试3次,间歇休息5 min。统计小鼠的5种防御行为:僵直,逃跑,过度呼吸,攻击木棍,站立防卫。评分标准为:0分,无该行为;1分,行为较少发生;2分,观察期间频繁出现。3次测试的平均分为防御反应评分。
1.5.3 条件恐惧实验 训练阶段,小鼠适应恐惧箱2 min,然后在1次声音刺激(75 dB,4500 Hz,180 s)后进行一次足底电击(0.8 mA,2 s),重复循环3次,间歇休息60 s。第2天进行条件恐惧测试,小鼠适应恐惧箱2 min后,给予1次声音刺激(75 dB,4500 Hz,180 s),记录随后60 s内的僵直不动时间,重复循环3次。
1.6 化学遗传技术与立体定位注射
激活dmPAG区谷氨酸能神经元活性,CON NS组不注射病毒,CON mCherry组和PTSD mCherry组注射对照病毒到双侧dmPAG 区,PTSD hM3Dq 组注射hM3Dq腺相关病毒到双侧dmPAG区。抑制dmPAG区谷氨酸能神经元活性,CON NS 组不注射病毒,CON mCherry 组和PTSD mCherry组注射对照病毒到双侧dmPAG区,PTSD hM4Di组注射hM4Di腺相关病毒到双侧dmPAG区。
小鼠用1%戊巴比妥钠50 mg/kg腹腔注射麻醉后,放置在立体定向仪上。用微量注射泵和10 μL微量注射器以40 nL/min的速度注射病毒,双侧核团总注射量为150 nL。注射结束后,注射器固定10 min慢慢取出,间断缝合伤口。病毒转染1月,行为学测试前1 h,注射过病毒的小鼠按1 mg/kg腹腔注射CNO以激活病毒的表达,起到激活或抑制谷氨酸能神经元的作用,CON NS 组腹腔注射与CNO 等体积的0.9%生理盐水排除CNO对行为学的影响。
1.7 免疫荧光染色
在验证dmPAG区谷氨酸能神经元c-fos表达的实验中,触须刺激实验后1.5 h断头取材,免疫荧光染色。验证病毒在dmPAG区转染情况的实验中,行为学实验完成后灌注取脑,切片染色。
小鼠用1%戊巴比妥钠麻醉(50 mg/kg,腹腔注射)后,0.9%生理盐水和4%多聚甲醛经心内灌注,取脑组织在PBS中用20%和30%蔗糖梯度脱水。冷冻切片机制作15 mm的脑组织切片,脑片用PBS洗涤3次,与5%驴血清在含0.3%Triton X-100的PBST中孵育2 h,然后在4 ℃下与Glu一抗(兔,1∶500),c-fos一抗(鼠,1∶1000)稀释液孵育过夜。在PBS中清洗一抗3次,然后26 ℃暗室中孵育二抗(山羊抗兔IgG,1∶200;驴抗小鼠IgG,1∶200)2 h。最后,用DAPI封存脑片,通过荧光共聚焦显微镜观察切片。
1.8 统计学分析
为了避免数据分析过程中产生偏倚采取盲法,实验执行人员不知道小鼠的分配顺序,统计分析人员不知道干预手段。使用GraphPad Prism 8.0对结果进行统计分析并作图,正态分布检验采用Shapiro-Wilk检验,方差齐性检验采用Levene's检验,满足以上两个条件,两组间比较采用t检验,多组比较采用单因素方差分析和Bonferroni多重比较检验。非正态分布的数据进行非参数检验。数据用均数±标准差表示,P<0.05认为差异具有统计学意义。
2 结果
2.1 PTSD小鼠表现出过度增强的防御行为
PTSD组小鼠SPS造模,静默14 d后进行行为学测试。在视觉本能恐惧实验中,与对照组相比PTSD组回巢潜伏期显著缩短(P<0.001,图2B),巢内停留时间百分比增加(P<0.05,图2C)。在触须刺激实验中,与对照组相比PTSD组防御反应评分明显升高(P<0.001,图2D)。在条件恐惧实验中,与对照组相比PTSD组听觉刺激诱发的僵直时间百分比高于对照组(P<0.01,图2E)。

图2 PTSD小鼠存在过度增强的防御行为Fig.2 PTSD mice exhibit excessive defensive behaviors. A: Procedure for testing defensive behaviors. B:Latency of flight to nest.C:Percentage of time spent in nest after looming stimulation.D:Response score of defensive behaviors.E:Percentage of freezing time in CFC test.**P<0.01,***P<0.001 vs CON group.
2.2 dmPAG区谷氨酸能神经元在PTSD小鼠过度防御行为中起重要作用
触须刺激实验结束后1.5 h 后灌注取材,脑组织冰冻切片并进行免疫荧光染色。与对照组相比,PTSD组dmPAG 区谷氨酸能神经元c-fos 表达量百分数增高(P<0.001,图3C)。

图3 PTSD小鼠在防御行为中dmPAG区谷氨酸能神经元活性增强Fig.3 Activation of glutamatergic neurons in the dmPAG of PTSD mice exhibiting defensive behaviors.A:Procedure of modeling and tissue collection.B:Immunofluorescence staining of the dmPAG showing c-fos+neurons(arrows).C:Percentage of c-fos+glutamatergic neurons in the dmPAG.***P<0.001 vs CON group.
2.3 激活dmPAG区谷氨酸能神经元对PTSD小鼠过度防御反应的影响
化学遗传特异性激活dmPAG区谷氨酸能神经元活性,腹腔注射CNO后1 h进行行为学测试。视觉本能恐惧实验中,与PTSD mCherry 组相比PTSD hM3Dq组回巢潜伏期和巢内停留时间百分比无统计学差异(图4D、E)。触须刺激实验中,与PTSD mCherry组相比PTSD hM3Dq 组防御反应评分升高(P<0.05,图4F)。条件恐惧实验中,与PTSD mCherry 组相比PTSD hM3Dq 组僵直时间百分比增高(P<0.01,图4G)。灌注取脑,免疫荧光染色结果显示病毒在dmPAG区成功转染(图4B)。
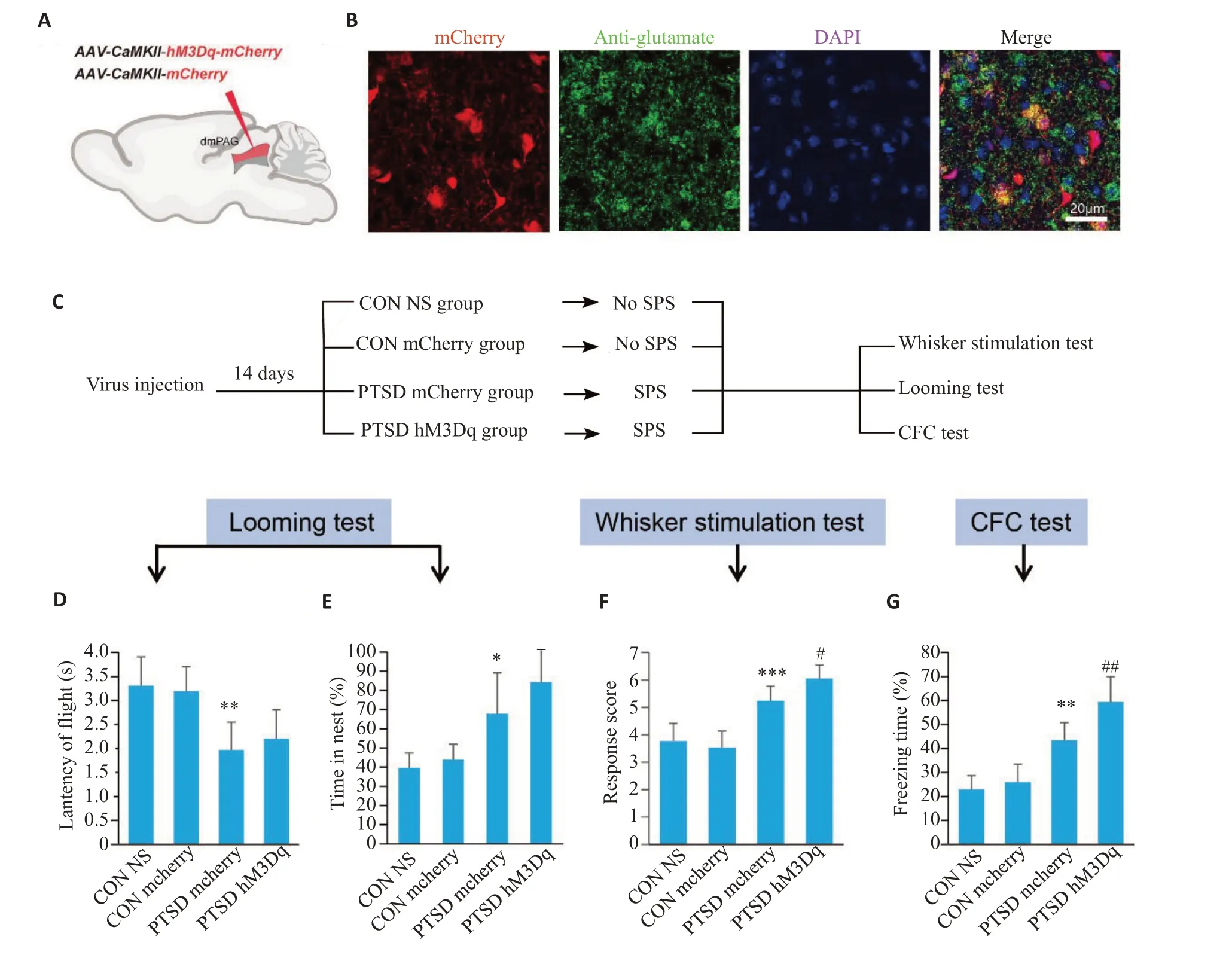
图4 化学遗传激活dmPAG区谷氨酸能神经元活性不能减轻PTSD小鼠过度增强的防御行为Fig.4 Chemogenetic activation of dmPAG glutamatergic neurons does not alleviate excessive defensive behaviors in PTSD Mice.A:Virus injection in the dmPAG.B:Expression of chemogenetic virus in the glutamatergic neurons.C:Procedure for testing defensive behaviors.D:Latency of flight to nest.E:Percentage of time spent in nest after looming stimulation.F:Response score of defensive behavior.G:Percentage of freezing time in CFC test.*P<0.05,**P<0.01,***P<0.001 vs CON group,#P<0.05,##P<0.01 vs PTSD mCherry group.
2.4 抑制dmPAG区谷氨酸能神经元对PTSD小鼠防御反应的影响
化学遗传特异性抑制dmPAG区谷氨酸能神经元活性,腹腔注射CNO后1 h进行行为学测试。视觉本能恐惧实验中,与PTSD mCherry组相比PTSD hM4Di组回巢潜伏期延长(P<0.05,图5D),巢内停留时间百分比降低(P<0.05,图5E)。触须刺激实验中,与PTSD mCherry 组相比PTSD hM4Di 组防御反应评分显著降低(P<0.01,图5F)。条件恐惧实验中与PTSD mCherry组相比PTSD hM4Di组僵直时间百分比显著降低(P<0.01,图5G)。灌注取脑,免疫荧光染色结果显示病毒在dmPAG区成功转染(图5B)。
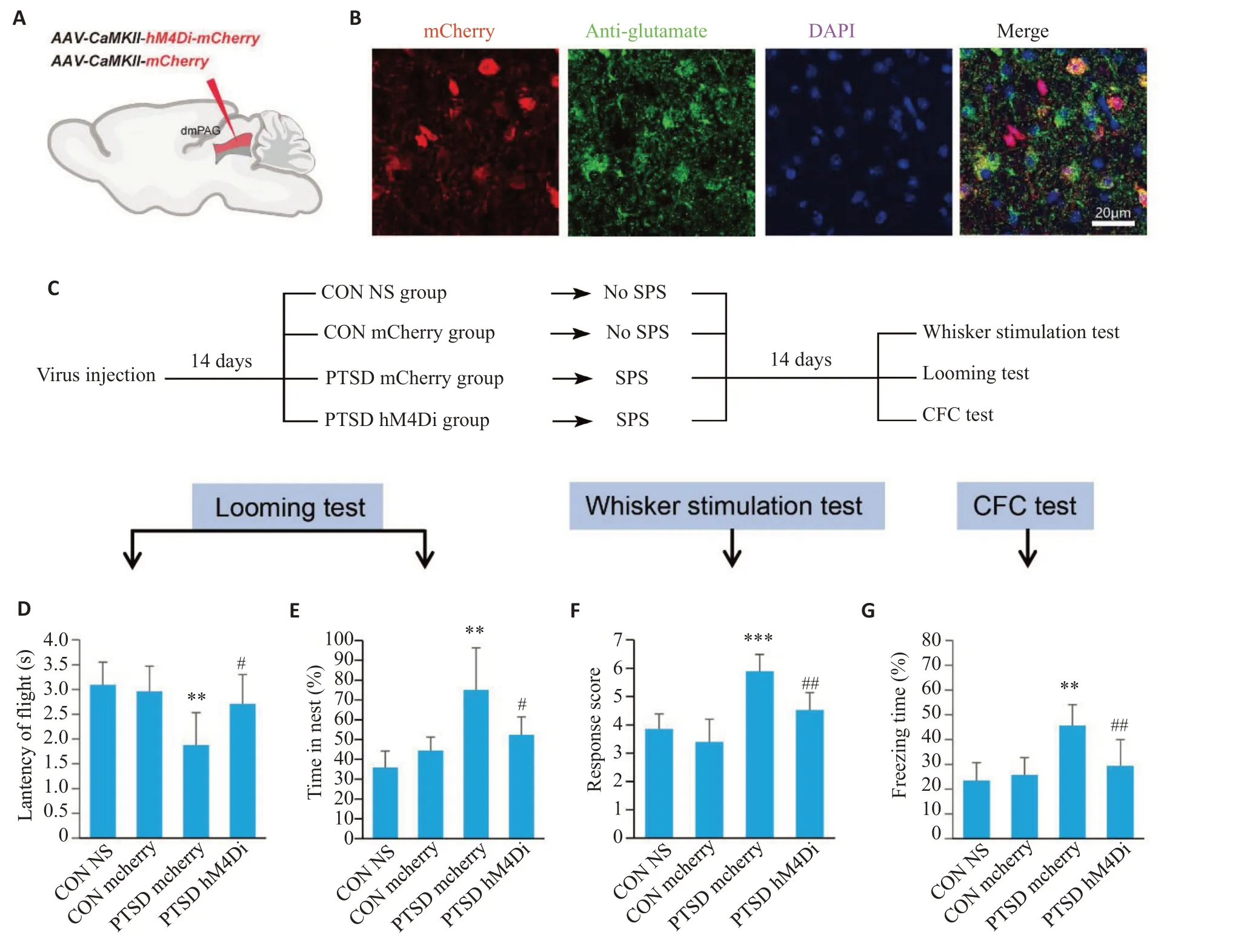
图5 化学遗传抑制dmPAG区谷氨酸能神经元活性可以减轻PTSD小鼠过度增强的防御行为Fig.5 Chemogenetic inhibition of dmPAG glutamatergic neurons alleviates excessive defensive behaviors in PTSD mice.A: Virus injection in the dmPAG. B: Expression of chemogenetic virus in the glutamatergic neurons. C: Procedure for testing defensive behaviors.D:Latency of flight to nest.E:Percentage of time spent in nest after looming stimulation.F:Response score of defensive behavior.G:Percentage of freezing time in CFC test.*P<0.05,**P<0.01,***P<0.001 vs CON group,#P<0.05,##P<0.01 vs PTSD mCherry group.
3 讨论
已有研究表明PTSD患者存在多种防御行为,如创伤后强直不动、听觉刺激诱发的心脏防御等[14,15]。SPS模型是一种广泛应用于PTSD分子机制和神经生物学研究的临床前模型,能够模拟PTSD后的恐惧记忆异常和焦虑抑郁状态,适合用于观察对PTSD的干预措施是否有效。我们的研究通过条件恐惧实验发现SPS造模的PTSD小鼠恐惧加剧,通过视觉本能恐惧实验和触须刺激实验发现PTSD小鼠对视觉和触觉刺激表现出过度增强的防御反应;免疫荧光染色结果显示PTSD小鼠防御反应后dmPAG区谷氨酸能神经元活性增高;化学遗传学特异性调控dmPAG区谷氨酸能神经元,发现激活dmPAG区谷氨酸能神经元活性PTSD小鼠仍然存在过度防御行为且触觉引起的防御反应增强,而抑制dmPAG区谷氨酸能神经元活性可以缓解PTSD后的恐惧情绪,减轻视觉和触觉诱发的过度防御行为。
神经环路异常是PTSD的发病机制之一[16]。PAG区编码恐惧记忆,调节疼痛,在应激状态中发挥重要作用,这些功能与PTSD的主要症状高度相关[17,18]。PAG按解剖结构可分为背内侧、背外侧、外侧和腹外侧等不同的亚区,其中dmPAG介导逃避和攻击行为[19,20]。据报道,内侧前额叶皮质、杏仁核、伏隔核和PAG之间的神经网络可能对PTSD恐惧记忆的形成起重要作用,dmPAG和杏仁核之间的信号输出增加可能是PTSD 的诱发因素之一[21,22];fMRI结果显示,PTSD患者即使在安静状态下也观察到背外侧中脑导水管周围灰质和腹外侧中脑导水管周围灰质与涉及情绪调控的脑区背侧前扣带回存在功能连接[23];一项临床研究发现,遭遇创伤后2周背外侧中脑导水管周围灰质与顶叶的静息态功能连接可以前瞻性预测PTSD的过度觉醒症状[24]。由此可见PAG是PTSD症状发展的关键脑区,过去关于PTSD的研究多集中于恐惧,而本研究进一步聚焦于恐惧情绪衍生出的过度防御反应,通过实验发现dmPAG区参与PTSD过度防御的调控。
PAG是一种中脑结构,中脑其他核团也有关于调控防御反应的报道,如中脑腹侧被盖区参与调控危险情况下的僵直和逃跑行为,楔形核是位于PAG尾部外侧的中脑结构,介导先天性僵直和抗掠食反应,激活上丘的小白蛋白阳性神经元促进视觉诱发的逃跑和僵直行为[25-28]。以上结果表明中脑调控防御行为,本研究进一步强调了中脑对PTSD过度防御反应的重要作用。防御行为不止局限在中脑水平,更涉及前脑与中脑的相互连接,如激活基底前脑到腹侧被盖区的谷氨酸能神经投射,可以诱导逃跑、躲藏等情境相关防御行为[29]。抑制下丘脑内侧区下丘脑前核的vGAT神经元到vlPAG区的投射,诱发面对伤害的防御性攻击行为[30]。本研究主要围绕dmPAG在PTSD过度防御反应中的作用,未来会进一步探索中脑导水管周围灰质相关神经环路对PTSD后情绪和行为的调控作用。
谷氨酸能神经系统功能紊乱是PTSD的发病机制之一[31]。谷氨酸能神经元释放兴奋性递质谷氨酸到突触间隙,产生兴奋性突触后电流对大脑皮质细胞有普遍而强烈的兴奋作用。许多关于PTSD药物治疗的研究围绕谷氨酸能神经系统展开,例如谷氨酸作用受体N-甲基-D-天门冬氨酸受体的正向调节剂NYX-783,作用于内侧前额叶皮层减少PTSD 小鼠恐惧的自发性恢复[32];盐酸美金刚可以改善PTSD患者的情绪调节及认知功能,可能是通过抑制谷氨酸能神经元活性发挥作用的[33]。目前PTSD的药物治疗多依据症状选用抗抑郁药,抗焦虑药或镇静剂等,本研究证实了dmPAG区谷氨酸能神经元对PTSD 过度防御行为的调控作用,为PTSD的治疗提供了新的潜在靶点。
神经科学的手段运用于PTSD机制及治疗的研究具有可行性,但本研究仍存在一定的局限性,如实验动物仅选取雄性小鼠,未探究性别对PTSD症状的影响。综上所述,dmPAG区的谷氨酸能神经元参与调控PTSD过度防御反应,中脑微环路的神经调控机制为治疗PTSD精神症状提供新思路。
