心脏磁共振成像对急性ST 段抬高型心肌梗死后左心室不良重构的预测价值
2024-04-13崔佳宁刘文佳赵亚男陈伟杰罗春材张兴华
崔佳宁,刘文佳,闫 非,赵亚男,陈伟杰,罗春材,张兴华,李 涛
1中国人民解放军总医院第一医学中心放射诊断科,北京 100853;2首都医科大学附属北京积水潭医院放射科,北京 100035;3中国人民解放军联勤保障部队第九八五医院放射科,山西 太原030001
经皮冠状动脉介入(PCI)手术是治疗ST段抬高型心肌梗死(STEMI)的主要手段,它能恢复罪犯血管的血流,缩小梗死范围,减低病人近期死亡率,但其远期事件发生率仍然居高不下,STEMI引起的心肌损伤可以使左心室结构和功能发生不利改变,导致左心室不良重构[1-3],与患者长期死亡率增加有关[4,5]。因此,早期了解STEMI术后左心室不良重构个体风险,以便于对患者进行早期风险分层,从而改善患者的临床管理[6]。
心脏磁共振(CMR)是心脏形态学及功能学检查的金标准,可以准确评价心脏结构、功能及心肌的组织特征改变,具有信息量大、扫描视野宽、无辐射等优点[7,8]。心脏磁共振特征跟踪技术(CMR-FT)是一种新的后处理方法,通过跟踪稳态自由进动电影图像来分析心肌应变[9]。CMR-FT技术无需额外的扫描序列,后处理程序简洁方便,而且能够测量整体和区域的应变及应变率,具有更高的重复性[10,11]。目前已有研究发现STEMI患者的梗死区周向应变逐渐改善[12],但是通过CMR评估左心室不良重构患者左心室结构和功能的演变过程的研究较少。与此同时,CMR-FT测量的应变数据也显示出预测STEMI后左心室不良重构方面的前景[13,14]。有研究证明患者整体纵向应变(GLS)、整体径向应变(GRS)和整体周向应变(GCS)与左心室不良重构有显著相关性,而且GLS和GCS增强了传统CMR参数对STEMI术后左心室不良重构的预测能力[15,16],但是也有研究提出左心室应变数据与左心室不良重构的发展之间不存在显著相关性[17],所以左心室的心肌应变及应变率与左心室不良重构的关系存在一定争议,且目前缺乏整体和区域的左心室应变率预测左心室不良重构的研究。因此,本研究旨通过CMR提高STEMI术后左心室不良重构患者左心室结构与功能演变的认识,并进一步评价CMR对左心室不良重构的预测价值。
1 资料和方法
1.1 临床资料
本研究采用回顾性研究方法,已通过伦理审查委员会审批(伦理号:S2022-567-01),并免除知情同意。检索本院医学图像存档与传输系统和电子病历系统,整理2014年1月~2020年1月连续收治的STEMI患者。纳入标准:患者根据ESC/ACC委员会标准[18]被首次诊断为STEMI,并在胸痛发作后12 h内接受PCI治疗,且在住院时和出院后接受2次CMR检查;首次CMR扫描是在PCI治疗后7 d内进行,两次CMR扫描之间间隔3~6个月。排除标准:既往心肌梗死;既往接受过血运重建手术(冠状动脉搭桥术或PCI);未进行第2次CMR扫描;CMR图像质量较差。最终研究队列纳入86例患者,根据有无出现左心室不良重构将所有STEMI患者分为两组。左心室不良重构被定义为第2次CMR检查时左心室收缩末期容积(LVESV)较初始CMR 增加15%或更多[19]。患者在住院期间和出院后根据STEMI指南进行管理[2]。入组流程见图1。
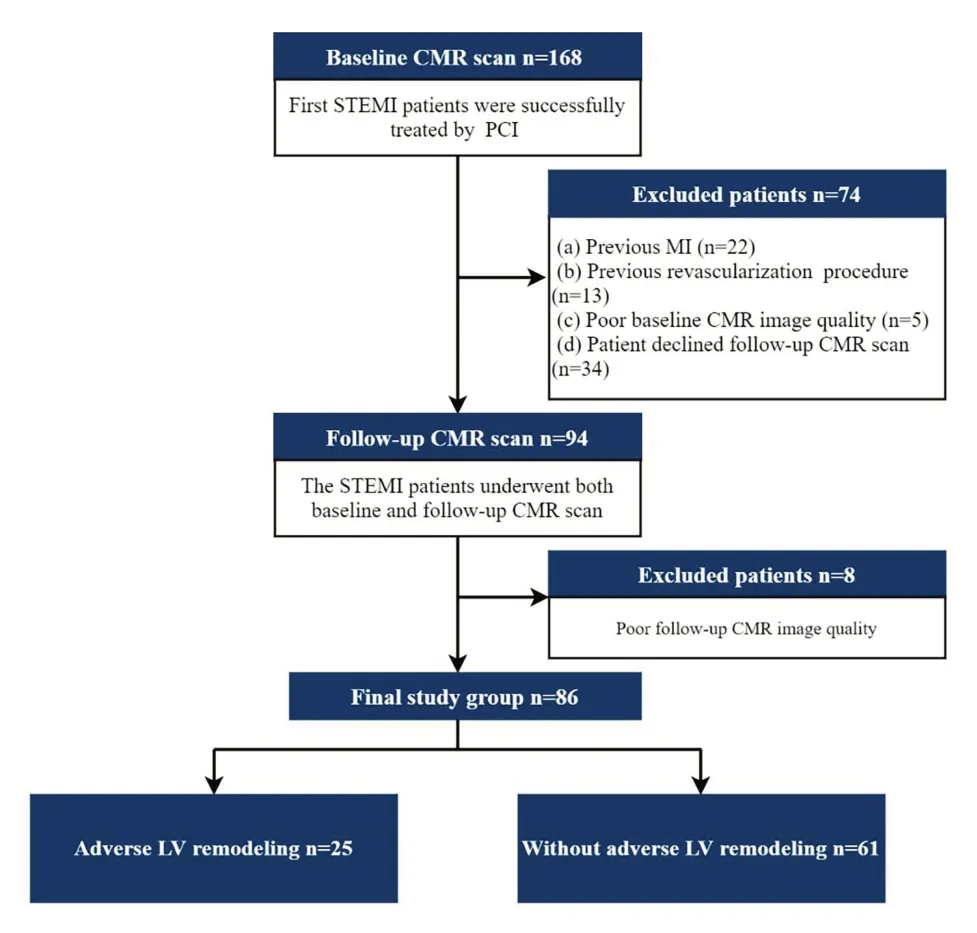
图1 患者入组流程Fig.1 Flowchart of patient enrollment.
1.2 CMR检查方法
采用1.5 T磁共振扫描仪(Multiva,Philips Medical Systems)对所有研究对象进行CMR 扫描。采用8通道表面相控阵线圈,心电触发及回顾性心电门控扫描患者。扫描序列:(1)电影序列:应用平衡式自由稳态进动序列(BTFE)采集短轴和长轴两腔心、三腔心、四腔心电影图像。短轴位共采集8~12层,覆盖左心室。采集参数:TR/TE 3.7/1.8 ms,翻转角60°,层厚8 mm,平面内分辨率1.4 mm×1.4 mm和FOV 320 mm×276 mm。(2)延迟增强扫描:在给予0.1 mmol/kg 造影剂(Gadopentetate Dimeglumine,BeiLu,Beijing)10~15 min后,采用相位敏感反转恢复序列(PSIR)采集延迟钆增强(LGE)图像,采集参数:TR/TE 6.2/3 ms,翻转角25°,层厚8 mm,平面内分辨率1.6 mm×1.6 mm和FOV 320 mm×282 mm。
1.3 CMR图像分析
采用后处理软件(cvi42 v5.3,Circle Cardiovascular Imaging)对所有心脏磁共振图像进行离线分析。
在电影序列短轴位,通过软件自动勾勒左心室心内膜和心外膜轮廓。如有偏离,通过手动调整轮廓来提高准确度。左心室的肌小梁和乳头肌被纳入腔内[20]。通过CMR-FT方法于连续短轴和长轴两腔心、三腔心、四腔心电影序列分析左心室应变和应变率。心肌应变率表示为心动周期各期相应变曲线的斜率,反映了心肌形变速度。峰值应变定义为整个心动周期内的最大绝对值。收缩期峰值应变率是指左心室收缩期中所有期相应变率的最大绝对值。舒张期峰值应变率是指心动周期的舒张期中所有期相应变率的最大绝对值。根据美国心脏协会推荐的左心室17节段模型(不含第17节段)可以获得节段峰值应变和应变率[20]。梗死区应变和应变率是梗死区心肌中所有节段的应变和应变率的中位数。
在连续短轴和长轴两腔心、三腔心、四腔心上获取LGE图像。LGE区域被定义为高于远端未受影响的心肌信号5个标准差以上的心肌区域[20]。梗死区被定义为有LGE的节段,遥远区被定义为位于同一层面没有LGE的节段。微血管阻塞(MVO)定义为高强化梗死区域内的低强化区域[20](图2)。

图2 STEMI患者的LGE图像Fig.2 LGE images of the patient with STEMI.
1.4 第2次CMR扫描
PCI术后平均5个月后进行第2次CMR扫描(3~6个月)(图3)。CMR扫描方案和图像分析方法与第1次CMR扫描一致。评估STEMI患者PCI治疗术后的左心室结构、功能、整体和节段应变、应变率以及组织特征的变化,分析左心室不良重构的预测因素。

图3 左心室不良重构患者PCI术后1周及5个月的CMR图像和应变分析图像Fig.3 CMR and strain analysis images at 1 week and 5 months after PCI in patients with adverse left ventricular remodeling.
1.5 临床随访
从第2次CMR扫描开始临床随访。主要结果被定义为全因死亡、卒中、因充血性心力衰竭和不稳定型心绞痛再入院,主要通过查阅医院记录或给患者及其家人打电话的方式获得。
1.6 统计学分析
使用SPSS 26.0 进行统计学分析。使用Shapiro-Wilk检验评估连续变量的正态性。符合正态分布的数据采用均数±标准差表示,组间比较采用t检验;非正态分布的数据以中位数(四分位间距)表示,组间比较采用Mann-WhitneyU检验;分类变量以例数或百分比表示,组间比较采用卡方检验。为评估左心室不良重构的独立预测因子,首先将所有基线临床资料和CMR参数进行单因素分析,筛选出与心肌梗死后左心室不良重构有关的因素,然后将入选的相关参数进行多因素Logistic回归分析,找出心梗后导致左心室不良重构的影响因素,最后使用受试者工作特征(ROC)曲线的曲线下面积(AUC)评估参数预测左心室不良重构的能力。
采用Kaplan-Meier曲线描述两组患者无主要不良心血管事件的发生率,Log rank检验比较两组患者生存曲线的差异。P<0.05为差异具有统计学意义。
2 结果
2.1 患者基线特征
研究共纳入86例患者,其中左心室不良重构组25例,无左心室不良重构组61例。左心室不良重构组峰值肌钙蛋白T和峰值肌酸激酶同工酶(CK-MB)大于无左心室不良重构组(P<0.05)。与无左心室不良重构组相比,左心室不良重构组出院后肾素血管紧张素醛固酮系统(RAAS)抑制剂使用率更低(P=0.001,表1)。CAD:Coronary artery disease;LAD:left anterior descending artery;LCX:Left circumflex artery;RCA:Right coronary artery;CK-MB:creatine kinase-MB;RAAS:Renin-angiotensin-aldosterone system.
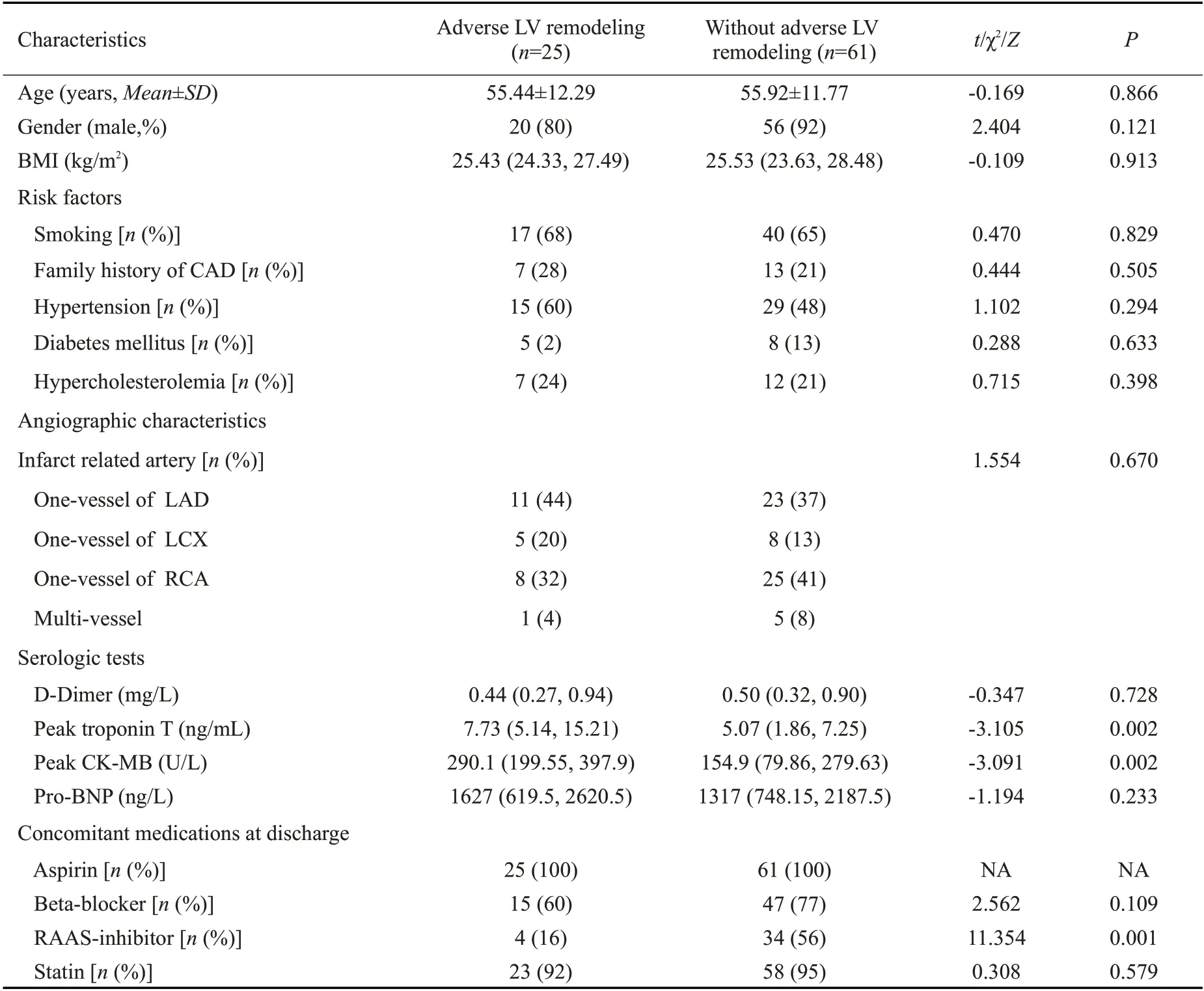
表1 基线资料Tab.1 Baseline characteristics of the patients with and without adverse left ventricular remodeling
2.2 左心室CMR参数比较
2.2.1 左心室结构和组织特征 在初始CMR时,两组的左心室容积指数、左心室射血分数(LVEF)、左心室心肌质量(LVMM)差异无统计学意义(P>0.05)。但左心室不良重构组梗死质量百分比和MVO质量百分比明显高于无左心室不良重构组(P<0.05)。在第2次CMR扫描时,左心室不良重构组有更大的左心室舒张末期容积指数(LVEDVI)、左心室收缩末期容积指数(LVESVI)、梗死质量百分比和更低的LVEF(P<0.05,表2)。

表2 两组患者左心室结构和组织特征的比较Tab.2 Comparison of LV structural and tissue characteristics measured with CMR between acute STEMI patients with and without adverse left ventricular remodeling
2.2.2 左心室应变及应变率 初始CMR分析显示,左心室不良重构组与无左心室不良重构组相比,只有径向和周向整体舒张期峰值应变率差异具有统计学意义(均P<0.05),两组3个方向梗死区峰值应变及应变率的差异无统计学意义(均P>0.05)。在第2次CMR显示,左心室不良重构组的3个方向整体峰值应变及应变率以及3个方向梗死区峰值应变、径向和周向梗死区峰值应变率均小于无左心室不良重构组(P<0.05,表3)。

表3 两组患者左心室峰值应变及应变率参数的比较Tab.3 Comparison of peak LV strain and strain rate parameters between STEMI patients with and without adverse left ventricular remodeling
2.3 两组患者初始和第2次CMR参数的自身前后比较
2.3.1 左心室结构和组织特征 左心室不良重构组的LVEDVI随时间推移呈增加趋势(P=0.008),而无左心室不良重构组则没有明显变化。左心室不良重构组的LVESVI随时间推移呈增加趋势(P=0.010),而无左心室不良重构组则呈下降趋势(P=0.014)。左心室不良重构组LVEF无明显变化,无左心室不良重构组升高(P=0.001)。值得注意的是,两组患者的梗死质量百分比和MVO质量百分比均呈下降趋势(均P<0.05)。除此之外无左心室不良重构组的LVMM也呈下降趋势(P=0.042,表4)。

表4 两组患者基线和随访的左心室结构和组织特征的前后比较Tab.4 Comparison of baseline and follow-up LV structural and tissue characteristics in patients with and without adverse LV remodeling
2.3.2 左心室峰值应变及应变率特征 左心室不良重构组3个方向的整体及梗死区峰值应变和应变率均未明显改变(P>0.05),无左心室不良重构组3个方向整体峰值应变以及径向和周向的梗死区峰值应变和梗死区峰值舒张期应变率均有显著改善(P<0.05,表5)。
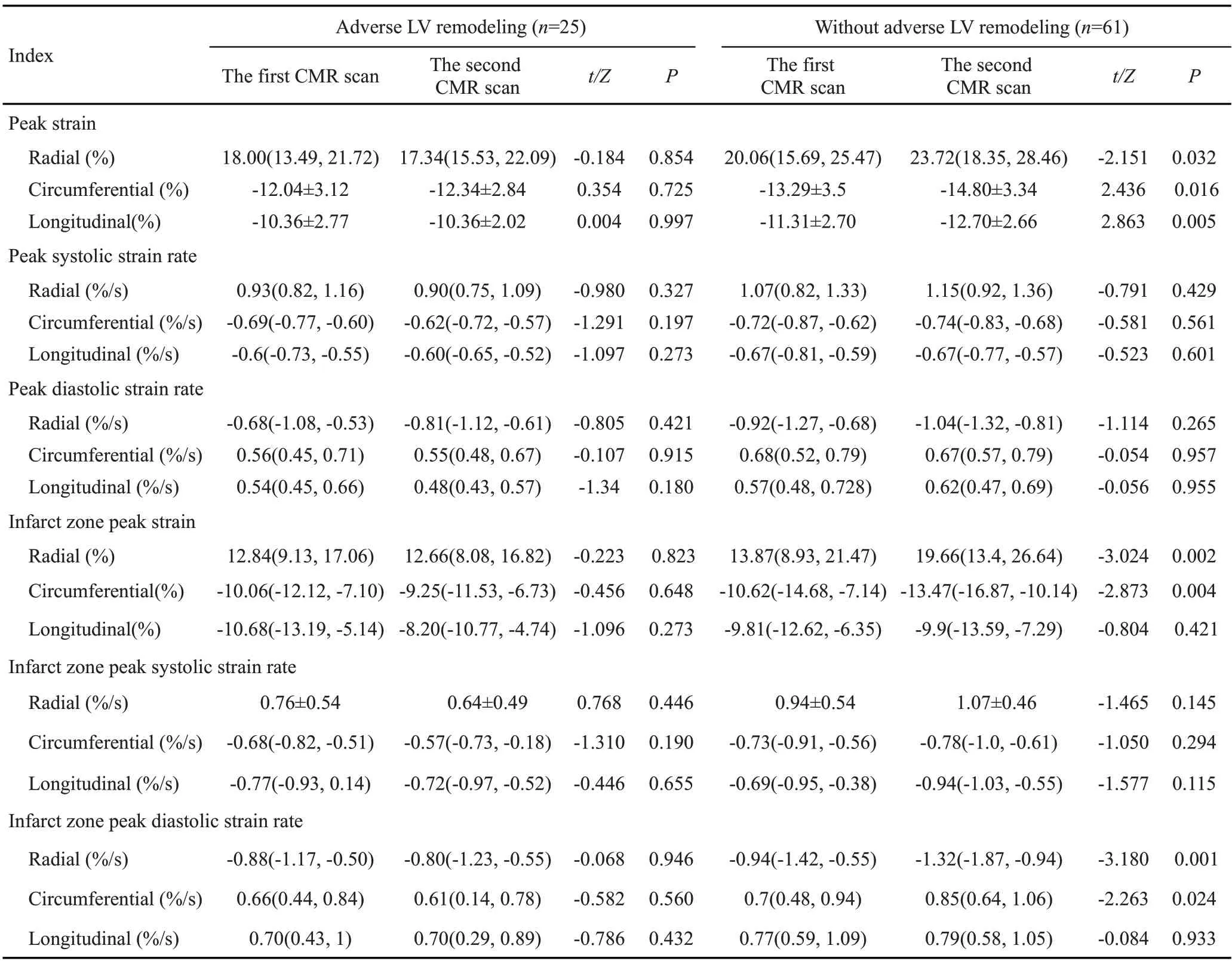
表5 两组患者基线和随访的左心室应变和应变率参数的前后比较Tab.5 Comparison of baseline and follow-up LV peak strain and strain rate parameters in patients with and without adverse LV remodeling
2.4 左心室不良重构危险因素的Logistic回归分析
单因素分析显示,峰值肌钙蛋白T、峰值CK-MB、RASS抑制剂的使用、梗死质量百分比、MVO质量百分比、整体径向和周向舒张期峰值应变率对左心室不良重构有预测作用(表6)。多因素分析显示,只有RASS抑制剂的使用、梗死质量百分比和整体径向舒张期峰值应变率是左心室不良重构的独立预测因素(P<0.05,表6)。ROC曲线结果显示(图4),梗死质量百分比的AUC为0.793(95%CI0.693~0.873),截断值为30.67%;径向舒张期峰值应变率的AUC 为0.645(95%CI0.534~0.745),截断值为0.58%;RASS抑制剂使用的AUC为0.699(95%CI0.590~0.793)。进一步将这3个变量联合组成复合模型预测左心室不良重构,ROC 曲线的AUC为0.866(95%CI0.776~-0.930)。复合模型超过了3个单独参数的预测能力[P(联合vs梗死质量百分比)=0.100,P(联合vs RASS抑制剂使用)<0.001,P(联合vs径向舒张期峰值应变率)<0.001]。

表6 STEMI患者PCI术后发生左心室不良重构的Logistic回归分析Tab.6 Univariable and multivariable logistic regression analysis of predictors of adverse LV remodeling after PCI in STEMI patients
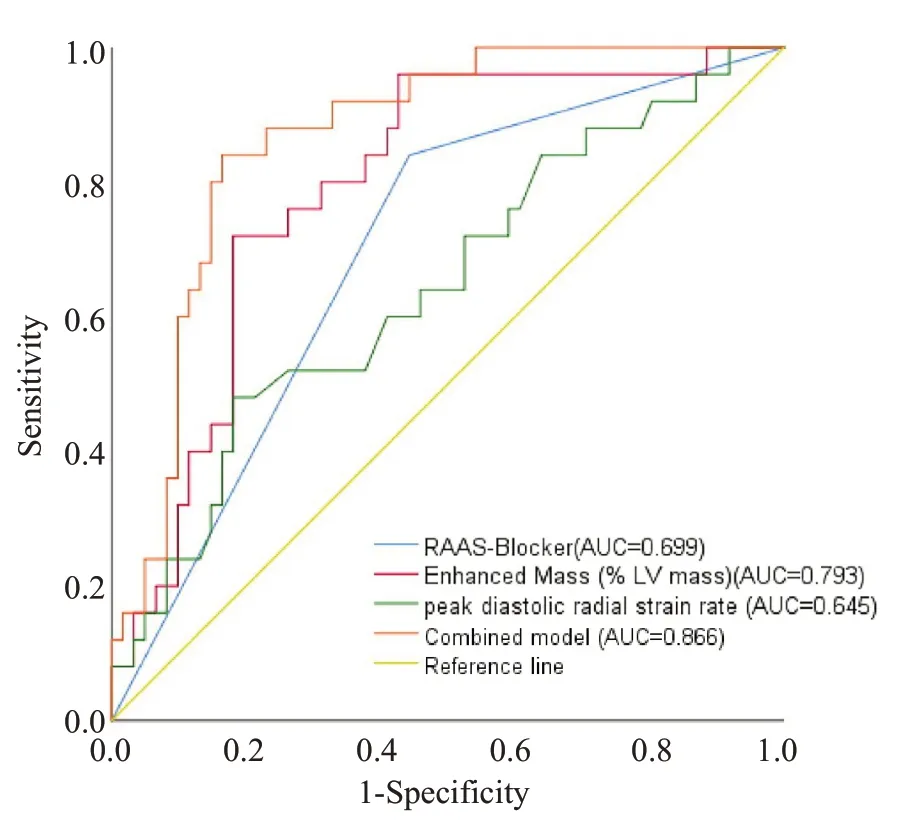
图4 RASS抑制剂的使用、梗死质量百分比、径向舒张期峰值应变率及3个参数联合预测左心室不良重构的ROC曲线Fig.4 ROC curves of RAAS blocker,infarct mass and peak diastolic radial strain rate and the combination of these 3 variables for prediction of adverse LV remodeling.
2.5 左心室不良重构和主要不良心血管事件的关系
随访30.9±15.5个月,共发生11起主要不良心血管事件,其中全因死亡3例,卒中1例,心力衰竭再入院1例,不稳定型心绞痛再入院6例。与无左心室不良重构的患者相比,左心室不良重构患者的主要不良心血管事件发生率较高,但差异无统计学意义[4/25(16%)vs7/61(11%);P=0.345,图5]。

图5 Kaplan-Meier图评估有无左心室不良重构患者的无主要不良心血管事件的发生率Fig.5 Kaplan-Meier plot of event-free survival of patients with and without adverse left ventricular remodeling.
3 讨论
本研究结果显示,在急性期,两组的左心室容积、整体及节段的心功能没有显著差异,但是随着时间的推移,左心室不良重构组的左心室容积明显变大,整体及节段的心功能明显更差。梗死质量百分比、径向舒张期峰值应变率及RASS抑制剂使用是左心室不良重构的独立预测因子。
心血管系统损伤的诊断指标有血清峰值肌钙蛋白T和峰值CK-MB。其中肌钙蛋白T是控制心脏收缩活动的物质,当心肌细胞发生损伤时,它会从心肌细胞中释放入血,血清肌钙蛋白T水平可显著升高[21]。CK-MB主要存在心肌内的酶蛋白,其只有在心肌细胞受损时才能被释放到外周中,是典型的心肌损伤标志物[22]。因此左心室不良重构患者的峰值肌钙蛋白T和峰值CK-MB表达量更高可能代表左心室不良重构患者心肌损伤程度更重。STEMI后两组在初始CMR时左心室容积无显著差异。但3~6个月后,左心室不良重构组左心室容积显著增加,无左心室不良重构组左心室容积显著降低,导致第2次CMR时左心室不良重构患者LVESVI、LVEDVI明显大于无不良重构组。值得注意的是左心室应变也发生了相同的变化,即两组患者急性期的整体和节段的应变没有明显差异,但在第1次CMR后左心室功能发生了明显变化,导致左心室不良重构组的左心室应变明显小于无左心室不良重构组。这一发现证实左心室形态和功能动态变化不仅存在急性期,也发生在STEMI后3~6个月。以往的研究数据表明,STEMI后的4个月内是左心室功能变化最动态的阶段,4个月后左心室功能相对稳定下来,所以STEMI后4~8个月进行随访CMR检查是定义左心室重构的基础[23],这与本文的研究结果相一致。
本文进一步研究了两组患者整体及梗死区心肌功能的具体演变过程。首先对左心室不良重构组的研究发现,该类患者的整体和梗死区的应变都没有明显的变化,这提示发生左心室不良重构患者梗死区心功能的恶化主要发生在STEMI后的1周内。本研究结果与之前关于STEMI患者术后心肌演变过程的研究结果不一致,有研究比较了39例在STEMI后2、30和90 d接受CMR检查的患者的梗死区和遥远区心肌周向应变的变化[12],观察到梗死区周向应变逐渐改善。此外,有研究通过分析191例心肌梗死患者发现STEMI后的1周和6个月相比,梗死区周向应变有所改善[24],这可能与区域射血分数的增加有关,有利于左心室重构逆转和功能恢复。此外,研究还发现无论是否存在微血管阻塞或心肌内出血,STEMI患者梗死区周向应变在PCI后6个月时都有所改善,这可能因为STEMI患者术后心功能改变的差异性,提示了识别STEMI术后发生左心室不良重构患者的重要性。本研究显示,在无左心室不良重构组,左心梗死区域的径向和周向的峰值应变及舒张期应变率均有较大幅度的改善,说明该组患者PCI术后的5个月内,心功能未见显著下降,相反有所改善,与既往研究结果相符。本研究发现急性期两组LVEF接近,但是整体舒张期峰值应变率有明显差异,提示CMR-FT对早期心功能改变的评估更敏感。LVEF虽然被公认为左心室整体收缩功能的参考标准,但LVEF仅能代表左心室几何变化,不能代表功能变化[25],提示LVEF可能无法识别左心室收缩功能细微的改变[9,26]。与LVEF通过体积变化反映收缩功能不同,应变是一种更深入的评价,研究了与心肌纤维几何形状相对应的3个不同方向的心肌形变。
近年来研究表明,梗死区域如果累及心肌各层,将会导致心肌收缩功能损害加重,功能恢复较差,所以CMR测量的梗死的范围和透壁性是左心室不良重构的主要决定因素[27,28]。本研究也发现梗死质量百分比与左心室不良重构相关,这与之前的研究结果相一致。
本研究发现,整体径向舒张期峰值应变率也是左心室不良重构的独立预测因子。心肌应变成像是在包括STEMI[10]在内的心血管疾病中识别左心室功能障碍的最有前景的技术之一。Martin等[15]研究了232例STEMI患者GLS、GRS和GCS与左心室不良重构的关系,发现即使对LVEF和梗死严重程度进行调整后,GLS仍是左心室不良重构的显著独立预测因素。Garg等[14]研究证明基线GLS与MVO和IMH密切相关,是预测左心室不良重构的最强指标。Holmes 等[16]发现GCS 增强了LGE对STEMI术后左心室不良重构的预测能力。有研究进一步证明GCS预测左心室不良重构的特异性高于MVO,IMH,心肌梗死面积(IS)等CMR参数[29]。但是,另有研究评估了65 例STEMI 患者的基线应变参数(GCS和GLS),发现CMR的左心室应变数据与左心室不良重构的发展之间不存在显著相关性[17]。既往研究显示,左室应变和应变速率与左心室不良重构的相关性尚不明确,缺乏完整的左室应变和应变速率(纵向、径向、周向)和组织学表征(心梗区域和微血管病变)的评价,而且依赖不同不良重构终点等。本研究表明,在3个方向应变及应变率参数中,只有径向舒张期峰值应变率是STEMI后左心室不良重构的显著独立预测因素,即使调整了包括峰值肌钙蛋白T、峰值CK-MB和MVO质量百分比在内的其它参数,这与之前研究中多次提到GCS和GLS是左心室不良重构预测参数的结果不一致。心肌梗死是一种与心肌缺血有关的疾病。心肌缺血可导致病变节段心肌形变、心肌功能下降、运动减弱,心肌的这些变化累及心内膜和心外膜。心内膜纤维收缩导致纵向应变及应变率相关的心肌纵向缩短。心外膜纤维收缩导致心肌周向缩短,与周向应变及应变率有关。径向收缩则是纵向和周向收缩的综合函数[30]。舒张期应变率受损提示舒张功能障碍伴异常心肌舒张和顺应性,与患者预后相关[31,32]。所以径向舒张期应变率可能代表整体心肌功能的变化。
除了上述的影像学指标外,本研究发现RASS抑制剂也是左心室不良重构的独立预测因子。国际指南推荐RASS抑制剂作为射血分数降低型心衰患者管理的药物治疗,以改善临床结果并促进左心室重构逆转[6]。也有证据表明肾素-血管紧张素系统(RAS)的激活在心肌梗死后左心室不良重构中起着重要作用,所以RASS抑制剂在预防或逆转梗死心肌心室重构方面具有重要的临床意义[33,34]。
本研究存在着样本量偏小,缺乏多中心、大样本临床试验来证实等缺点,而且本研究仅对心肌组织进行了整体和节段应变分析,未进一步划分为心内膜下心肌、心肌中层心肌和心外膜下心肌。因此,本文结果可能忽略了心肌组织不同层间存在的应变异质性。
综上所述,STEMI再灌注治疗后CMR成像有助于分析患者左心室结构和功能的演变以及左心室不良重构患者的特征。梗死质量百分比、径向舒张期峰值应变率及RASS抑制剂的使用是左心室不良重构的独立预测因子。以上发现有助于识别STEMI后左心室不良重构的高危患者,使其从密切监测和早期治疗中获益。
