积雪草苷对离体大鼠胸主动脉的舒张作用及其机制
2024-04-13卢国庆孙红燕孙正宇刘乐强张宁宁王宇航何一鸣纪佳慧李馨月康品方
卢国庆,孙红燕,孙正宇,刘乐强,王 磊,张宁宁,王宇航,何一鸣,纪佳慧,李馨月,康品方,唐 碧
1蚌埠医科大学第一附属医院心血管内科,安徽 蚌埠 233000;蚌埠医科大学2心脑血管病研究中心生理学教研室,3临床医学院,安徽 蚌埠233000
高血压是全球归因死亡的主要危险因素[1],且全球发病率逐年升高[2],长期高血压会导致多种并发症[3]。血管重构和功能障碍是高血压及其并发症发生之前的主要病理过程[4],各种因素导致的血管重构,可引起血管阻力的增加,动脉血管损伤过程中会释放多种缩血管物质[5],导致血管收缩,引起血压升高,故主动脉的舒张对高血压的治疗尤为关键,诸多有效的高血压治疗药物最终都会直接或间接地引起血管舒张效应[6],寻找新型主动脉舒张药物对于更好地开发高血压的新治疗策略具有重要意义。
积雪草苷(AS)是积雪草的主要活性成分,属于三萜皂苷类[7],具有多种药理作用,包括抗炎[8]、抗氧化[9]、抗抑郁[10]、保神经[11]、抑制瘢痕形成[12]和抗肿瘤[13]等作用,此外AS具有的保护血管内皮细胞[14]、抗动脉粥样硬化[15]、改善血管重构[16]等药理作用,相关研究表明,AS通过减弱肾素-血管紧张素系统的激活[17],抑制氧化应激标志物的产生[18],重建血管功能[19]以及改善胰岛素抵抗[20]等机制,从而产生降压作用,提示了AS在高血压的治疗方面具有巨大潜力。有离体实验研究表明,AS能够对多种动脉产生舒张效应,如糖尿病大鼠脑动脉血管、冠状动脉、肺动脉,并且能够保护并改善内皮功能障碍[21],但AS是否通过离子通路相关机制治疗高血压未见相关文献报道,AS在大鼠胸主动脉中可能的血管舒张作用及其潜在机制尚不清楚。本研究选择AS为研究对象,首先探讨其对大鼠血压和胸主动脉血管形态的影响,其次探索AS对离体胸主动脉的舒张作用及潜在可能离子通路机制,为高血压的治疗提供新的思路。
1 材料和方法
1.1 仪器与试剂
RM6240E多道生理信号采集处理系统、SGQ-4离体组织器官恒温灌流装置、JZJ01型张力换能传感器、DSWY-1大鼠尾动脉血压测量装置(成都仪器厂)。AS(上海麦克林生化科技股份有限公司),去甲肾上腺素(NE)、乙酰胆碱(Ach)、一氧化氮合酶阻断剂N-硝基-L-精氨酸甲酯(L-NAME)、环氧合酶抑制剂吲哚美辛(Indo)、血红素氧合酶-1抑制剂锌原卟啉Ⅸ(ZnPP Ⅸ),非特异性钾通道阻滞剂四乙基氯化铵(TEA)、电压门控钾通道阻断剂4-氨基吡啶(4-AP)、内向整流型钾通道(KIR)抑制剂氯化钡(BaCl2)、ATP 敏感性钾通道抑制剂格列苯脲(Gli)、选择性高电导钙激活性钾离子通道(BKca)阻滞剂Iberiotoxin,乙二醇双(2-氨基乙基醚)四乙酸(EGTA),羟乙基哌嗪乙硫磺酸均购于美国Sigma公司;双孔钾通道TWIK相关酸敏感钾通道1(TASK-1)抑制剂TASK-1-IN-1(MCE),戊巴比妥钠(北京普博斯生物有限公司),HE染色试剂盒(碧云天),水为超纯水。
1.2 动物实验
选取SPF级雄性SD大鼠(6~8周龄,体质量180~220 g)40只,由杭州医学院实验动物中心提供,实验动物使用许可证号为SCXK(浙)2019-0002。饲喂标准实验饲料,充足饮水,实验环境为室温,相对湿度为45%~55%。适应性饲养7 d后进行实验。本研究经蚌埠医学院伦理委员会审核批准(伦理编号:2019-074号),动物的养护及处理严格遵守《实验动物管理条例》进行。
1.3 动物分组与血压测量
取18只SD大鼠按照简单随机法平均分为3组(6只/组):正常对照组(二甲基亚砜,DMSO灌胃)、AS低剂量组[17](50 mg/kg)和AS高剂量组[22](100 mg/kg)。每天给予相应药物灌胃1次,连续灌胃2周。在给药前1 d、给药第8天和第15天,利用DSWY-1大鼠尾动脉血压测量装置对每只大鼠进行6组收缩压(SBP)测量,并取平均值。
1.4 HE染色观察胸主动脉形态
完成所有血压测后,采用戊巴比妥麻醉大鼠,剂量参考标准为50 mg/kg,脱颈处死后将其胸主动脉取出并分离,用4%多聚甲醛固定24 h,乙醇梯度醇洗及脱水,石蜡包埋。使用二甲苯将固定的胸主动脉组织切片,进行HE染色;使用显微镜观察和记录,拍照观察胸主动脉血管形态。
1.5 离体实验
1.5.1 大鼠胸主动脉血管环的制备及处理 用戊巴比妥(50 mg/kg)将大鼠麻醉后,脱颈处死,取其胸主动脉,放入提前充氧的预冷的K-H液中,在显微镜下去除周边组织。将分离干净的血管剪成3~4 mm的血管环,采用眼科镊缠绕棉絮擦拭血管腔,可去除内皮。将血管环安装在2个三角形金属环之间,上端连接张力传感器,将血管环的下端固定,采用RM6240E 多道生理信号采集处理系统记录血管环的张力变化。恒温浴槽内持续通入95%O2+5%CO2混合气体,加入15 mL K-H液,并保持温度在37 ℃。浴槽内每间隔20 min换1次K-H液,每5 min调整0.3 g,逐步将基础张力平衡至1.8 g,平衡稳定2 h[23],对制备的血管环张力情况进行记录,即认定为血管环基础张力。连续2次以60 mmol/L的KCl刺激血管环,2次收缩幅度的差值<10%,表明血管活性良好。以浓度为1×10-6mol/L的NE刺激待血管环收缩到稳定状态后,将1×10-5mol/L的乙酰胆碱加入,若胸主动脉的舒张程度>80%,则说明内皮功能良好,属于内皮完整组;若舒张程度<10%,则表示内皮被去除,属于去内皮组[24,25]。待内皮功能检测完毕,使用K-H液将血管环恢复至基础状态,然后记录血管环的张力[26]。
1.5.2 AS对基础张力状态下大鼠离体胸主动脉内皮完整血管环张力的影响 取“1.5.1”小节下内皮完整血管环,无NE和KCl预收缩,K-H液平衡2 h,实验组每间隔10 min 累积加AS 1、3、10、30、50、100 μmol/L(溶剂DMSO 的体积分数分别为0.002%、0.006%、0.02%、0.06%、0.13%),对照组加入等体积分数DMSO,随后记录血管环的张力变化(n=6)。
1.5.3 AS对内皮完整和去内皮血管环张力的影响 取内皮完整和去内皮的血管环,待血管稳定后,分别添加NE(1×10-6mol/L)或KCl(60 mmol/L)以刺激收缩,在稳定后,实验各组均按照“1.5.2”小节的方法累积加入AS,对照组加入等体积DMSO,再测量各个血管环的张力并计算AS舒张血管百分比。AS舒张血管百分比的计算方式为:(NE或KCl诱发的血管环最大收缩张力-给予AS后血管环张力)/(NE或KCl诱发的血管环最大收缩张力-血管环基础张力)×100%(n=6)[26,27]。
1.5.4 L-NAME、Indo和ZnPP Ⅸ对AS舒张血管环作用的影响 选用活性良好且保留内皮的血管环,用K-H液平衡稳定后,设定正常对照组、AS组、AS+L-NAME组、AS+Indo 组和AS+ZnPP Ⅸ组。实验组分别加入LNAME(0.1 mmol/L)、Indo(1×10-5mol/L)、ZnPP Ⅸ(1×10-5mol/L),AS组加等体积溶剂生理盐水,预先孵育20 min后,各组均加入NE(1×10-6mol/L)刺激血管环收缩,并记录其张力变化。在稳定状态下,按照“1.5.2”小节的方法逐渐加入AS,正常对照组则加入等体积DMSO,分别测定各组血管环的张力,并计算AS对舒张血管的百分比。最后分析L-NAME、Indo和ZnPP Ⅸ对AS舒张血管环作用的影响(n=6)。
1.5.5 钾通道阻滞剂对AS舒张血管环作用的影响 用“1.5.1”小节中的方法取得内皮完整及活性良好的血管环,K-H液平衡稳定后,设正常对照组、AS组、AS+TEA组、AS+Gli组、AS+4-AP组和AS+BaCl2组,实验组分别加入TEA(5 mmol/L)、Gli(1×10-5mol/L)、BaCl2(0.1 mmol/L)、4-AP(1 mmol/L),AS组加等体积溶剂生理盐水,预孵育20 min。各组均加入NE(1×10-6mol/L)刺激血管环收缩,并记录其张力变化。在稳定状态下,按照“1.5.2”小节的方法逐渐加入AS,正常对照组则加入等体积DMSO,分别测定各组血管环的张力,并计算AS对舒张血管的百分比。同时,对钾离子通路抑制剂对AS舒张血管环作用的影响进行分析(n=6)。
1.5.6 Iberiotoxin和TASK-1-IN预孵育组对AS舒张血管环作用的影响 获取上述同样的内皮完整血管环,设正常对照组、AS组、AS+Iberiotoxin组和AS+TASK-1-IN-1 组,实验组分别加入Iberiotoxin(0.1 μmol/L)、TASK-1-IN-1(1×10-6mol/L),AS组加等体积溶剂生理盐水,预孵育20 min,然后各组都加入NE(1×10-6mol/L)以刺激血管环收缩,记录其张力变化。待血管环张力稳定后,各组均按照“1.5.2”小节的方法逐步加入AS,正常对照组加等体积DMSO,分别测定各组血管环的张力,并计算AS 舒张血管百分比,分析Iberiotoxin、TASK-1-IN-1对AS舒张血管环作用的影响(n=6)。
1.5.7 AS对NE激活的Ca2+收缩血管环作用的影响 取活性良好的去内皮血管环,先用无钙K-H溶液冲洗并孵育30 min,然后根据不同浓度的AS(30、50、100 μmol/L)对血管环预处理,实验分为AS干预组和溶剂对照组。在给药物及溶剂进行干预20 min后,各组分别加入无钙NE(1×10-6mol/L),15 min后不断加入CaCl2(0.1、0.3、1、3、10 mmol/L)。记录血管环张力变化,并计算血管收缩率。以正常对照组累积加入CaCl2后引起的收缩张力最大值为100%,血管收缩率(%)计算方式为:(AS预处理组连续加入CaCl2后最大血管环张力-AS预处理组加入CaCl2前血管环张力)/(溶剂对照组连续加入CaCl2诱发的血管环最大收缩张力-溶剂对照组加入CaCl2前血管环张力)×100%[26]。分析AS对NE激活的Ca2+收缩血管环作用的影响(n=6)。
1.5.8 AS对KCl激活的Ca2+收缩血管环作用的影响 取活性良好的去内皮血管环,如“1.5.7”小节同样的方法进行分组及预孵育药物,20 min后各组分别加入无钙KCl(60 mmol/L)生理盐溶液,15 min 后分别加入浓度为0.1、0.3、1、3、10 mmol/L的CaCl2。记录血管环张力变化,并按照“1.5.7”小节中的方法计算血管收缩率。比较对照组和干预组之间的收缩效应差异,分析AS对KCl激活引起的Ca2+收缩血管环作用的影响(n=6)。
1.6 统计学分析
采用GraphPad Prism 9软件进行数据统计处理并绘制浓度对数值-舒张效应曲线,定量数据以均数±标准差表示。采用双因素方差分析和Bonferroni's test检验对实验数据进行组间比较。以P<0.05为差异有统计学意义。去甲肾上腺素收缩的百分比逆转是呈现动脉血管环松弛反应的基础。血管活性激动剂的最大松弛反应以Emax表示,产生最大反应50%的浓度用EC50表示。pD2=-log EC50表示药物敏感性或效价[28]。
2 结果
2.1 AS对大鼠血压的影响
在给药后的第8天,正常对照组、AS 50 mg/kg和100 mg/kg 组的SBP 分别为136.5±1.87、131.7±2.16、127.7±2.25 mmHg;给药第15 天,3 组的SBP 分别为137.0±1.78、128.8±1.94、124.3±1.63 mmHg(图1)。随着给药时间的推移和药物剂量增加,大鼠SBP下降,与正常对照组的差异有统计学意义(P<0.05)。

图1 AS对大鼠血压的影响Fig.1 Effect of asiaticoside(AS)on blood pressure of SD rats.*P<0.05,**P<0.01 vs normal control group(n=6).
2.2 AS对大鼠胸主动脉组织形态的影响
HE染色结果显示,正常对照组和AS干预组大鼠胸主动脉的细胞排列整齐,结构无破坏,中膜无增厚,无明显炎性或其他细胞浸润,各层弹力纤维没有明显的紊乱迹象(图2)。
图2 AS对大鼠胸主动脉组织形态学的影响Fig.2 Effect ofAS on histomorphology of thoracic aorta in rats(HE staining,original magnification:×90.5).
2.3 AS对离体大鼠基础状态下胸主动脉内皮完整血管环的张力的影响
对于稳定在基础张力状态下的大鼠胸主动脉内皮完整血管环,未经NE或Kcl刺激,不同AS(1、3、10、30、50、100 μmol/L)干预后,血管环张力明显改变(图3)。
2.4 AS对内皮完整和去内皮血管环张力的影响
与对照组比较,内皮完整和去内皮组的主动脉环在经NE 或KCl 预刺激的中,AS 给药浓度为10、30、50、100 μmol/L时分别引起浓度依赖性松弛(P<0.05)。AS在对NE 预收缩内皮完整的动脉环中产生的Emax为119.82%±6.66%,pD2为4.54±0.204(n=6),AS在对NE预收缩在剥去内皮的动脉环中产生的最大舒张率为94.53%±6.63%,pD2值为4.83±0.258(n=6),在AS 100 μmol/L 浓度的作用下,二者差异有统计学意义(P<0.05)。对于KCL引起的预收缩的血管环,内皮保留与否的差异无统计学意义(P>0.05,图4)。
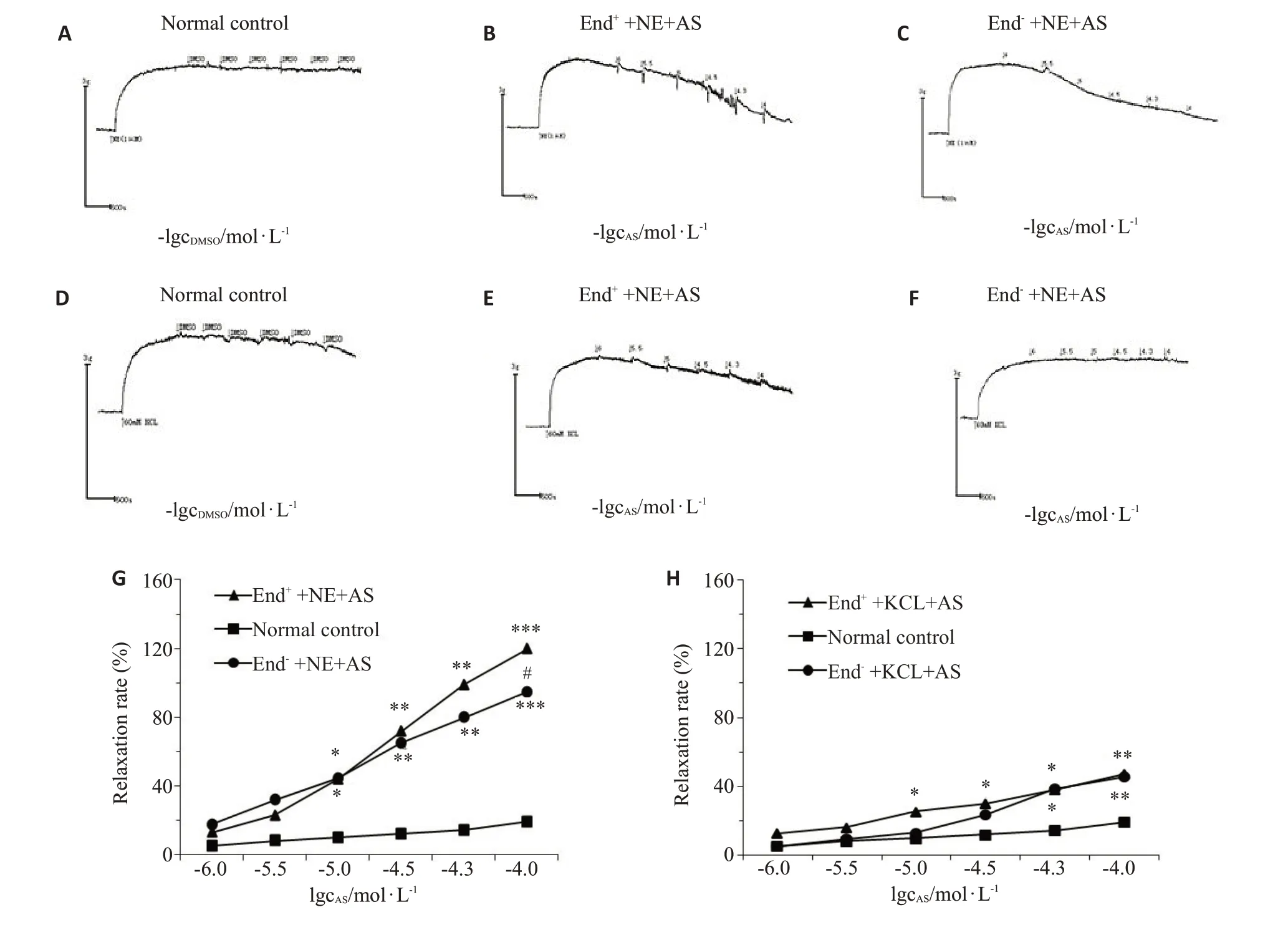
图4 AS对内皮完整和去内皮血管环张力的影响Fig.4 Effect of AS on tension of preconstricted endothelium-intact (End+) and endothelium-denuded (End-)isolated thoracic aorta.A,D:Control group.The representative tracings show the effect of AS on Endo+(B,E)and Endo-(C,F)arterial rings preconstricted with NE(1 μmol/L)or KCl(60 mmol/L).G,H:Diagrams showing the mean values of relaxation of AS-treated Endo+and Endo-vessels(n=6).*P<0.05,**P<0.01 vs normal control group;#P<0.05 vs End+group.
2.5 L-NAME、Indo和ZnPP Ⅸ对AS舒张血管环作用的影响
L-NAME(0.1 mmol/L)组可以降低AS诱导的最大舒张率(Emax67.36%±8.92%,n=6),与对照组的差异有统计学意义(Emax119.82%±6.66%,n=6,P<0.01)。pD2值与对照组的差异无统计学意义(P>0.05)。Indo和ZnPPⅨ组与AS对照相比,差异无统计学意义(P>0.05,图5)。
2.6 钾通道阻滞剂对AS舒张血管环作用的影响
TEA(5 mmol/L)可抑制NE(1 μmol/L)预收缩下AS的舒血管作用,且最大累积浓度AS 的舒张率与对照组的差异有统计学意义(Emax40.1%±9.68%vs119.82%±6.66%,n=6,P<0.01);Gli、BaCl2和4-AP均无法减弱AS的舒血管作用(P>0.05,图6)。

图6 钾通道阻滞剂对AS舒张血管环作用的影响Fig.6 Effect of potassium channel blockers on vasodilation effect of AS.A, B: Control group; C-F: Inhibitor Intervention group; G, H: Concentration-response curve (n=6).*P<0.05,**P<0.01,***P<0.001 vs normal control group;#P<0.01,##P<0.01 vsAS group.
2.7 Iberiotoxin和TASK-1-IN-1对AS舒张血管环作用的影响
BKca阻滞剂Iberiotoxin(0.1 μmol/L)显著降低NE(1 μmol/L)预收缩下AS的舒血管作用,最大舒张率与对照组的差异有统计学意义(Emax34.53%±3.66%vs119.82%±6.66%,n=6,P<0.01)。TASK-1-IN-1组与AS对照组的差异无统计学意义(P>0.05,图7)。

图7 Iberiotoxin和TASK-1-IN-1对AS舒张血管环作用的影响Fig.7 Effect of Iberiotoxin and TASK-1-IN-1 on vasodilation effect of AS.A, B: Control group. C, D:Inhibitor Intervention group.E:Concentration-response curve(n=6).*P<0.05,**P<0.01,***P<0.001 vs normal control group;#P<0.01,##P<0.01,###P<0.001 vsAS group.
2.8 AS对NE激活的Ca2+收缩血管环作用的影响结果
AS浓度依赖性地减弱CaCl2对血管的收缩效应,并使CaCl2收缩作用量-效曲线右移,AS(50µmol/L)组处理的动脉环最大收缩率Emax为40.89%±2.98%(n=6),AS(100µmol/L)组最大收缩率Emax为18.43%±8.20%(n=6),与正常对照组相比,差异有统计学意义(P<0.01,图8)。
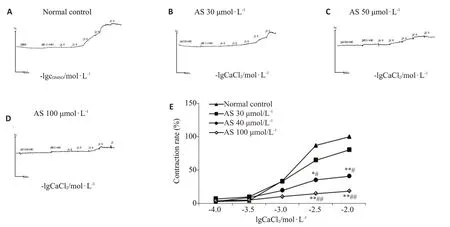
图8 AS对去甲肾上腺素激活的Ca2+收缩血管环作用的影响Fig.8 Effect of AS on norepinephrine-activated Ca2+ constriction of vascular loops.A: Control group; B-D: Different concentrations of AS(30,50,100 μmol/L)groups.E:Concentration-response curve(n=6).*P<0.05,**P<0.01 vs normal control group;#P<0.05,##P<0.01 vsAS 30 μmol/Lgroup.
2.9 AS对KCl激活的Ca2+收缩血管环作用的影响
当KCl预刺激的去内皮血管环被置于CaCl2浓度分别为1、3、10 mmol/L的环境下,由AS(100 μmol/L)孵育组所产生的收缩率下降(P<0.05);同样地,在CaCl2浓度为3、10 mmol/L的情况下,对于由AS(50 μmol/L)预处理组产生的收缩率,其在相同条件下也呈减弱趋势(P<0.05)。AS(50 μmol/L)处理的动脉环最大收缩率Emax为60.18%±5.78%(n=6),AS(100 μmol/L)的Emax为44.0%±4.61%(n=6,图9)。
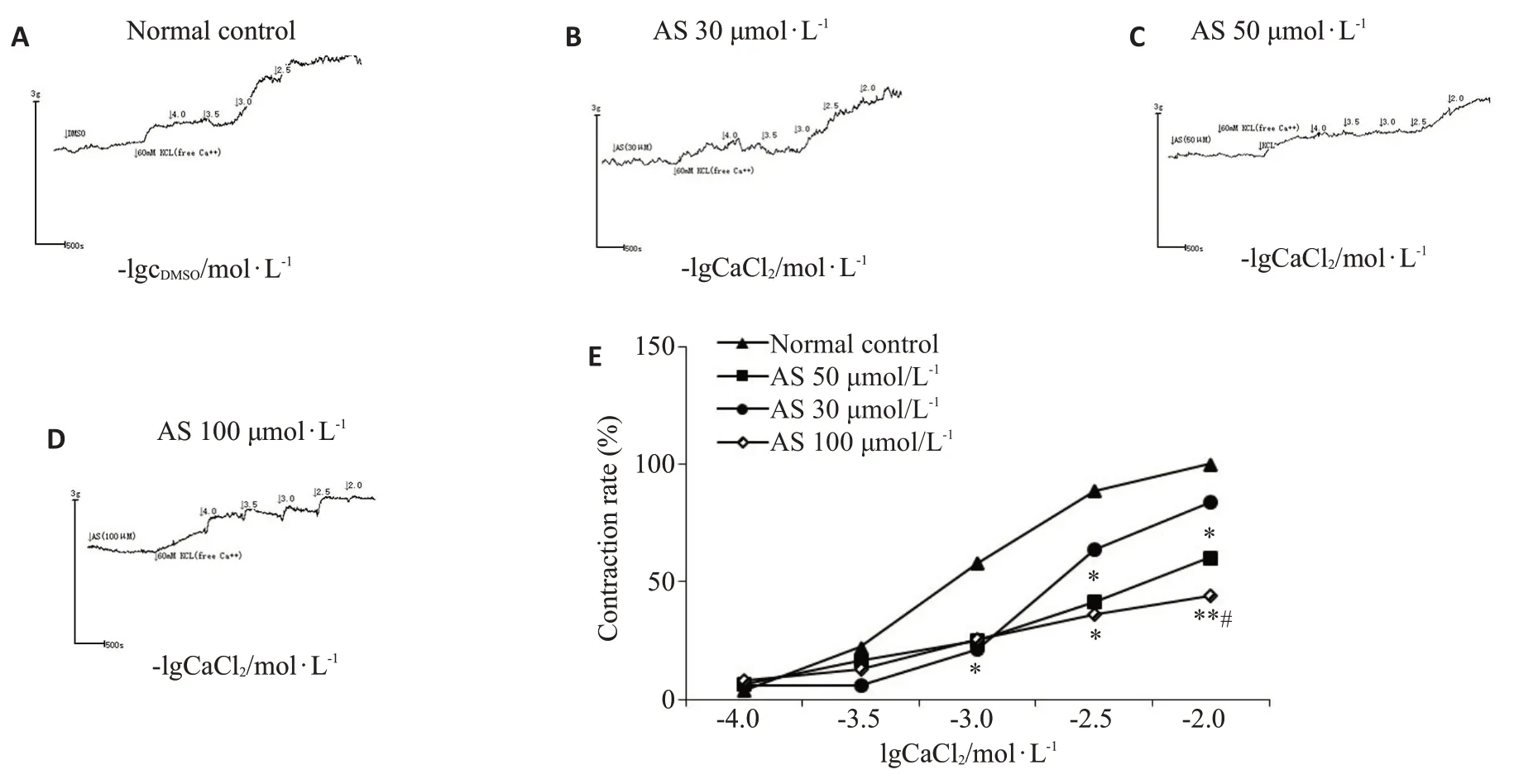
图9 AS对KCL激活的Ca2+收缩血管环作用的影响Fig.9 Effect of AS on constriction of the vascular ring by Ca2+activated by KCL.A:Control group.B-D:Different concentrations of AS (30,50,100 μmol/L) groups; E: Concentration-response curve (n=6);*P<0.05,**P<0.01 vs normal control group;#P<0.05 vsAS 30 μmol/Lgroup.
3 讨论
高血压作为心血管疾病的危险因素已经得到了深入的研究,它与心血管疾病的关系得到了很好的证实。一项荟萃分析显示,降低血压可显著降低心血管疾病的风险和死亡率[29]。原发性高血压动脉系统的主要特征包括小动脉和大动脉重构,并伴有相关的功能。而在原发性高血压中,小动脉和大动脉的改变是密切相互依赖的,时间关系很难建立,是相互干扰,即小动脉改变影响大动脉表型,大动脉改变影响小动脉表型改变[30]。当动脉损伤时,血管出现收缩、血管舒张功能受损、管腔直径减小相关的管腔比增加,导致血管阻力增加,引起血压升高。应用舒张血管的药物时,使得血管舒张外周及中央阻力下降,从而起到降血压的作用。动脉的舒张机制主要涉及血管内皮的舒张,平滑肌离子通路的电流变化导致平滑肌收缩舒张变化。
AS具有多种药理特性,包括抗炎、抗氧化、保护心脏以及改善血管重塑等[8-15]。这些特性使得AS能够通过各种途径降低血压。例如,它可以抑制代谢过程,减少氧化应激,恢复血管的功能,并保护血管内皮[18-20]。有研究发现,AS可通过增加一氧化氮生物利用度,增强LNAME诱导的高血压大鼠的血流动力学状态并恢复血管功能,从而达到降压的目的[17],该研究主要侧重于AS对血管内皮功能的保护,我们团队在基于AS调节内皮细胞释放的活性因子的同时,另外从平滑肌细胞的离子通路入手探索AS舒张血管的作用机制,发现AS可通过对钾离子和钙离子通路调节,进而引起平滑肌的血管舒张变化。另有研究表明,AS的类似物羟基积雪草可以通过调节钙离子和改善内皮功能来扩张主动脉[31],但该研究仅验证AS对一氧化氮途径的影响,未探讨AS对一氧化碳、前列腺素等其他重要的血管舒张因子的作用;此外,对于平滑肌离子通路的研究,仅限于钙离子途径,并未探索AS对多种钾离子通路的影响,且尚未在动物模型上得到验证。因此,本研究尝试针对以上问题做出改进,我们分别在整体动物和离体的层面,探索AS对大鼠血压的影响,AS对影响血管内皮细胞的一氧化氮、一氧化碳、前列腺素等血管活性分子的作用,以及参与影响主动脉平滑肌细胞电活动的多种钾离子通路和钙离子通道的作用,从而能够更加全面和深入的阐述AS舒张血管的离子通路相关机制。
本研究表明,在AS长期干预下,可以降低正常大鼠尾动脉收缩压,但对胸主动脉的微观组织形态无明显影响。体外血管环水平实验得出,在NE和KCL预收缩内皮保留的血管环中,AS具有剂量依赖性的舒张作用;对于NE预刺激的去除内皮组,AS对血管环的的扩张能力略微降低,这说明AS舒张血管的作用机制可能部分依赖于血管内皮。
高浓度(100 mg/kg)AS干预内皮完整的血管环时,通过L-NAME抑制一氧化氮的生成可减弱AS的舒张血管效应,可能机制是高浓度AS促进血管内皮源性舒张因子如一氧化氮的释放,导致血管舒张。内皮型一氧化氮合酶可由多种血管活性因子和缺氧、炎症、氧化应激等调节[32]。多项研究表明AS可激活介导的信号增强丝氨酸/苏氨酸特异性磷酸化蛋白激酶/内皮型一氧化氮合酶,从而促进一氧化氮的产生[16,33]。环氧合酶介导血管内皮收缩因子的产生,影响血管内皮的收缩[34],环氧合酶抑制剂吲哚美辛对AS的舒张血管效应无明细影响。有报道称血管源性一氧化碳参与调节动脉的舒张作用[35]。血红素加氧酶-1促进一氧化碳产生,引起血管舒张,而本实验发现血红素加氧酶-1抑制剂ZnPP Ⅸ对AS的血管舒张效应不产生影响。
血管平滑肌细胞膜上存在多种类型的K+通道,这些通道在平滑肌收缩张力和血管舒张张力的维持中起着重要作用[36,37]。本研究发现非选择性钾通道阻滞剂TEA(10 mmol/L)减弱AS引起的松弛。我们推测,AS引发的血管松弛现象,其机理可能是血管平滑肌细胞上的钾离子通道开放,致使细胞内K+外流增多,引起细胞膜电位的超极化,从而关闭电压门控钙通道,使得Ca2+内流减少,最终导致血管松弛。我们进行多种钾离子通抑制剂的干预,发现BKca阻滞剂Iberiotoxin能显著减弱AS引起的胸主动脉环松弛。然而,AS的松弛不受格列本脲(KATP通道阻滞剂)、氯化钡(KIR通道阻滞剂)、TASK-1-IN-1(双孔钾通道TWIK相关酸敏感钾通道1抑制剂)和4-AP(KV通道阻滞剂)的影响。可以看出,AS对大鼠胸主动脉血管环的舒张作用机制与ATP 敏感性钾通道、内向整流型钾通道、电压依赖性钾通道均无关系,可能与选择性高电导钙激活性钾离子通道的开放有关,AS是通过激活选择性高电导钙激活性钾离子通道引起平滑肌细胞膜电位的超极化,从而舒张血管。
Ca2+在平滑肌收缩和不同的细胞功能中起着非常重要的作用,并参与了高血压等疾病的发病机制。细胞内钙浓度的升高通过电压依赖性和受体操作的钙通道的参与导致血管平滑肌收缩,由于细胞外K+浓度升高,血管平滑肌膜去极化导致电压依赖性钙通道的激活[38]。本研究发现,在预先用无钙液孵育后使得血管平滑肌细胞处于无钙环境,用高浓度的KCl 刺激后大量钾离子内流,导致细胞去极化,最终激活电压依赖性钙通道,加入不同浓度CaCl2会导致大量钙离子内流,引起血管收缩。高浓度的AS预孵育则会抑制这种平滑肌收缩反应。因此,AS可以通过抑制Ca2+内流来影响血管收缩。
当去甲肾上腺素主要作用于血管α1受体时,它触发了G蛋白与磷脂酶C的活动,进而产生了三磷酸肌醇。这一过程导致了肌浆网内的钙储存被释放出来。接着,Ca2+通过受体的调控进入细胞内部,引发血管平滑肌的收缩[39]。根据实验观察,AS能够阻断由去甲肾上腺素诱导的血管环收缩。这表明AS可能通过抑制血管平滑肌细胞肌浆网内的钙离子释放以及受体依赖性的钙通道打开,来实现血管的扩张效应。
综上所述,AS具有降低正常大鼠收缩压和舒张胸主动脉的作用,具有浓度依赖性,其机制可能通过一氧化氮途径舒张血管内皮、诱导非选择性钙敏感型钾离子通道开放,抑制外钙内流、肌浆网中的储钙释放和受体操控钙通道开放。本研究仅初步探讨了AS对大鼠胸主动脉的舒张作用,其具体作用机制需后续进一步研究。然而,实验的设计仍存在一些局限性,因此后续仍需不断完善和优化。
