激活α7nAchR促进肥胖小鼠的脂肪稳态和米色脂肪生成及产热作用
2024-04-13包汉生王苏童吕穆杰王永成
包汉生,王苏童,吕穆杰,王永成,姜 萍,李 晓
1山东中医药大学,山东 济南 250355;2山东中医药大学附属医院,山东 济南250014
肥胖是脂肪组织过度堆积所导致的病理状态,对人体健康构成了严重的危害。研究发现,哺乳动物体内的脂肪可分为白色脂肪、棕色脂肪和米色脂肪[1],其中白色脂肪不直接参与机体产热[2],但在一定刺激条件下可转化为米色脂肪,后者含有丰富的线粒体,具有产热和促进能量消耗的作用[3]。近些年来,防治肥胖的治疗主要集中在通过激活交感神经促进白色脂肪米色化以增加产热也越来成为肥胖防治领域的焦点,但这一方法存在弊端[4,5]。肥胖机体由于过多营养物质,如葡萄糖、游离脂肪酸和氨基酸等的堆积,能够触发炎症因子造成体内代谢异常,脂肪组织中常伴随着以巨噬细胞浸润为主的炎症反应,表现为有促炎作用的M1型巨噬细胞增多,抗炎作用的M2型巨噬细胞减少[6-8]。虽然刺激交感神经可以促进白色脂肪米色化,但会进一步加重炎症,不利于肥胖的长期治疗。因此,激活交感神经刺激的同时,减轻炎症反应,对肥胖的治疗具有重要意义。
α7烟碱型乙酰胆碱受体(α7 nAchR)是胆碱能抗炎通路的主要受体之一,在抵抗机体炎症反应中起着重要作用[9]。既往研究已证实,机体外周脂肪组织中存在大量α7 nAchR,肥胖时可导致脂肪组织中α7 nAchR表达降低[10,11]。激活α7 nAchR可以提升缺血脑组织中M2型巨噬细胞并降低M1型巨噬细胞,并可通过活化JAK2/STAT3选择性的阻止内质网应激导致的M2型巨噬细胞凋亡[12,13]。提示激活α7 nAChR是改善肥胖机体脂肪组织炎症的潜在作用靶点。且近年来通过激活α7 nAChR改善交感神经兴奋导致的白色脂肪炎症反应,激活交感神经促进白色脂肪米色化产热在文献记录上尚属空白,因此本研究旨在观察激活α7 nAChR对白色脂肪组织中巨噬细胞表型转化及米色化效能的影响,并探讨其可能的作用机制,尝试解决激活交感神经促进白色脂肪米色化这一方法的实际应用障碍,为防治肥胖提供新思路。
1 材料和方法
1.1 实验动物
8周龄雄性C57BL/6J小鼠,SPF级,50只,体质量20~23 g,购于浙江维通利华实验动物技术有限公司,实验动物许可证号:SCXK(浙)2019-0001,小鼠饲养于SPF级动物房,恒温恒湿,自由进食和饮水,12 h 昼夜交替。高脂饲料(蛋白20%、碳水化合物20%、脂肪60%,能量5.24 kcal/g)和普通饲料均购买于济南朋悦实验动物繁育有限公司,许可证号:SCXK(京)2018-0006。所有动物实验部分均符合山东中医药大学动物伦理委员会标准(NO.2020-10)。
1.2 实验材料
α7 nAchR 选择性 激动剂GST-21(MCE);α7 nAchR选择性拮抗剂α-BGT(ApeXbio);β 3肾上腺素受体激动剂CL316,243(MCE);小鼠肿瘤坏死因子α(TNF-α);转化生长因子β(TGF-β);白细胞介素1β(IL-1β);白细胞介素10(IL-10)酶联免疫吸附测定试剂盒(江莱生物公司);纤维类组织RNA快速提取试剂盒(离心柱型);SPARKscript ⅡRT Plus Kit(With gDNAEraser);2×SYBR Green qPCR Mix(With ROX)(山东思科捷生物技术有限公司)。Anti-UCP1 Rabbit pAb(Servicebio);Anti-Mannose Receptor/CD206 Rabbit pAb(Servicebio);Anti-CD86 Rabbit pAb(Servicebio)。Westerm blot 中一抗使用UCP-l(abcam),BetaActin (proteintech),CHRNA7(ABclonal),NF-KBp65(ABclonal),STAT3(abcam),p-STAT3(abcam),JAK2(abcam),p-JAK2(abcam)。
1.3 实验仪器
ST8 离心机(Thermo Scientific)、Multiskan Go 型酶标仪(Thermo Scientific)、Arktik Thermal Cycler 96孔型PCR仪(Thermo Scientific)、Light Cycler 480Ⅱ荧光定量PCR仪(Roche)、EG1150H型石蜡包埋机(Leica)、RM2016病理切片机(上海徕卡仪器有限公司)、Nikon Eclipse E100 型正置光学显微镜(日本尼康公司)、NIKON DS-U3成像系统(日本尼康公司)、Mini-PROTEAN 垂直电泳仪(北京君意垂直电泳仪公司)型Trans-Blot转印槽(Bio-Rad)。
1.4 实验方法
1.4.1 动物造模及干预方法 50只8周龄雄性C57BL/6J小鼠按随机数字表法分为对照组,高脂组,模型组,激动剂组,抑制剂组,10只/组。适应性喂养1周后,空白组继续以普通饲料饲养,其余各组以高脂饲料喂养建立肥胖模型,每周对各组小鼠的体质量进行1次称量并记录数据,高脂饲料饲养14周后,高脂饲料喂养组体质量大于普通饲料喂养组体质量20%即为模型建立成功[14]。其中模型组注射β3肾上腺素受体激动剂CL316243皮下注射(0.1 mg/kg,1次/d),连续注射2周[15],以诱导白色脂肪米色化,激动剂组和抑制剂组给与注射β3 肾上腺素受体激动剂CL316243 的同时分别给与α7 nAchR选择性激动剂GST-21(腹腔注射,4 mg/kg,1次/d[16])、α7 nAchR 选择性拮抗剂α-BGT(腹腔注射,1 μg/kg,1次/d[17]),干预2周后处死各组小鼠。
1.4.2 标本获取 末次给药后,小鼠禁食10 h称质量,记录小鼠体质量。腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,麻醉后将小鼠置于解剖台上,留取附睾区白色脂肪组织,用于后续指标检测。
1.4.3 苏木素-伊红(HE)染色 将小鼠附睾区白色脂肪组织固定于脂肪固定液24 h以上,梯度脱水,石蜡包埋组织、切成5 μm厚片放置蒸馏水中浸泡2 min,HE染色5 min后,流水冲洗10 min,于95%乙醇中脱水处理2 min,二甲苯5 min,透明,重复洗涤2次,滴加中性树胶封片,晾干,于显微镜下进行观察、拍照、分析。
1.4.4 RT-qPCR检测白色脂肪中相关mRNA的表达水平 采用RT-qPCR检测UCP-1、PRDM16、Arg1、iNOS、PGC-1α mRNA表达水平,使用2-ΔΔCT法进行数据分析,引物序列见表1。

表1 RT-qPCR引物序列Tab.1 Sequence of primers for RT-qPCR
1.4.5 ELISA法检测白色脂肪中相关指标 取小鼠附睾区白色脂肪,严格按照ELISA试剂盒说明书进行操作,应用酶标仪测定450 nm的吸光度A490nm,以A490nm为横坐标,标准品浓度为纵坐标,根据标准曲线计算出小鼠白色脂肪中IL-1β、TNF-α、IL-10和TGF-β水平。
1.4.6 Western blot法检测白色脂肪 裂解液裂解白色脂肪,4 ℃、15000×g离心10 min,取上清,提取总蛋白,用蛋白定量试剂盒测定蛋白浓度,制备SDS-PAGE凝胶,半干转膜至PVDF膜,用5%脱脂奶粉摇床上封闭1 h,三羟甲基氨基甲烷缓冲盐水与补间(TBST)洗净加入一抗过夜,回收一抗用TBST洗净后,PVDF膜加入二抗摇床1 h。TBST洗净,滴加ECL化学发光液显影、成像。采用Image软件分析量化。
1.4.7 免疫组化 石蜡切片脱蜡至水,组织切片置于盛有抗原修复缓冲液(pH=6.0)的修复盒中于微波炉内进行抗原修复。自然冷却后洗涤3次。切片置于磷酸盐缓冲液(PBS)洗涤3 次,5 min/次。在组化圈内滴加3%BSA 均匀覆盖组织,加一抗过夜后用PBS在摇床上洗涤3次,之后加二抗室温孵育50 min,用PBS在摇床上洗涤3次。切片稍甩干后加钻石荧光显色液(DAB显色液),苏木素复染3 min,脱水封片,显微镜镜检,图像采集分析。
1.5 统计学分析
采用SPSS 21.0软件进行统计分析,计量资料以均数±标准差表示,两组均数之间比较采用独立样本t检验;多组间比较采用单因素方差分析,事后检验采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠体质量的变化
正式造模前,各组小鼠体质量无统计学差异(P>0.05),饲养14周后,高脂饲料喂养的各组小鼠体质量超过空白组体质量的20%以上,表明肥胖模型建立成功,高脂各组体质量明显高于空白组(P<0.01)。经药物干预2周后,模型组体质量低于高脂组(P<0.05),模型组低于抑制剂组(P<0.05),激动剂组组体质量低于模型组(P<0.01,表2)。
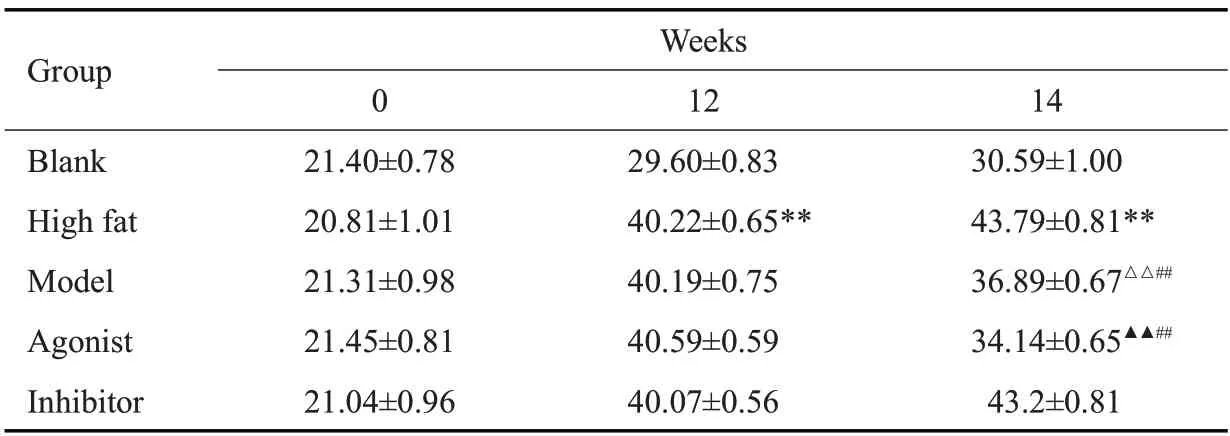
表2 各组小鼠体质量比较Tab.2 Comparison of body weight of the mice among the groups(g,Mean±SD,n=10)
2.2 激活α7 nAchR对白色脂肪脂滴的影响
在光镜下,与空白组相比,高脂组白色脂肪平均脂滴面积明显增大(P<0.01),与高脂组相比,模型组脂滴面积缩小(P<0.01),与模型组相比,激动剂组脂滴面积进一步缩小(P<0.05)。与高脂组、激动剂组相比,抑制剂组脂滴面积却较激动剂组和模型组增加(P<0.01,P<0.05,图1)。
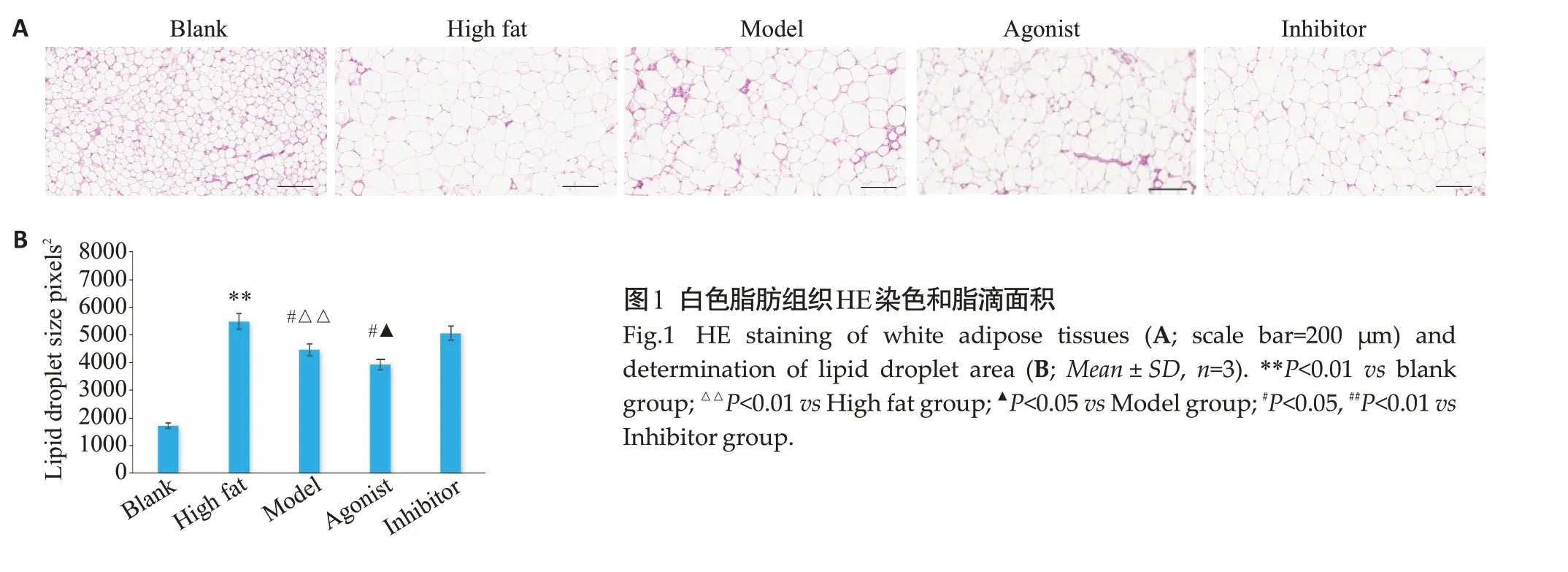
图1 白色脂肪组织HE染色和脂滴面积Fig.1 HE staining of white adipose tissues (A;scale bar=200 μm) and determination of lipid droplet area (B; Mean±SD, n=3).**P<0.01 vs blank group;△△P<0.01 vs High fat group;▲P<0.05 vs Model group;#P<0.05,##P<0.01 vs Inhibitor group.
2.3 激活α7 nAchR对白色脂肪米色化产热的影响
PCR结果显示,与空白组相比,高脂组小鼠白色脂肪组织UCP-1、PRDM-16、PGC-1α mRNA水平分别下降(P<0.01),与高脂组小鼠相比,模型组UCP-1、PRDM-16、PGC-1α mRNA 较空白组分别升高(P<0.01)。与模型组相比,激动剂组UCP-1、PRDM-16 mRNA 水平较模型组升高(P<0.01),PGC-1α mRNA 水平升高,但差异无统计学意义。与模型组、激动剂组相比,抑制剂组UCP-1、PRDM-16、PGC-1α mRNA 水平分别降低(P<0.01)。免疫组化结果显示,与空白组相比,高脂组小鼠白色脂肪组织UCP-1表达水平下降(P<0.01)。与高脂组相比,模型组UCP-1表达水平升高(P<0.01)。与高脂组、模型组、抑制剂组相比,激动剂组UCP-1表达水平升高(P<0.01,图2、3)。
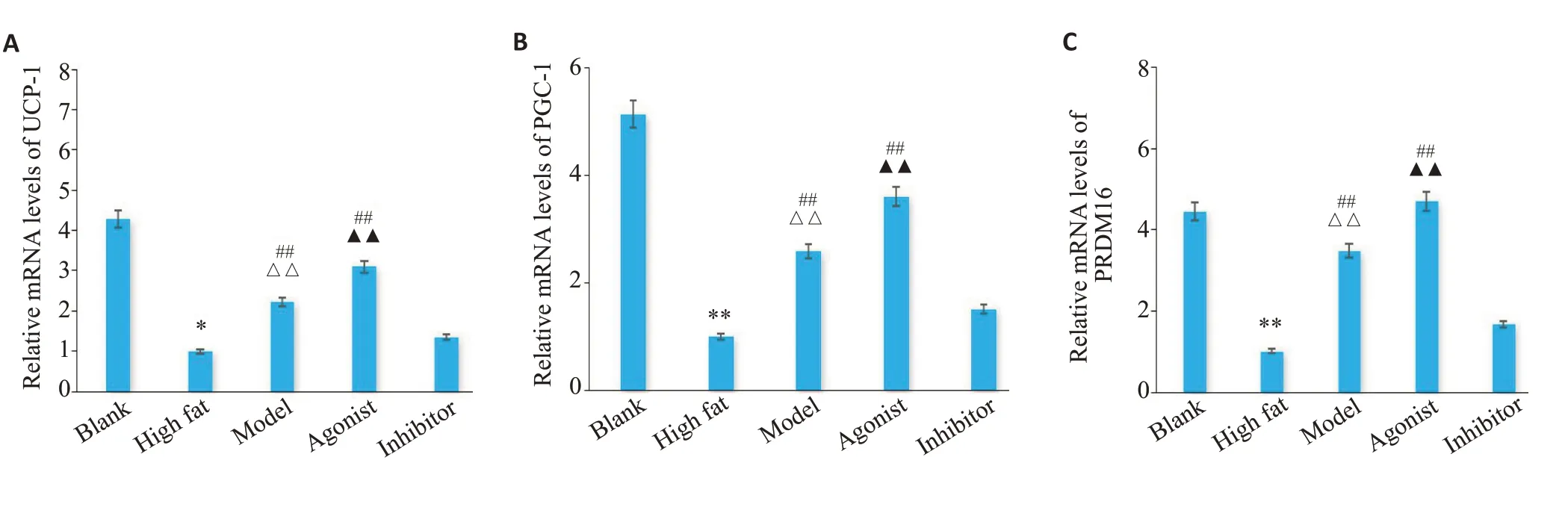
图2 各组小鼠白色脂肪组织UCP-1、PRDM16及PGC-1α的mRNA表达水平Fig.2 Expression levels of UCP-1 (A),PRDM16 (B) and PGC-1α (C) mRNAs in the white adipose tissue of the mice in each group.Data are presented as Mean±SD(n=3).*P<0.05,**P<0.01 vs Blank group;△△P<0.01 vs High fat group;▲▲P<0.01 vs model group;##P<0.01 vs Inhibitor group.

图3 各组小鼠白色脂肪组织UCP-1的免疫组化阳性表达水平Fig.3 Protein level of UCP-1 in the white adipose tissue of the mice in each group detected by immunohistochemistry(A;scale bar=50 μm)and quantitative analysis of the optical density(B;Mean±SD,n=3).**P<0.01 vs blank group;△△P<0.01 vs High fat group;▲▲P<0.01 vs model group;##P<0.01 vs Inhibitor group.
2.4 激活α7 nAchR对白色脂肪炎症标志物及炎症因子的影响
与空白组相比,高脂组iNOS mRNA、TNF-α、IL-1β水平升高(P<0.01),Arg1 mRNA、TGF-β、IL-10水平降低(P<0.01)。与高脂组相比,模型组iNOS mRNA、TNF-α、IL-1β水平升高(P<0.01),Arg1 mRNA、TGF-β、IL-10 水平降低(P<0.01)。与模型组相比,激动剂组iNOS mRNA、TNF-α、IL-1β水平降低(P<0.05),Arg1 mRNA、TGF-β、IL-10水平升高(P<0.01)。与模型组、激动剂组相比,抑制剂组iNOS mRNA水平、TNF-α、IL-1β水平升高,但差异没有统计学意义(P>0.05)。Arg1 mRNA水平、TGF-β、IL-10水平降低(P<0.05,P<0.01,图4)。
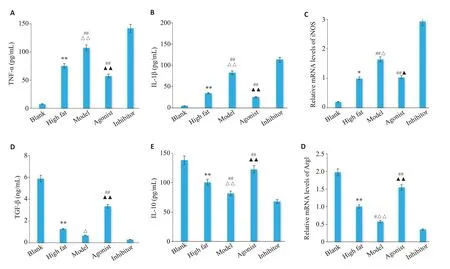
图4 各组小鼠白色脂肪组织中iNOS、Arg1 mRNA表达水平及炎症因子TNF-α、IL-1β、TGF-β、IL-10含量Fig.4 Expression levels of iNOS and Arg1 mRNA and the contents of TNF-α,IL-1β,TGF-β and IL-10 in the white adipose tissue of the mice in each group.A-C:Levels of proinflammatory factors released(A,B)and M1-type macrophage markers(C).D-F:Anti-inflammatory factors released(D,E)and M2-type macrophage markers(F).Data are presented as Mean±SD(n=3).*P<0.05,**P<0.01 vs Blank group;△P<0.05,△△P<0.01 vs High fat group;▲▲P<0.01 vs Model group;#P<0.05,##P<0.01 vs Inhibitor group.
2.5 激活α7 nAchR对白色脂肪CD206、CD86的影响
与空白组相比,高脂组CD86 表达水平上升(P<0.05),CD206 降低(P<0.01)。与高脂组相比,模型组CD86水平升高(P<0.01),CD206水平降低(P<0.01)。与模型组、高脂组相比,激动剂组CD86水平明显降低(P<0.05),CD206水平升高(P<0.01)。与模型组、高脂组相比,抑制剂组CD86水平升高,但差异没有统计学意义(P>0.05)、CD206 水平降低(P<0.05,P<0.01,图5A、C示CD206;B、D示CD86)。

图5 各组小鼠白色脂肪组织CD206、CD86的免疫组化阳性表达水平Fig.5 Protein levels of CD206 and CD86 in white adipose tissue of the mice in each group detected by immunohistochemistry(scale bar=50 μm).A,C:Immunohistochemistry for CD206 in the white adipose tissue in each group.B,D:Immunohistochemistry for CD86 in each group.Data are presented as Mean±SD (n=3).**P<0.01 vs Blank group;△△P<0.01 vs High fat group;▲▲P<0.01 vs Model group;##P<0.01 vs Inhibitor group.
2.6 激活α7 nAchR对白色脂肪促炎通路及抑炎通路的影响
与空白组相比,高脂组小鼠白色脂肪组织织α7 nAchR、p-STAT3、p-JAK2表达水平下降(P<0.05),NFκB p65表达水平上升(P<0.01)。与高脂组相比,模型组小鼠脂肪组织α7 nAchR、p-STAT3、p-JAK2表达水平下降(P<0.05),NF-κB p65表达水平上升(P<0.01)。与模型组相比,激动剂组α7 nAchR、p-STAT3、p-JAK2表达水平上升(P<0.01),NF-κB p65表达水平下降(P<0.01)。抑制剂组α7 nAchR、p-STAT3、p-JAK2表达水平较模型组、激动剂组下降(P<0.01),NF-κB p65表达水平较高脂组,激动剂组上升(P<0.01,图6)。

图6 各组小鼠白色脂肪组织中α7 nAchR、p-STAT3、p-JAK2、NF-κB p65蛋白表达量Fig.6 Protein expressions of α7 nAchR,p-STAT3,p-JAK2 and NF-κB p65 in white adipose tissue of the mice.A:Western blots of α 7 nAchR,p-STAT3,p-JAK2 and NF-κB p65 in each group.B-E:Quantitative analysis of the protein expressions(Mean±SD,n=3).*P<0.05,**P<0.01 vs Blank group;△P<0.05 vs High fat group;▲▲P<0.01 vs Model group;#P<0.05,##P<0.01 vs Inhibitor group.
3 讨论
肥胖是一种慢性、复发和多因素疾病,其特征是体内多余的脂肪组织堆积而成的,主要与白色脂肪组织中的炎症以及促炎M1巨噬细胞和其它免疫细胞增加有关。研究发现白色脂肪在交感神经刺激下可转化为米色脂肪,通过米色脂肪产热可起到减脂的作用[18]。既往研究证明,刺激白色脂肪交感神经可激活环磷酸腺苷/蛋白激酶A(cAMP/PKA)通路,促进脂肪甘油三酯脂肪酶(ATGL)、激素敏感性脂肪酶(HSL)和围脂滴蛋白(Perilipin)磷酸化,从而导致脂肪分解产生游离脂肪酸[19]。但是激活交感神经会强化IKKβ/NF-κB促炎通路活性[20],促进M1巨噬细胞分泌TNF-α、IL-1β因子,从而加重其炎症反应。Okla等[21]还发现激活M1型巨噬细胞表面toll 样受体4(TLR4)和Nod 样受体3(NLRP3)可导致脂肪细胞氧化应激和线粒体功能障碍,同样导致激活β3受体介导的白色脂肪“米色化”受到抑制,因此长时间激活交感神经会破坏白色脂肪组织微环境稳态,影响其产热效能。本研究结果显示高脂饮食后各组小鼠体质量均增加,而激动剂组较其它高脂饮食各组体质量减轻最为明显,产热因子UCP-1、PRDM-16、PGC-1α mRNA水平较模型组明显升高,说明了增加产热反应可促进白色脂肪的消耗,推动减脂。模型组的炎症反应加剧,提示激活β3受体促进产热的同时会破坏白色脂肪组织稳态,而使用α7 nAchR后,激动剂组不仅白色脂肪组织脂滴面积减少,且炎症水平降低。加用α7 nAChR受体抑制剂后可减弱上述作用,进一步提示激活α7 nAch后能能减轻机体炎症反应,促进白色脂肪米色化,增强产热效能。
既往研究证明,激活α7 nAChR后可通过增加环加氧酶2表达和前列素E2的合成来减少炎症反应治疗阿尔茨海默症[22]。Liu等[23]发现激活α7 nAChR可减轻碘乙酸单钠(MIA)诱导的关节疼痛退化和骨关节疼痛,通过比较正常人和膝骨关节炎患者发现,膝关节炎病患者α7 nAChR降低,自噬和细胞凋亡失衡。刘慧阳等[24]通过总结发现在抗抑郁作用的关键受体是α7 nAChR,它可以介导胆碱能抗炎途径(CAP)的激活表现良好的治疗抑郁效果。吴淑杰等[25]发现使用α7 nAChR激动剂GTS-21可以改善自主神经平衡,抑制NF-κB通路激活以及减少肾纤维化和炎症反应。齐勇等[26]综述说明α7 nAChR信号传导在肥胖诱导的慢性炎症中起关键作用,最终表明在肥胖机体内限制了α7 nAChR的表达。Kumi等[27]证明抑制α7 nAChR加剧了小鼠的肝脏炎症和纤维化。以上证据均证明了激活α7 nAChR可抵抗炎症,降低炎症反应带来的负面影响。
巨噬细胞可能受到多种因素影响,而改变其表型,M1巨噬细胞主要参与促炎反应,M2巨噬细胞主要参与抗炎反应,通过调节巨噬细胞的活化状态来改善炎症环境是治疗炎症类疾病的有效方法[28]。在高脂肪饮食小鼠模型中,调节M1、M2巨噬细胞平衡可改善高脂血症,炎症和心肌损伤,在疼痛发生时M2巨噬细胞可以分泌抑炎因子从而达到抑制疼痛的作用,M2巨噬细胞似乎是促进疼痛缓解的多种内源性途径的主要参与者[29]。促进M2 巨噬细胞的极化增加抗炎因子可以缓解脓毒血症患者的急性肾损伤[30]。大量证据表明调节M1、M2巨噬细胞的平衡在改善机体炎症反应方面有重要作用。
激活α7 nAChR受体可激活JAK2/STAT3通路以阻止NF-kB进入细胞核与DAN结合,抑制促炎因子转录合成[32],减少促炎因子TNF-α、IL-1β,增加抑炎因子TGF-β、IL-10的产生。实验中模型组小鼠应用β3受体激动剂后促使白色脂肪组织释放NE,作用于脂肪组织β-AR,增加cAMP水平和PKA活性,从而使白色脂肪组织产热基因UCP-1、PRDM16及PGC-1α等表达量增高。同时该组小鼠白色脂肪组织中促炎通路NF-κB p65表达水平上升、脂滴面积增大,提示β3受体激动剂可促进白色脂肪的产热反应,但加重其炎症反应,增强的炎症反应导致白色脂肪组织微环境稳态受损。实验中使用GTS-21激活激动剂组小鼠α7 nAchR后,促炎通路NFκB p65表达降低,抑炎通路p-STAT3、p-JAK2的表达升高,实验结果显示M1巨噬细胞标志物及其分泌的促炎因子降低,M2巨噬细胞标志物及其分泌的抑炎因子升高,提示M1/M2比值降低,机体炎症反应降低。此外研究表明,M1型巨噬细胞数量降低可弱化toll样受体4(TLR4)和Nod 样受体3(NLRP3)对脂肪组织的线粒体功能障碍的影响[33,34],我们的结果也提示α7 nAchR后白色脂肪组织产热相关基因UCP-1,激活表明激活α7 nAChR可以进一步降低脂滴面积,改善炎症水平,有利于维持白色脂肪组织的稳态,促进米色化产热效能。
综上所述,激活α7 nAchR可促进巨噬细胞M1型向M2型转化,降低M1/M2的比值;激活JAK2/STAT3通路;减少促炎因子TNF-α和IL-1β的释放,增加抑炎因子TGF-β、IL-10释放,从而减轻脂肪组织炎症反应,以维持白色脂肪组织微环境稳态,起到促进白色脂肪组织米色化、提高米色化产热效能的作用。
