产后阴道微生态的定性系统评价
2024-04-12闫梅王晓银罗同勇帅志容李宁王玉敏
闫梅王晓银罗同勇帅志容李宁王玉敏
(1. 四川省妇幼保健院•四川省妇女儿童医院,四川 成都 610000;2. 成都中医药大学附属医院,四川 成都 610000;3. 四川省妇幼保健院米易分院•米易县妇幼保健院,四川 攀枝花 610000)
女性阴道微生态体系是以女性生殖解剖为基础,阴道内微生态菌群在妇科内分泌激素调节下稳定与变化的状态[1]。在健康女性阴道内的多种微生物中,乳酸杆菌占据半壁江山,从而形成了阴道内PH 酸性环境的生理屏障,减少泌尿生殖道的感染[2]。产后是女性生命周期中一个特殊的生理阶段,雌激素水平较妊娠期折棍性下跌,微生态从而随之改变。高通量16S rDNA 测序检测技术可鉴定阴道微生物菌群[3],对比传统培养模式在探索阴道微生物菌落多样性等方面更有优势[4]。为了解产后这个特殊阶段的阴道微生态的状况,将国内外采用高通量16S rDNA 测序检测技术针对产后阴道微生态的相关研究进行了描述性系统评价,为后续的研究奠定基础。
1 方法
1.1 检索资源与策略
检索数据库包括中国生物医学文献数据库(CBM)、中国知网(CNKI)、万方数据库、维普数据库、中国临床试验注册中心,PUBMED、embase、WOS、Cochrane。检索策略采用主题词加自由词,中文检索内容包含阴道 /生殖道、微生态 / 菌群 /微生物 /细菌 /菌落、产后期/产后,英文检索内容包含Vaginal/Vaginas/Reproductive tract,Microbiota/Flora,Microbiome/Microbiotas/Microbial/Microbiome/Microb iomes,Postpartum Period/Postpartum/Puerperium。检索时间从1966 至2022 年12 月所收录的文献。手工检索综述类的参考文献、灰色文献等以确定可能遗漏的研究。
1.2 纳入排除标准
纳入标准:全文文献;纳入标准研究对象:产后阶段的妇女,不限种族、国家;采用采用高通量16S rDNA 测序检测技术分析阴道分泌物;研究至少包含1 项核心主题:产后的菌群结构特征、阴道菌型分布、产后阴道微生态的生物多样性、产后与孕期及非孕期的差异性菌属;语种:中英文。排除标准:重复发表;个案报道;综述类、信函类文献。
1.3 文献筛选
由2 名研究者独立完成标题的筛选、摘要及潜在合格的全文及结果的提取。
第3 名研究者回顾所有最终决定,并团队讨论解决分歧。
1.4 纳入研究定性评估
采用英国公共卫生资源组织提供的关键评价方案(Critical Appraisal Skills Program,CASP)工具对论文质量进行评价[5],采用定性系统评价证据分级工具(Certainty of Qualitative Studies,CERqual)工具对结果信度进行评估[6]。
1.5 文献合并方法
采用定性荟萃分析的方法归纳合并结果。首先针对每个研究结果进行提取编辑,然后按照主题分类,在共同的主题下,对不同结果进行提炼和归纳合成[7]。
2 结果
2.1 文献筛选结果
检索各数据库共得出1783 篇文献,去重后剩1270 篇,根据题目和摘要进行筛选后,选定56 篇文献进行全文筛选,最终确定10 篇文献纳入分析。文献筛选流程见图1。

图1 文献筛查流程图
2.2 纳入研究基本特征及文献质量评价
共纳入5 个国家(马拉维[8]、美国[9-11]、非洲尼日利亚[12]、中国[13-16]、英国[17])的10 项研究,总样本量为2586。研究质量等级评价,5 项高质量评价,5项为中等质量评价。详见表1 及表2。

表1 纳入研究基本特征
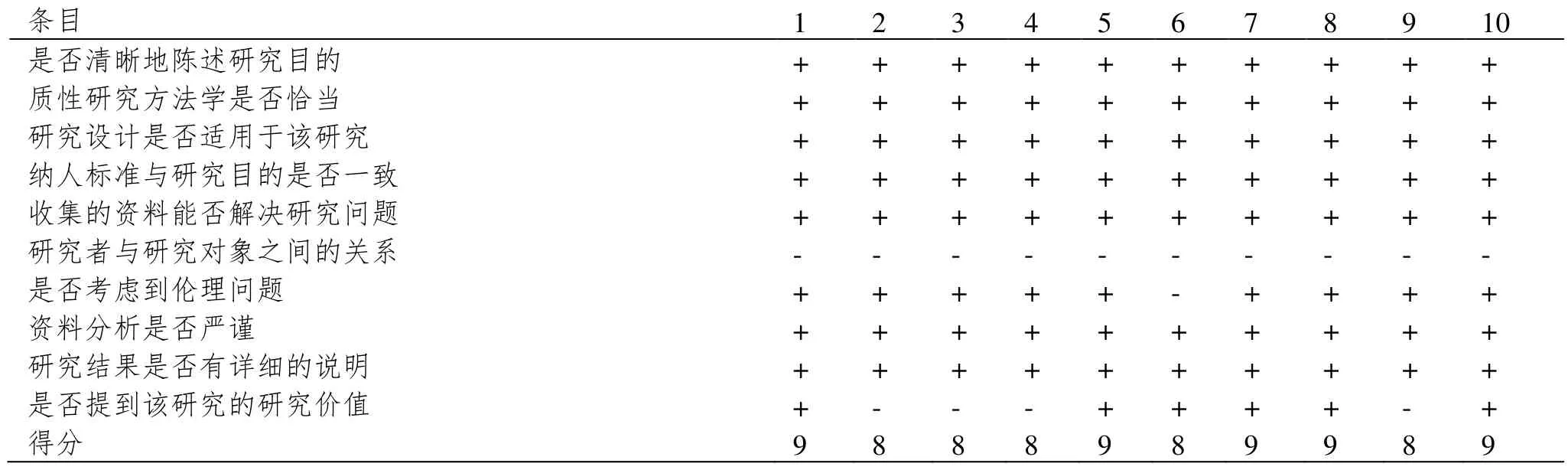
表2 文献质量评价
2.3 主题综合结果
综合10 项研究对产后阴道微生态的4 大核心主题,包括产后的菌群结构特征、菌型(Community state types, CST)分布、产后阴道微生态的生物多样性、产后与孕期及非孕期的差异性菌属,进行了归纳分析和和证据分级。
2.3.1 产后的菌群结构特征
生殖道菌群结构在产后阶段表现为特征性,从产前以乳酸菌为主,转变为混合社区群聚类,即厌氧菌、尤其是加德纳菌为主[10,12]。产后1 周后主要以加德纳菌为主,到了产后6 周,其他厌氧菌如普氏菌属、霍氏菌属、链球菌、奇异菌属等比例增加[9,14]。该结果纳入7 个研究,方法学质量高,相关性强,一致性好,涵盖5 个国家,包括马拉维、美国、尼日利亚、中国、英国,包含中低高收入国家,证据充分。综上,结果信度为“高”。见表3。

表3 产后阴道微生态4 大核心主题证据分级
2.3.2 产后的阴道菌型
生殖道菌群分四种CST。孕期女性阴道乳杆菌菌属主要以惰性乳酸杆菌为主要成分的CST III 型和卷曲乳杆菌为主导的CST I 型构成[14]。产后主要惰性乳酸杆菌为主要成分的 CST III,CST IV-A 构成。其中,CST- IV 的菌型在产后明显增多,并与种族无关[12,16]。产后一周,CST 以CST III、CST IV-A、CST IV-B、CST IV-C、CST IV-D 为主[8]。到了产后42 天时,转变为CST III 与CST IV-A 为主的菌型[14]。该结果纳入4 项研究,方法学质量高,相关性强,一致性好,涵盖4 个国家包括马拉维、尼日利亚、中国、英国,包含中低高收入国家,证据充分。综上,结果信度为“高”。见表3。
2.3.3 产后的阴道微生态菌种生物多样性分析
有研究表明,育龄非孕期妇女到了产后阶段,阴道群落丰富度指数和群落多样性指数变化较前无差异,提示其阴道微生态的生物多样性未发生明显变化[13]。有些文献对健康女性从妊娠到产后进行追踪],产后的α多样性对比妊娠早期和晚期明显增加,Shannon 多样性指数对比整个孕期,产后阶段最高[9,12,14]。在β多样性方面,主坐标分析也显示了妊娠和产后样本之间的清晰分离[12]。对比妊娠各阶段的女性,产后组菌群结构多样性最高,丰度和多样性均有所增加[12,14]。该研究纳入7 项研究,方法学质量高,相关性强,一致性好,涵盖5 个国家包括马拉维、美国、尼日利亚、中国、英国,包含中低高收入国家,证据充分。综上,结果信度为“高”。见表3。
2.3.4 产后和正常非孕期主要的差异菌
健康非孕期妇女阴道内优势菌为乳酸杆菌,占所有细菌的55%[15]。在产后阶段乳酸杆菌丰度减少,种类增加,其占比明显少于孕期各阶段[9]。产后的卷曲乳杆菌(Lactobacillus crispatus),较育龄非妊娠期及妊娠早期和晚期明显减少,惰性乳杆菌(Lactobacillus iners)较育龄非妊娠期明显减少,而与妊娠早期和晚期类似[8,9]。格氏乳杆菌(Lactobacillus gasseri)、詹氏乳杆菌(Lactobacillus jensenii)也明显减少甚至消失,短乳杆菌属(Lactobacillus brevis)和人乳杆菌属(Lactobacillus coleohominis)因含量少,反而变化不明显[8,9]。在产后妇女阴道内,梭菌目(clostridiales)、嗜胨菌属(Peptoniphilus)、不动杆菌属(Acinetobacter)等几类菌显著增加,变性菌门(Proteobacteria)的增加幅度较小,而厚壁菌门(Firmicutes)大幅度减少[13,16]。在非乳杆菌占主导地位的阴道微生物群中被抑制的乳酸菌为阴道乳杆菌(Lactobacillus vagalis)和惰性乳杆菌((Lactobacillus iners),他们的“坚定”盟友是加德纳菌和脲原体。该研究包含7 个研究,方法学质量高,相关性强,涵盖4 个国家包括马拉维、美国、尼日利亚、中国,中低高收入国家均纳入,证据充分性好,数据较薄弱,一致性不明确。综上,结果信度为“中”。见表3。
3 讨论
产褥期是由妊娠期逐步恢复到非孕期状态的过程。产后42 天就是一个时间节点,此时除乳腺外,其他的女性生殖系统基本恢复到育龄未孕状态,选择此时有利于观察产后微生态的恢复情况,以比较育龄非孕期、妊娠期的差异[18]。
健康非孕期女性的阴道内有20 余种细菌,可分为常驻菌、过路菌和偶见菌。常驻菌包括乳酸杆菌(Lactobacillus)、加德纳菌属(Gardnerella)、链球菌(Streptococcus)、奇异菌属(Atopobium)、普氏菌属(Prevotella)、不动杆菌属(Acinetobacter)、梭杆菌属(Fusobacterium)、霍氏菌属(Hallella)等[19]。乳酸杆菌作为占据半壁的优势菌群,通过占据空间,分解糖原产生乳酸等方式竞争性压缩其它菌群的生长空间,另外协同免疫调节维持着PH 酸性的阴道内环境,从而阴道微生态达到“稳态”,预防感染[14]。妊娠期因为胎盘功能,雌激素水平大幅度增加,阴道内鳞状上皮细胞内糖原含量上升,其分解产生的多种成分利于乳酸杆菌定植,因此孕期与非孕期健康女性菌群特征保持一致,依然是乳酸杆菌占优势,是阴道菌群中最稳定的部分[14]。而产褥期雌激素水平下降,乳酸杆菌减少,产后的优势菌转变成厌氧菌。阴道菌群有四种CST,孕妇的生殖道菌群以CST III 型和CST I 型为主,与非妊娠期类似[20],产后一周,CST 以CST III 和CST IV 的4 个亚型为主[8]。到了产后42 天,则主要是CST III 与CST IV-A[14]。CST IV-A 中加德纳菌相对丰度较高,还包含有奇异菌属、链球菌属、普氏和霍氏菌属,优势菌的转变引发阴道PH 值上升,使得CST IV 的细菌有机会成长起来。
产后的阴道微生态菌种多样性,与非孕期健康女性无明显差异,而与妊娠早、中、晚期相比,其α多样性和β多样性均最高],其中乳酸杆菌的菌种增多,丰度下降[9,12]。这些变化和产后恶露、雌激素水平波动、分娩损伤、手术、产后盆底功能障碍有关[21,22]。乳酸杆菌通过创造一个PH 酸性的阴道环境来抑制其他细菌的生长,而产后恶露、碱性分泌物冲刷阴道,PH 升高,阴道自然屏障功能受损,阴道内环境不利于乳酸杆菌繁殖,进一步减少它的丰度。而产后一周,母体循环中雌激素水平可降低100~1000 倍,血清E2在产后第一周可下降到20pg·mL-1,在产后6 个月有所增加,这与哺乳期女性产后4-6 月恢复月经也是吻合的。类似于绝经对微生态的影响,雌激素水平的降低,继发性的引起阴道上皮厚度的减少,糖原含量的减少和可用性的下降,糖原是乳酸杆菌的代谢原材料,从而影响其丰度],增加了阴道对条件致病菌的易感性,影响产后微生态的稳定性和自净能力,增加了阴道感染的风险[23-25]。有研究显示,妊娠期间体内甾体激素如雌激素、孕激素水平升高,L.crispatus 丰度也高[12]。而产后阴道干燥和萎缩也与上皮细胞结构、屏障功能基因的下调和炎症相关基因的上调有关[16]。还有研究提示,从怀孕到产后,透明质酸钠、热休克蛋白70 水平升高,D-乳酸、L-乳酸水平下降,热休克蛋白70 和透明质酸碎片激活促炎免疫反应,这将改变阴道上皮和免疫系统的特性,D-乳酸,L-乳酸为阴道提供多重保护机制的能力,包括对阴道内病原体的抑制,促进阴道上皮细胞DNA 修复,增强先天免疫和适应性免疫[9,26,27]。这些都对产后微生态的变化产生协同作用,提示随着胎盘娩出,雌激素水平迅速下降,孕期稳定的乳酸杆菌优势菌群和阴道化合物水平迅速发生相应的改变,出现从乳酸菌主导的微生物群向非乳酸菌主导的微生物群转变[12]。而产后如果雌激素水平的恢复出现延迟,产后相当长一段时间阴道菌群丰度较低,这也从另外一个方面提示了产后微生态和雌激素水平的关系。
此外,妊娠期不同型别的阴道乳杆菌属可以调节菌群构成和诱导多样性的稳定性改变。妊娠期菌属为L.crispatus 类型,可促进其稳定性。菌属为L.gasseri或L.iners,则可在诱导后期菌群构成和多样性变化上有一定的倾向性[28]。所以,这可能是各研究对产后与妊娠期、非孕期的差异菌属不完全一致的原因。
阴道微生态与人体之间通过共进化、共发育、共代谢、互调控等方式进行相互作用,增强宿主固有免疫功能,调节机体适应性免疫,抑制病毒和细菌,增强上皮细胞屏障功能等,对女性生殖道乃至全身健康产生深远影响29-31]。阴道微生态紊乱的状态,不仅仅会促进阴道感染发病率的增加,而且还和其他妇科疾病如HPV 感染,宫颈病变如CIN 的进展甚至妇科肿瘤的发生关系密切[25,32-36]。而产后特殊的生理状态,会导致产后宫颈阴道微生态群紊乱的状况,从而打破女性下生殖道的稳态,诱发亚临床炎症反应,持续在免疫失调状态,甚至导致子宫内膜异位症等疾病的发生[37]。因此,了解妇女产后的阴道微生态状况及其变化,我们可以对产后妇女尝试采取有效的治疗措施,比如益生菌、局部雌激素的补充来尽快改善阴道微环境,使其尽快向健康非孕期妇女转化,以减少产褥感染及妇科疾病的发生率。从纵向研究的角度来看,阴道微生物群在妊娠期、产后的变化与妊娠期并发症比如妊娠期糖尿病、胎膜早破、早产等是否有关系,后续需要进一步的研究。
这些研究可为分析和寻找更有利于妊娠结局的细菌比例及成分、健康妊娠进展的生物标志物、不良妊娠结局的生物标志物奠定基础,也可为筛选和发育适合中国女性生殖道健康的益生菌群提供基础,从而在孕期及产后积极干预,调节阴道微生物组减少妊娠期并发症的发生率,促进新生儿下呼吸道有益菌的种植,维护孕产妇及新生儿健康[38]。
