黄芪提取物对帕金森病小鼠黑质区白介素-17通路的影响
2024-04-10关勇宇张广润李海龙邵菲菲
关勇宇,张广润,李海龙,邵菲菲
(1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省人民医院,甘肃 兰州 730000)
帕金森病(Parkinson’s disease,PD)是一种与年龄相关的神经系统退行性病变,临床主要表现为姿势平衡障碍、肌肉强直、静止性震颤、动作迟缓等,严重影响患者生活质量[1-2]。流行病学调查数据显示,我国65岁以上人群PD患病率达1.7%[3-4]。黑质致密区多巴胺能神经元变性或坏死是PD发生的主要病理机制,故临床主要通过服用多巴胺类或多巴胺受体激动剂类药物治疗PD,虽能一定程度上改善患者症状,但该疗法无法阻断神经元丢失[5]。现代研究证实,神经炎症损伤在PD退行性病变过程中具有主导作用[6],其中辅助性T淋巴细胞17(Th17)合成分泌的促炎介质白介素(IL)-17信号通路异常在神经退行性病变PD发生和发展中扮演重要角色[7]。
中医将PD划为“颤证”范畴,多与肝、脾、肾等脏腑功能有关,肝气横逆克伐脾土,脾胃受损会导致中州运行不畅,肠腑功能不通[8]。中医学在PD治疗方面积累了丰富的经验,多种中草药可通过多个通路或靶点治疗PD等神经退行性疾病。黄芪作为一种补气良药,具有补肾健脾之功效,同时其活性成分黄芪黄酮、黄芪皂苷、黄芪多糖等均具有良好的抗炎、抗氧化和神经保护等功效[9-11],在保护PD神经元方面具有潜在价值[12],但关于黄芪治疗PD的具体作用机制和路径目前尚未完全阐明。本研究以1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导构建的PD小鼠模型为对象,观察黄芪提取物对模型小鼠的运动功能和IL-17信号通路中抗肿瘤坏死因子受体相关因子6(Tumor necrosis factor receptor-associated factor 6,TRAF6)、核因子-κB(Nuclear factor-κB,NF-κB)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、环氧合酶-2(Cyclooxygenase,COX-2)等蛋白表达水平的影响,以探究黄芪提取物治疗PD的可能途径。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:从湖南斯莱克景达实验动物有限公司购买30只8周龄雄性C57BL/6小鼠[许可证:SCXK(湘)2021-0012]为研究对象。小鼠于光照黑暗交替各12 h环境中适应性喂养7 d,饲养环境内相对湿度控制在50%~60%,温度24 ℃左右。
1.1.2 实验试剂:黄芪饮片(批号202306005,云南好医生云福中药饮片有限公司);葡萄糖(批号23B1601,天津鼎盛鑫);黄芪皂苷Ⅳ(批号84687-43-4,天津士兰科有限公司);芦丁(批号207671-50-9,上海一基生物);MPTP(批号28289-54-5,百灵威);丙磺舒(批号57-55-9,武汉合中);RIPA裂解液(批号R0010,Solarbio);BCA试剂盒(批号PC0020,北京索莱宝);兔抗IL-17(批号600-401-BU8,武汉艾美捷);兔抗TRAF-6(批号:P4044Rb-h,上海丽臣商贸有限公司);兔抗NF-κB(批号YT746,北京百奥莱博);兔抗IL-1β(批号103-P11,德国Relia Tech);兔抗IL-6[批号Rab(P)17162,上海圻明生物];兔抗TNF-α(批号103-P35,德国Relia Tech);兔抗COX-2(批号AF-0010,北京鼎国昌盛);辣根过氧化物酶标记的山羊抗兔二抗(批号A21020,武汉艾美捷)。
1.1.3 实验仪器:旋转蒸发仪(型号RE-52,北京欧莱德);真空恒温干燥箱(型号HE-WD-300,东莞豪恩);紫外分光光度计(型号721,上海赫尔普);转棒疲劳仪(型号ZL-200C,安徽耀坤)。
1.2 实验方法
1.2.1 黄芪提取物制备:取200 g黄芪饮片,加入1000 ml蒸馏水浸泡30 min,开大火煮沸转中火煎煮30 min,纱布过滤;残余药渣再次加500 ml蒸馏水煎煮30 min后过滤;取2次滤液倒入旋转蒸发仪中,于60 ℃条件下水浴浓缩,恒温干燥箱干燥成粉。以葡萄糖、黄芪皂苷Ⅳ和芦丁为标准样品,紫外分光光度法测得黄芪提取物中总黄芪多糖、黄芪皂苷及黄芪黄酮含量分别为64.33%、0.74%和10.35%。提取黄芪干燥物保存备用。
1.2.2 实验分组与建模:将小鼠随机均分为五组,每组6只。模型组和各浓度黄芪组均腹腔注射MPTP诱导构建PD模型。每日晨起8:30按照30 mg/kg的剂量腹腔注射MPTP试剂,60 min后按照250 mg/kg的剂量注射丙磺舒,1次/d,连续注射5 d;对照组相同时间内腹腔注射等量0.9%氯化钠溶液。从第6天开始,低、中、高浓度黄芪组分别在相同时间以50、100、200 mg/kg的黄芪提取物对小鼠进行灌胃,1 d/次,连续灌胃14 d;模型组和对照组则以相同方式以等量0.9%氯化钠溶液灌胃。末次给药后次日对小鼠进行转棍实验和爬杆实验,断头取脑,去掉小鼠头皮与颅骨,迅速分离出各组小鼠大脑黑质组织,-80 ℃保存待用。
1.2.3 小鼠行为表现:①转棍实验。建模前3 d开始,将小鼠置于直径3 cm转棒仪棍棒上,设置启动速度为5 r/min,从起始转速增加至15 r/min,训练小鼠使之能在最大转速时停留于转棒时间达到120 s。末次灌胃后次日测试三组小鼠在转速为15 r/min时于棍棒上保持时间,记为掉落潜伏期,每只小鼠做3次,取平均值;最后采用梯形算法计算三组小鼠总体棍棒评分。②爬杆实验。选择直径1 cm、高度50 cm、顶端带有直径3 cm圆球的爬杆,爬杆具有防滑处理。于建模前1 d将小鼠置于圆球上,观察小鼠头向下时间(T1),若其在圆球上停留时间超过30 s,则引导小鼠沿杆向下爬行,记录小鼠由杆顶爬至杆底所用时间(T-LA),重复3次。末次灌胃后次日再次测试三组小鼠T1和T-LA。
1.2.4 免疫组化测定酪氨酸羟化酶:分离脑黑质致密区(Substantia nigra pars compact,SNpc)组织,常规石蜡包埋、切片、烤片、二甲苯脱蜡、酒精梯度水化,室温封闭20 min,滴加浓度为1∶100的酪氨酸羟化酶(Tyrosine hydroxylase,TH),4 ℃孵育过夜,添加二抗,室温孵育90 min,添加新鲜配制的DAB显色液,显微镜下观察,以棕黄色或棕褐色为阳性表达,计算阳性表达率。
1.2.5 Th17细胞数目测定:分离SNpc组织,4%多聚甲醛溶液固定,常规石蜡包埋、切片、烤片、二甲苯脱蜡、酒精梯度水化、非免疫血清37 ℃封闭20 min后,采用CD4+、RORrt荧光抗体,4 ℃孵育过夜;加入二抗37 ℃条件下孵育90 min,添加DAPI进行细胞核染色,封片。倒置荧光显微镜下观察染色情况,400倍镜下观察切片Th17阳性细胞数目,取连续10个视野计算平均阳性细胞数。
1.2.6 Western blot检测相关蛋白相对表达量:取分离得到小鼠纹状体脑组织,加入RIPA裂解液,置于冰上做匀浆处理;4 ℃,15000 r/min离心15 min,分离上清液至EP管中。取1 μl上清液,采用BCA试剂盒测定样品中蛋白质浓度;其余部分按照1∶4加入5×加载缓冲液,95 ℃变性5 min,冰上冷却后电泳,并转至PVDF膜上,10%脱脂奶粉摇床上封闭处理1 h。分别加入IL-17、TRAF-6、NF-κB、IL-1β、IL-6、TNF-α、COX-2一抗和β-actin(内参),4 ℃孵育过夜,TBST缓冲液冲洗3次,5 min/次,加入辣根过氧化物酶标记的二抗,室温孵育1 h,TBST冲洗3次,5 min/次,增强化学发光法显色。Image-Lab 6.1凝胶图像分析系统扫描计算各组小鼠SNpc区组织中IL-17、TRAF-6、NF-κB、IL-1β、IL-6、TNF-α、COX-2蛋白相对表达量。
1.3 统计学方法 运用SPSS 22.0统计学软件进行数据分析。计量资料以均数±标准差表示,行单因素方差分析后采用LSD检验;P<0.05为差异具有统计学意义。
2 结 果
2.1 各组小鼠行为表现情况比较 见表1。与对照组比较,模型组和各浓度黄芪组小鼠转棍掉落潜伏期明显缩短,爬杆实验的T1和T-LA明显延长(均P<0.05)。与模型组比较,各浓度黄芪组小鼠转棍掉落潜伏期明显延长,爬杆实验的T1和T-LA明显缩短(均P<0.05),且黄芪提取物浓度呈剂量依赖性。
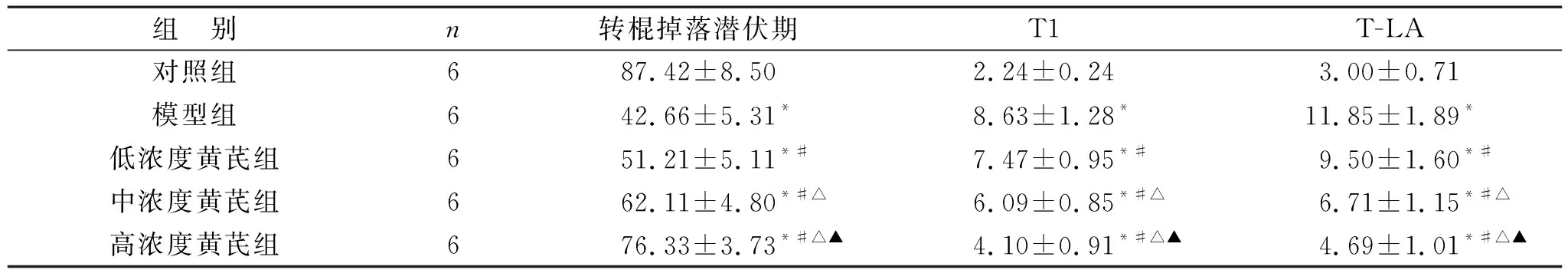
表1 各组小鼠行为表现情况比较(s)
2.2 各组小鼠SNpc区TH表达和Th17细胞数目比较 见表2。与对照组比较,模型组和各浓度黄芪组小鼠SNpc区TH表达水平下降,Th17细胞数目增多(均P<0.05)。与模型组比较,各浓度黄芪组小鼠SNpc区TH表达水平升高,Th17细胞数目减少(均P<0.05),且与黄芪提取物浓度呈剂量依赖性。
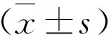
表2 各组小鼠SNpc区TH表达和Th17细胞数目比较
2.3 各组小鼠IL-17、TRAF-6和NF-κB蛋白表达水平比较 见表3。与对照组比较,模型组和各浓度黄芪组小鼠IL-17、TRAF-6和NF-κB蛋白相对表达水平升高(均P<0.05)。与模型组比较,各浓度黄芪组小鼠IL-17、TRAF-6和NF-κB蛋白相对表达水平下降(均P<0.05),且与黄芪提取物浓度呈剂量依赖性。
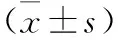
表3 各组小鼠IL-17、TRAF-6和NF-κB蛋白表达水平比较
2.4 各组小鼠IL-1β、IL-6、TNF-α、COX-2蛋白表达水平比较 见表4。与对照组比较,模型组和各浓度黄芪组小鼠IL-1β、IL-6、TNF-α、COX-2蛋白相对表达水平升高(均P<0.05)。与模型组比较,各浓度黄芪组小鼠IL-1β、IL-6、TNF-α、COX-2蛋白相对表达水平下降(均P<0.05),且与黄芪提取物浓度呈剂量依赖性。
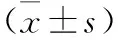
表4 各组小鼠IL-1β、IL-6、TNF-α、COX-2蛋白表达水平比较
3 讨 论
小胶质细胞异常激活和黑质区多巴胺能神经元丢失是PD主要病理改变,然而,关于多巴胺能神经元变性坏死的病理机制目前尚未完全明确。目前认为PD发生与年龄、细胞凋亡、兴奋性神经毒、氧化应激、免疫炎症异常等有关[13-14]。现代研究证实,PD存在明显的免疫炎症失调,纹状体炎症可通过激活小胶质细胞,诱导黑质区多巴胺能神经元变性死亡[15]。传统PD治疗以补充多巴胺为主,但长期服用药物可能会引发药物相关性运动波动和运动障碍,而且对神经元保护作用不明显[16]。探究具有神经保护作用的PD治疗方法成为临床工作者努力的方向。
黄芪是一种具有补气固表、补血生肌、利尿排脓等功效的中草药,其提取物中含有黄芪多糖、黄芪黄酮、黄芪皂苷等多种活性成分,可通过增强机体抗氧化能力,从而维持大脑组织中神经细胞完整性,延缓或改善神经元的退行性病变[17];同时,可通过降低炎症细胞激活,减少神经细胞凋亡,抑制中枢神经系统的炎症浸润和神经元的炎症损伤[18]。现代研究阐明,黄芪提取物可通过多靶位点、多通路发挥PD治疗作用[19-20]。小胶质细胞作为大脑组织中固有免疫细胞,与T淋巴细胞、自然杀伤性细胞、白细胞等共同参与神经元损伤后免疫反应[21]。研究证实,在PD患者大脑SNpc区存在明显CD4+、CD8+T淋巴细胞浸润现象,T淋巴细胞会损伤血脑屏障,引发局部特异性免疫反应,从而导致淋巴细胞侵入中枢神经系统,引发中枢神经系统神经元的免疫性损伤破坏[22]。Th17细胞是CD4+T淋巴细胞经抗原提呈刺激后分化而来的T淋巴细胞,可分泌IL-17、TNF-α、IL-21等多种促炎介质,其中IL-17是Th17细胞的主要效应因子,也是T细胞诱导炎症反应的早期启动因子,可通过TRAF6/NF-κB、TRAF6/AP-1、TRAF6/MAPKs/AP-1等多种途径,启动IL-1β、IL-6、TNF-α、COX-2等炎症介质转录,诱发局部炎症性损伤[23]。有关研究表明,敲除IL-17基因可抑制MPTP诱导的小胶质细胞激活及其激活后形态与功能损伤[24]。
本研究通过比较发现,MPTP诱导的PD模型小鼠转棍掉落潜伏期明显缩短,爬杆实验的T1和T-LA明显延长,SNpc区TH表达水平明显下降,Th17细胞数目和IL-17相对表达量明显升高。说明Th细胞激活和IL-17上调表达是促进多巴胺神经元丢失的重要机制。TRAF6和NF-κB是IL-17信号通路下游必不可少的衔接蛋白,其中TRAF6是ACT1的关键底物;NF-κB是与T淋巴细胞发育、免疫细胞激活、炎症反应等有关的炎症转录因子,NF-κB激酶抑制物相关激酶与ACT1相互作用,参与IL-17介导的NF-κB激活[25]。IL-17/NF-κB信号通路激活被证实是导致PD神经元死亡的重要原因之一[26]。本研究对比显示,与模型组相比,黄芪组小鼠转棍掉落潜伏期明显延长,爬杆实验T1和T-LA明显缩短,SNpc区TH表达水平升高,Th17细胞数目减少,纹状体区IL-17、TRAF-6、NF-κB、IL-1β、IL-6、TNF-α、COX-2蛋白相对表达水平明显下降,提示黄芪提取物可通过抑制IL-17信号通路激活,保护多巴胺能神经元的炎症性凋亡,改善PD小鼠行为表现。此外,本研究结果显示,黄芪提取物对PD小鼠的影响作用与黄芪提取物浓度显著相关,随着黄芪提取物灌胃浓度增加,其对PD小鼠行为表现、SNpc区TH表达水平、Th17细胞数目、IL-17、TRAF-6、NF-κB、IL-1β、IL-6、TNF-α、COX-2表达水平的影响作用逐渐增强。
综上所述,黄芪提取物能有效改善PD模型小鼠活动能力,保护SNpc区TH阳性神经元,其机制可能与抑制IL-17/TRAF-6/NF-κB信号通路,减少多巴胺神经元的炎症性损伤凋亡有关。
