益肺汤调控TGF-β1/Smad2通路抗肺纤维化机制研究
2024-04-10邓祥丽陈丽娟吴海茵马信文
邓祥丽,陈丽娟,邵 梅,吴 梅,杨 梅,吴海茵,马信文,黄 芬
(1.云南中医药大学第一临床医学院,云南 昆明 650051;2.云南中医药大学第一附属医院,云南 昆明 650021)
肺纤维化(Pulmonary fibrosis,PF)是一种慢性、进行性、年龄相关性的间质性肺疾病,其病理特征为成纤维细胞增殖、细胞外基质沉积(Extracellular matrix,ECM)、肺结构破坏及其功能丧失,临床主要表现为活动性呼吸困难,呈进行性加重,预后多不良,最终因呼吸衰竭而死亡[1-2]。PF好发于老年人,起病隐匿,属肺系难治性疾病,其发病率逐年上升,中位生存期仅为3~5年[3]。目前,PF的临床治疗药物主要是吡非尼酮、尼达尼布,但其疗效有限,不良反应也较为明显[4]。因此,研究PF的发病机制,提供更多的治疗方案,是目前PF亟待解决的问题。研究显示,转化生长因子-β1(Transforming growth factor-β1,TGF-β1)是PF的重要启动因子,可激活下游多种Smads蛋白,其中Smad2和Smad3是两个主要的下游调节剂[5-6]。通过激活Smad通路,介导上皮-间质转化(Epithelial-mesenchymal transition,EMT),并诱导成纤维细胞增殖、肌成纤维细胞分化,且分泌大量α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Ⅰ型胶原蛋白(CollagenⅠ,Col Ⅰ)、纤维连接蛋白(Fibronectin,FN)等细胞外基质(EJCM)成分,加速PF进程[7-9]。肾素-血管紧张素系统(Renin-angiotensin system,RAS)是重要的体液调节系统,近年来研究显示RAS和肺损伤关系密切,其中血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)是RAS中的重要效应肽,在PF的发生、进展过程中伴随着Ang Ⅱ水平的升高[10-11]。
本研究团队基于多年临床研究认为肺脾两虚、气血失衡是PF的基本病机,研创出益肺汤,治以健脾益肺、调气活血,在PF患者治疗过程中获得了良好的疗效反馈。本研究拟通过体外实验,Ang Ⅱ诱导大鼠肺成纤维细胞(NIH-3T3)向肌成纤维细胞转化,观察TGF-β1/Smad2信号活化在益肺汤抑制肺纤维化中的作用,从调控TGF-β1/Smad2信号通路揭示益肺汤抗肺纤维化的机制,为该方的临床应用提供理论支持。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与细胞:NIH-3T3小鼠胚胎成纤维细胞(批号BNCC339681,北纳生物);SPF级C57小鼠[批号SCXK(湘)2016-0002,湖南斯莱克景达实验动物有限公司]40只,体重20~25 g,6~8周龄。
1.1.2 主要试剂及仪器:Ang Ⅱ(批号A9525,SIGMA);Rabbit Anti-alpha smooth Actin Polyclonal Antibody(批号bs-10196R,Bioss);辣根酶标记山羊抗兔IgG(H+L)(批号ZB-2301,中杉金桥);Rabbit Anti-Smad2 Polyclonal Antibody (批号bs-0718R,Bioss);Goat Anti-Rabbit IgG Cy3,Conjugated(批号CW0159S,CWBIO);即用型DAPI染液(批号KGA215-50,凯基);Rabbit Anti-α-SMA (批号bs-10196R,Bioss);Rabbit Anti-FN(批号ab32419,abcam);Rabbit Anti-Col Ⅰ (批号AF7001,Affinity);Rabbit Anti-Smad2 (批号ab40855,abcam);洁净工作台(型号BBS-SDC,BIOBASE);显微镜(型号CX41,OLYMPUS);蛋白垂直电泳仪(型号DYY-6C,北京六一仪器厂);超高灵敏度化学发光成像系统[型号Chemi DocTM XRS+,(上海)伯乐生命医学产品有限公司]。
1.2 实验方法
1.2.1 益肺汤水煎液制备:益肺汤由炙桑白皮、桃仁、炒枳实、桔梗各12 g,生白术10 g,丹参18 g,甘草6 g组成,中药材购于云南中医药大学第一附属医院中药房;将中药饮片进行常规煎煮、过滤、真空减压浓缩,浓缩至生药含量3 g/ml浓度,分装,-80 ℃环境下保存、备用。
1.2.2 含药血清的制备:参照相关文献制备益肺汤含药血清[12-13]。40只SPF级C57小鼠适应性饲养1周后,给予益肺汤灌胃,1次/d,连续给药3 d,给药剂量11.2 g/(kg·d)。末次给药后1 h主动脉取血,将所得血清用DMEM配成20%含药血清溶液,静置于4 ℃冰箱4 h后2500 r/min离心25 min,分离血清同组混合于56 ℃水浴灭活30 min,0.22 μm滤器过滤,分装,-20 ℃保存备用。
1.2.3 细胞实验分组:参考成文媛等[14]前期实验研究,将40只小鼠适应性饲养1周后,随机分为正常对照组、模型组、模型+正常血清组、模型+含药血清组,每组10只。正常对照组:同条件培养更换培养液但不做药物干预及Ang Ⅱ处理;模型组:使用100 ng/μl的Ang Ⅱ 稀释液处理细胞;模型+正常血清组:100 ng/μl的Ang Ⅱ诱导+正常组血清10%;模型+含药血清组:100 ng/μl的Ang Ⅱ诱导+益肺汤含药血清10%。接种细胞至50%汇合度时模型+正常血清组、模型+含药血清组按照实验方案加入血清,处理48 h后,将模型组、模型+正常血清组、模型+含药血清组换成含有0.1%FBS的培养基饥饿处理24 h,再按照实验方案,用100 ng/μl的Ang Ⅱ进行诱导。给药24 h后,给至下游检测。
1.2.4 免疫组化检测α-SMA:取4%的多聚甲醛进行样本固定15 min,PBS浸洗培养皿3次,打孔,0.5%Triton X-100(PBS配制)进行室温通透20 min。加入新鲜配制的3%双氧水,室温孵育10 min,PBS充分淋洗。培养皿内滴加5%BSA,37 ℃封闭30 min。滴加一抗α-SMA(1∶200)至培养皿内,4 ℃孵育过夜。PBS浸洗玻片后滴加聚合HRP标记抗兔IgG二抗工作液,37 ℃孵育30 min,洗涤后DAB显色,苏木精复染,封片镜检。
1.2.5 免疫荧光检测Smad2:用4%的多聚甲醛固定样本15 min,PBS浸洗培养皿,0.5%Triton X-100(PBS配制)室温通透20 min。PBS浸洗,滴加5% BSA,37 ℃封闭30 min。滴加一抗NSE(1∶200),4 ℃孵育过夜。PBS浸洗后滴加荧光二抗Cy3(1∶200),37 ℃孵育30 min,PBS浸洗,滴加DAPI避光孵育5 min,PBS冲洗,封片镜检。
1.2.6 Western blot检测α-SMA、FN、Col Ⅰ、Smad2:将各组细胞加入200 μl的RIPA细胞裂解液,充分冰上裂解30 min后,12000 r/min离心10 min,吸取上清液,提取细胞蛋白。按照BCA试剂盒检测蛋白浓度。配制SDS-PAGE胶,蛋白变性,上样,凝胶电泳1~2 h后,300 mA恒流转膜30~50 min,3%的脱脂牛奶封闭液封闭1 h。PVDF膜孵育一抗,4 ℃过夜,TBST洗膜;二抗溶液中室温孵育1~2 h,再次洗膜。加入ECL发光液,进行显影成像。Quantity One分析各条带灰度值。
1.2.7 ELISA检测TGF-β1:参照TGF-β1试剂盒说明书,空白孔调零,用450 nm波长进行各孔的吸光度(OD值)测量。根据标准物的浓度、OD值,得到标准曲线的直线回归方程式,根据此方程式,计算出样品浓度,然后乘以稀释倍数,即可获得样品实际浓度。
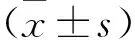
2 结 果
2.1 益肺汤对Ang Ⅱ诱导的NIH-3T3细胞α-SMA表达的影响 免疫组化检测结果见图1。棕褐色表示α-SMA蛋白。使用100 ng/μl的Ang Ⅱ对细胞造模后发现α-SMA蛋白表达略上调,使用益肺汤含药血清干预48 h后造模,α-SMA蛋白表达也会出现上调,但是上调的程度低于模型组。
图1 免疫组化检测α-SMA(苏木精染色,×200)
2.2 益肺汤对Ang Ⅱ诱导的NIH-3T3细胞Smad2蛋白表达的影响 免疫荧光检测结果见图2。红色荧光表示Smad2蛋白。使用100 ng/μl的Ang Ⅱ对细胞造模后发现Smad2蛋白表达上调,使用益肺汤含药血清干预48 h后造模,Smad2蛋白表达也会出现上调,但是上调的程度低于模型组。

图2 免疫荧光检测Smad2(DAPI染色,×200)
2.3 益肺汤对Ang Ⅱ诱导的NIH-3T3细胞α-SMA、FN、Col Ⅰ、Smad2表达的影响 Western blot检测结果见表1(图3)。与正常对照组比较,模型组α-SMA、FN、Col Ⅰ、Smad2表达显著升高(均P<0.05);与模型组比较,模型+含药血清组α-SMA、FN、Col Ⅰ、Smad2显著降低(均P<0.05)。
表1 各组α-SMA、FN、Col Ⅰ、Smad2表达比较
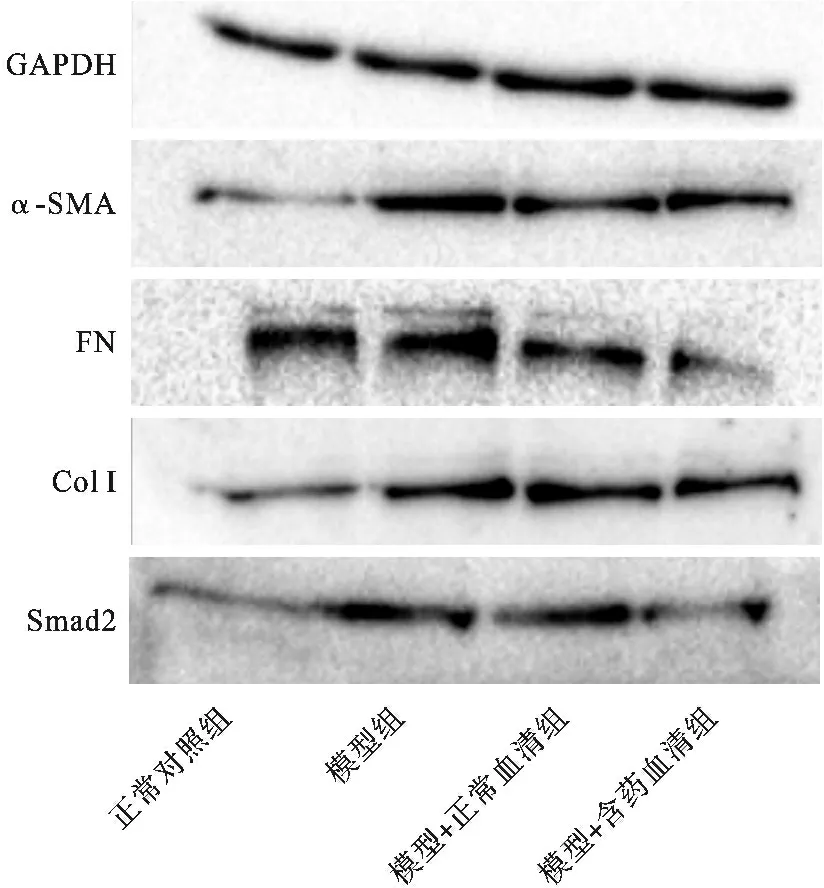
图3 Western blot检测α-SMA、FN、Col Ⅰ、Smad2蛋白水平
2.4 益肺汤对Ang Ⅱ诱导的NIH-3T3细胞TGF-β1表达的影响 ELISA检测结果见表2。与正常对照组比较,模型组TGF-β1水平显著升高(P<0.05),与模型组比较,模型+含药血清组TGF-β1水平低于模型组(P<0.05)。
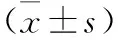
表2 各组TGF-β1表达比较
3 讨 论
PF是一种严重的、不可逆的弥漫性肺间质性疾病,是多种间质性肺病的终末期改变,预后较差,发病率、病死率较高[15-16]。PF中医病名多归于“肺痿”“肺痹”范畴,病位在肺,与脾相关。“诸气者,皆属于肺”,肺主呼吸之气,脾主运化水谷精气,此谓“肺为主气之枢,脾为生气之源”。脾为后天之本,气血生化之源,肺脾皆为多气多血之脏。肺脾经络相连,五行相生,紧密联系,共主气血生成、运行[17-18]。肺脾两虚,气血生化不足,肺叶失养,则痿弱不用;气机失调,气血失和,津留成痰,血滞成瘀,痰瘀胶结,痹阻肺络,虚实夹杂,恶性循环,导致病情缠绵难愈。“气通血活,何患不除”,气血以流畅、平衡为贵,调理气血,平衡阴阳,则疾患消除[19]。
本研究团队立足于气血,联系肺脾相关理论,从肺脾同治、气血同调出发,研创益肺汤。方中炙桑白皮甘寒入肺经,有泻肺平喘、利水消肿之功;白术、枳实出自《脾胃论》中枳术丸,借五行相生的理论,培土生金,正如《石室秘录》云:“治肺之法,正治甚难,当转以治脾,脾气有养,则土自生金”;“热在上焦,因咳为肺痿”,形成肺痿的中间环节是虚热熏灼于肺,肺失清肃而咳,加丹参、桃仁以清热活血,气血同治,以奏“疏其血气,令其条达而致和平”之效;桔梗、甘草宽胸理气,止咳化痰,且桔梗为“舟楫之药”,可引诸药入肺经。全方共奏健脾益肺、调气活血之功,具有脏腑兼顾、宣降结合、气血同调之特点,体现了中医整体观念。基于本课题前期临床研究,益肺汤可有效改善PF患者症状,延缓PF进展。
持续的炎症反应、损伤诱发机体启动抗炎、反复修复,导致成纤维细胞增殖、分化为肌成纤维细胞,α-SMA、Col Ⅰ、FN等细胞外基质在肺内堆积,破坏肺结构,促进PF发生[20]。α-SMA是肌成纤维细胞的标志性蛋白,亦是肌成纤维细胞具有收缩活性的基础,参与合成Col Ⅰ、FN等细胞外基质成分,其含量可作为判定PF程度的间接指标[21-23]。本研究显示,WB和免疫荧光显示,造模后,α-SMA、FN、Col Ⅰ的相对表达均显著升高。含药血清干预48 h后造模,α-SMA、FN、Col Ⅰ的相对量较模型组均下降。本研究结果表明,益肺汤可下调α-SMA、FN、Col Ⅰ的表达,抑制Ang Ⅱ诱导NIH-3T3增殖,降低细胞外基质水平,从而改善PF。大量研究结果显示,TGF-β通路是调控成纤维细胞增殖、活化,促进PF发展的主要信号通路,其中TGF-β1参与调控细胞增生、分化、凋亡、黏附以及运动,是促进ECM过度产生、抑制降解的关键细胞因子[24-27]。相关研究表明,肺成纤维细胞中α-SMA的表达受TGF-β的调控,TGF-β1刺激后,细胞中α-SMA的表达上调,且TGF-β1剂量水平与PF进展呈正相关[28]。本研究结果进一步显示,α-SMA、TGF-β1是导致PF的重要因素,并可能协同参与其形成。TGF-β1可促进Col Ⅰ、FN等ECM合成、过度沉积,促使成纤维细胞过度增殖,肌成纤维细胞大量产生,最终出现肺纤维化[29]。TGF-β1激活Smad信号通路,Smad蛋白家族是TGF-β1下游的细胞内效应器,其中Smad2是Smad家族中的主要活化蛋白之一,磷酸化的Smad2与Smad4结合形成复合体,进入细胞核转录促纤维化基因,导致ECM大量积聚,促使纤维化的形成[30-31]。相关研究亦表明,通过抑制TGF-β1/Smads信号通路异常激活可改善Ang Ⅱ诱导的纤维化病变[32]。本研究显示,Ang Ⅱ诱导的肺成纤维细胞TGF-β1、Smad2表达升高,益肺汤降低了TGF-β1、Smad2的表达,表明益肺汤可通过调控TGF-β1/Smad2信号通路,抑制Ang Ⅱ诱导NIH-3T3的转化,从而阻止PF进展。
综上所述,益肺汤通过调控TGF-β1/Smad2信号通路,下调Col Ⅰ、α-SMA、FN的表达,抑制Ang Ⅱ诱导的肌成纤维细胞转化而发挥其抗肺纤维化的作用。
