基于JAK2/STAT3通路研究周氏固金消瘤汤含药血清对人肺腺癌A549细胞侵袭迁移能力的影响
2024-04-10王理槐
文 静,王理槐,侯 超
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.深圳市中医院,广东 深圳 518033)
世界卫生组织国际癌症研究机构(IARC)发布的全球癌症统计数据显示,肺癌占2020年全球新发癌症病例的11.4%,位居第二,但其病死率位居首位[1-2]。非小细胞肺癌是肺癌最常见的组织学类型[3-4]。肿瘤的侵袭转移是肿瘤发展过程中最具危险性的阶段,是造成患者死亡的主因,因而抑制肺癌侵袭转移一直是治疗研究的重点。肿瘤的侵袭转移级联过程涉及克隆形成、上皮-间质转化(Epithelial-mesenchymal transition,EMT)、E-钙黏蛋白(E-cadherin)缺失、细胞外基质降解、细胞运动、血管生成等多个步骤,大量信号通路参与调节肿瘤侵袭过程,如JAK/STAT3通路的激活能通过促进EMT,进而增强肿瘤侵袭转移能力[5-6]。张雅丽等[7]研究通过抑制JAK3/STAT6信号通路,从而抑制肺癌细胞增殖、侵袭、转移和血管生成。有研究证实中药能够抑制肺癌大鼠肿瘤进展,促进肿瘤细胞凋亡,其机制可能与调节JAK/STAT通路有关[8-9]。中医认为肿瘤病机以虚为本,邪实为标,痰瘀互结,邪毒内阻,发为本病,其中气虚痰阻证多见,治宜益气化痰[10],治疗时权衡标本虚实之轻重,施以化痰、清热、补虚之法[11]。陈虹宇等[12]探讨益气除痰法治疗非小细胞肺癌的疗效,发现益气除痰方能通过多靶点、多途径逆转EMT、血管生成等,进而抑制非小细胞肺癌的侵袭转移。周氏固金消瘤汤(ZSGJXLT)作为国医大师周岱翰教授治疗肺癌的经验方,有益气除痰、化瘀解毒、软坚散结的功效。前期研究发现ZSGJXLT对人肺腺癌荷瘤裸鼠有显著抑瘤作用[13]。为证实ZSGJXLT的抗肺癌侵袭转移活性,本研究拟采用血清药理学方法,基于JAK2/STAT3信号通路对ZSGJXLT抑制肺癌侵袭转移的药效机制进行探讨。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:40只SD大鼠,SPF级,雄性,6~8周龄,体重(225±25)g,扬州大学比较医学中心提供,许可证号:SCXK(苏)2017-0007。本研究经扬州大学动物伦理审查委员会批准(YXYLL-2020-110)。
1.1.2 实验试剂:CCK-8试剂盒(批号NM598,同仁化学研究所);超敏ECL化学反应发光试剂盒(批号19091716,新赛美生物科技有限公司);BCA蛋白浓度测定试剂盒(批号23225,上海碧云天生物技术有限公司);p-STAT3(批号9145,美国CST公司);STAT3(批号12640,美国CST公司);p-JAK2(批号4406,美国CST公司);JAK2(批号3230,美国CST公司);β-actin抗体(批号4970,美国CST公司);N-cadherin(4)、E-cadherin(6)及HRP标记二抗(批号7074,美国CST公司);MMP-2(批号M01263224,万类生物科技有限公司);MMP-9(批号M01193096,万类生物科技有限公司);VEGFA抗体(批号AF5131,美国Affinity Biosciences公司);基质胶(批号356234,美国康宁公司);Transwell小室(批号3413,美国康宁公司)。
1.1.3 实验仪器:CO2细胞培养箱(型号3107,美国Forma scientific公司);高内涵成像系统(型号Operetta CLS,美国Perkin Elmer公司);多功能酶标仪(型号Synergy HTX,美国伯腾仪器有限公司);倒置荧光显微镜(型号Ti-U,日本尼康公司);凝胶成像系统(型号ChemiDoc XRS+,美国Bio-Rad公司)。
1.2 实验方法
1.2.1 周氏固金消瘤汤含药血清制备:周氏固金消瘤汤由守宫6 g,薏苡仁30 g,人参、生南星各15 g,百部、浙贝母、龙葵各20 g,干蟾皮10 g组成,由扬州市中医院中药房提供,按煎药机规程操作煎煮成汤剂,60 ℃浓缩生药浓度为3 g/ml,4 ℃冰箱保存备用。SD大鼠适应性喂养1周后,随机均分为周氏固金消瘤汤(ZSGJXLT)组和空白血清组,每组20只,ZSGJXLT组每日予ZSGJXLT 52 g/kg灌胃,空白血清组每日予等体积0.9%氯化钠溶液灌胃,2 ml/次,2次/d,连续2周,末次给药1 h后麻醉,取血,静置30 min后3000 r/min常温离心15 min,取上清,56 ℃灭活30 min,无菌微孔滤膜过滤除菌,-80 ℃冻存备用。
1.2.2 细胞培养:人肺腺癌A549细胞株,购于上海中科院细胞库,培养于1640完全培养基中,置于5%CO2,37 ℃恒温培养箱中培养,传代至第3代备用。
1.2.3 CCK-8检测A549细胞活力:将对数期细胞接种于96孔板(5×103个/孔),分为5%、10%、20%、30%及40% ZSGJXLT含药血清组,同时设立空白血清组和空白对照组,每组5个复孔,含药血清及空白血清的总体积分数均为20%,药物作用12、24、36 h后,加入CCK-8试剂10 μl,孵育1 h后用酶标仪(450 nm波长)测吸光度值(OD)。细胞活性抑制率=(空白血清孔OD-含药血清孔OD)/(空白血清孔OD-空白孔OD)×100%。
1.2.4 划痕愈合实验检测细胞的二维运动能力:将对数期细胞接种于6孔板(1×106个/ml),细胞过夜贴壁,培养到汇合度约80%,用20 μl枪头垂直于孔板表面划痕,PBS洗3次,分别用5%、10%、20% ZSGJXLT含药血清及空白血清处理细胞24 h,显微镜下观察痕道宽度并拍照,导入Image J软件中评估细胞划痕愈合率。
1.2.5 高内涵细胞成像技术观察细胞的三维运动能力:将对数期细胞接种到96 孔板(2×103个/孔),加入5%、10%、20% ZSGJXLT含药血清及空白血清,贴壁过夜,将平板放入Operetta CLS高内涵成像系统动态观察12 h。然后使用Harmony 4.1软件进行数据采集和分析。
1.2.6 Transwell小室法检测细胞的侵袭和迁移能力:在进行侵袭/迁移实验时,Transwell上室分别加入/不加入稀释基质胶,将对数期细胞接种到Transwell上室(4×104个/孔),培养于100 μl无血清培养基中,下室分别加入5%、10%、20% ZSGJXLT含药血清及空白血清液0.5 ml,培养箱孵育24 h,取出Transwell小室,弃去培养基,无菌棉签轻拭去上室残留细胞,4%多聚甲醛固定上室底面细胞,室温放置15 min,PBS洗去固定液,结晶紫染色30 min,显微镜下观察并拍照,Image J软件分析图像,计算细胞相对侵袭与迁移百分比。
1.2.7 Western blot检测细胞相关蛋白:取对数生长期的细胞接种于6孔细胞培养板,不同浓度的ZSGJXLT含药血清及空白血清处理24 h后提取蛋白,取20 μg总蛋白进行SDS聚丙烯酰胺凝胶电泳,冰浴中电压100 V转膜2 h,取出PVDF膜,7%脱脂奶粉封闭液封闭1 h,置于一抗稀释液中,4 ℃脱色摇床上孵育过夜,回收一抗,TBST洗膜3次×15 min,二抗37 ℃孵育2 h后,回收二抗,TBST洗膜3次×15 min,暗房用ECL化学发光法显影,Image J软件检测各蛋白条带A值,计算目的蛋白相对表达水平。
1.3 统计学方法 采用Graphpad Prism 9.0统计学软件进行绘图和统计学分析。计量资料符合正态分布以均数±标准差表示,组间两两比较采用Dunnett’s检验,多组间样本均数比较采用单因素方差分析,计数资料的比较使用卡方检验或Fisher确切概率法;以P<0.05为差异有统计学意义。
2 结 果
2.1 周氏固金消瘤汤含药血清可以抑制A549细胞活性 与空白血清组相比,ZSGJXLT含药血清对A549细胞的活性有显著抑制作用,与时间及浓度呈正相关性,其中5%、10%、20%、30%与40% ZSGJXLT含药血清作用A549细胞24 h后,随着药物浓度的增加,细胞活性下降。24 h的IC50为25.42%。见表1。
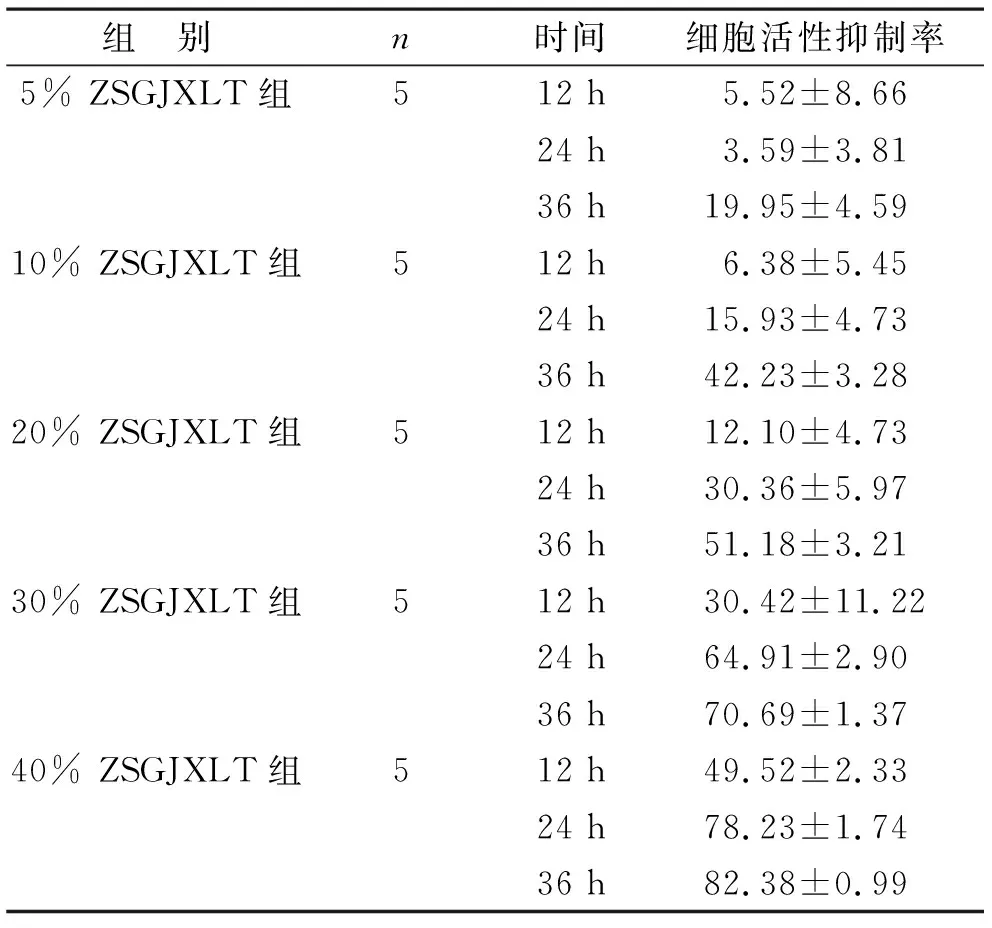
表1 周氏固金消瘤汤含药血清对A549细胞活性的影响(%)
2.2 周氏固金消瘤汤含药血清可以抑制A549细胞的划痕愈合 与空白对照组相比,5% ZSGJXLT(ZSGJXLT低剂量)、10% ZSGJXLT(ZSGJXLT中剂量)、20% ZSGJXLT(ZSGJXLT高剂量)含药血清作用A549细胞后,细胞划痕愈合率均下降,呈浓度依赖性,其中ZSGJXLT中剂量及高剂量组与空白对照组比较差异有统计学意义(均P<0.05)。见图1(表2)。

图1 周氏固金消瘤汤含药血清对A549细胞划痕愈合能力的影响(×200)

表2 干预24 h各组A549细胞划痕愈合率比较(%)
2.3 周氏固金消瘤汤含药血清可以抑制A549细胞的运动 高内涵细胞成像结果表明,与空白对照组相比,经不同浓度ZSGJXLT含药血清处理的细胞均方位移随观察时间的延长均呈下降趋势(图2),细胞移动速度也不同程度下降,其中ZSGJXLT中剂量及高剂量组与空白对照组比较差异有统计学意义(均P<0.05),见表3。细胞位移轨迹(图3)及实时动态位移图(图4)观察到随着ZSGJXLT含药血清浓度的增加,细胞运动能力逐渐下降,呈浓度依赖性。
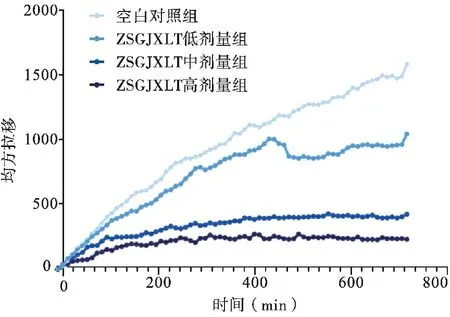
图2 周氏固金消瘤汤含药血清对A549细胞均方位移的影响
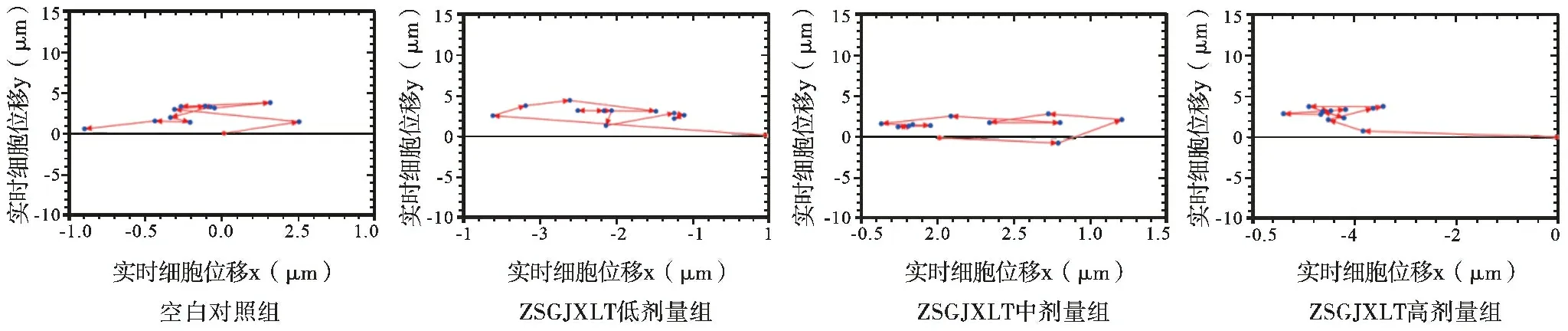
图3 各组A549细胞实时位移轨迹变化

图4 各组A549细胞实时动态位移图(×20)

表3 各组A549细胞移动速度比较(mm/s)
2.4 周氏固金消瘤汤含药血清可以抑制A549细胞的侵袭和迁移能力 与空白对照组比较,ZSGJXLT低剂量、中剂量及高剂量组A549细胞侵袭、迁移数量明显减少(均P<0.05),而与药物浓度呈正相关,见表4(图5、6)。
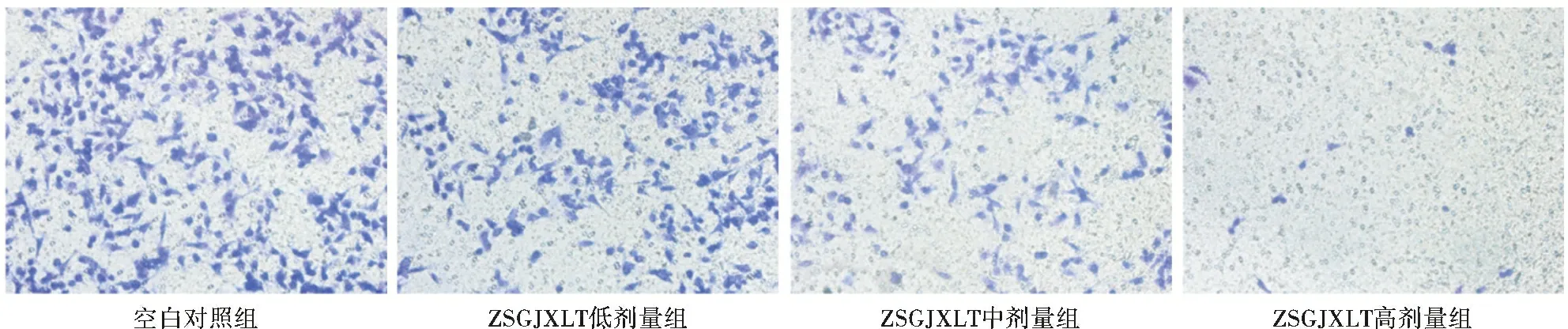
图5 周氏固金消瘤汤含药血清对A549细胞侵袭能力的影响(结晶紫染色,×200)

图6 周氏固金消瘤汤含药血清对A549细胞迁移能力的影响(结晶紫染色,×200)
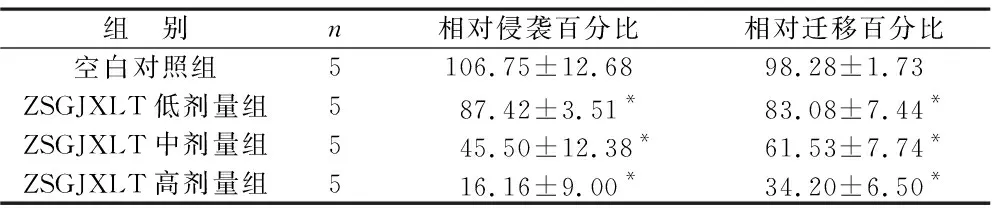
表4 干预24 h各组A549细胞相对侵袭、迁移百分比比较(%)
2.5 周氏固金消瘤汤含药血清对A549细胞中JAK2/STAT3通路相关蛋白表达的影响 经不同浓度ZSGJXLT含药血清处理A549细胞24 h后,随着含药血清浓度的增加,p-JAK2/JAK2、p-STAT3/STAT3及VEGFA/β-actin相对表达水平下降,其中ZSGJXLT中剂量及高剂量组与空白对照组比较差异有统计学意义(均P<0.05);MMP-9、MMP-2及N-cadherin表达下降,E-cadherin表达升高,其中ZSGJXLT高剂量组与空白对照组比较差异有统计学意义(均P<0.05)。见表5。
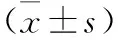
表5 各组细胞中JAK2/STAT3通路相关蛋白相对表达量比较
3 讨 论
肺癌相当于中医古籍中的“息贲”“肺积”等病症,病机特点为“痰、瘀、毒、虚”,以“虚”“痰”为关键病理因素,多因禀赋不足、外感六淫、饮食失调、情志不畅等,致使肺失宣降,气滞血瘀,津液失布,聚湿成痰,久积成块。周岱翰教授针对肺癌“脾虚痰湿”关键病机,基于“培土生金”理念提出“益气除痰”为肺癌治疗大法[14-15]。周氏固金消瘤汤作为益气除痰经典方剂,攻补兼施、寒温并用,治以益气除痰、解毒消癥,方中薏苡仁、守宫除痰散结为君,人参、百部益气健脾、润肺止咳,生南星、龙葵、干蟾皮燥湿化痰、散结解毒,共为臣药,浙贝母清热化痰,解毒散结为佐使。临床研究初步发现ZSGJXLT联合化疗对非小细胞肺癌脾虚痰湿型患者有增效减毒之功[16]。有研究通过小鼠抑瘤实验验证了ZSGJXLT的抗肺癌活性[13]。血清药理学能够真实反映中药复方及单体在体内的消化、吸收、代谢及最终产生药理效应的成分,在药效机制研究中具有可信度高等优势[17]。因而ZSGJXLT的血清药理学研究能为复方的抗肺癌活性提供更具说服力的实验证据。
恶性肿瘤的侵袭转移是导致手术、放化疗等现代医学手段失败的主要原因,因而揭示肿瘤侵袭转移机制,寻找有效阻断剂,是延长肿瘤患者生存期的关键。大量研究证实中医药能通过抑制肿瘤细胞运动、迁移和肿瘤血管生成,调控肿瘤微环境及EMT等途径逆转肿瘤侵袭转移[18]。张亚辉等[19]证实肺岩宁能下调转录因子Snail表达抑制人肺腺癌A549细胞EMT发生及侵袭转移。王鑫[20]证实爪哇黄芩素可影响肿瘤侵袭迁移相关基因,从而抑制肿瘤细胞的侵袭迁移。屈直[21]研究证实二陈汤可以通过多种途径发挥抑制血管生成、免疫调节、抑制肿瘤侵袭与转移的作用。
蛋白酪氨酸激酶(JAK)/信号转导子及转录激活因子(STAT)信号通路参与肿瘤增殖、血管生成、侵袭及转移等恶性生物学过程,涉及E-cadherin、VEGF等多种细胞因子[22],与诸多恶性肿瘤如非小细胞肺癌等的发生发展关系密切。抑癌因子可通过靶向JAK2/STAT3通路发挥抗肺癌侵袭转移活性,如SH2B3[23]能通过调控JAK2/STAT3通路,抑制肺癌增殖及EMT等阻碍肺癌细胞迁移。STAT3的异常激活可上调肿瘤血管生成关键因子VEGF的表达,如巨噬细胞分泌的IL-1β能通过激活STAT3和NF-κB,上调VEGFA进而促进血管生成[24]。N-cadherin蛋白表达升高及E-cadherin蛋白表达缺失是EMT的主要特征,可使肿瘤获得侵袭能力[25]。EMT与肿瘤血管生成作为肿瘤侵袭转移的关键环节,均涉及VEGF、MMP-9及MMP-2等共同调控因子,如MMP-9可裂解细胞外基质从而释放VEGF,VEGF刺激局部产生MMP促使毛细血管进一步延伸侵袭到细胞外基质。
本研究结果显示,周氏固金消瘤汤含药血清对JAK2、STAT3总蛋白及其磷酸化蛋白都有抑制作用,下调下游因子VEGFA、N-cadherin、MMP-9、MMP-2蛋白表达,上调E-cadherin蛋白表达,提示复方的抗肺癌侵袭转移活性可能通过靶向JAK2/STAT3信号通路来实现。同时本研究不足之处在于仅设计了不同浓度的ZSGJXLT含药血清组,而未设置阳性对照组,无法充分评价该药物的作用。尽管提到ZSGJXLT通过影响JAK2/STAT3信号通路来发挥作用,但是没有对具体是如何影响这一通路中的特定分子相互作用进行实验研究。
