电针气海、中极、关元穴改善压力性尿失禁尿道括约肌线粒体损伤机制研究
2024-04-10朱旭东盛梦钰蔡晓清李海涛邵轶群叶和松
杨 明,朱旭东,马 波,盛梦钰,蔡晓清,李海涛,邵轶群,叶和松
(1.南京中医药大学第二附属医院,江苏 南京 210017;2.沭阳县中医院,江苏 宿迁 223600;3.上海中医药大学附属岳阳中西医结合医院,上海 200437)
压力性尿失禁(Stress urinary incontinence,SUI)临床表现为腹压增加时患者出现漏尿症状,发病人群主要为中老年女性。流行病学统计发现,SUI影响着50%以上中老年女性的日常生活[1-2]。该疾病严重影响患者的生活质量,给患者心理和生理造成沉重负担[3-5]。SUI发病机制较为复杂,目前认为SUI的发生主要与尿道括约肌解剖结构异常和功能障碍以及尿道周围的支撑和附属结构缺陷有关[6-7]。研究提示,SUI患者盆腔支撑组织中存在线粒体DNA(mtDNA)缺失和重排的累积,且随着SUI病程的加重而明显累积[8-9]。同时,线粒体质控(MQC)高效运行的前提需确保线粒体结构和功能的完整,MQC通过协调线粒体动力学的稳定性以保障肌肉细胞的常规活动,因而MQC过程中断是年龄或其他病因所致尿道括约肌功能障碍的潜在机制[10-11]。mtDNA突变和氧化损伤的累积,促进机体的老化,引起尿道支持结构解剖及功能的异常,最终导致SUI的发生[12]。大量研究报道,针刺干预对SUI有较好的临床疗效,同时相关机制研究亦是如火如荼开展中[13-15],但鲜有关于电针调节盆底组织线粒体动力学从而治疗SUI的作用机制研究。
课题组根据江苏省名中医顾兆军主任创立的小腹三针(气海、中极、关元穴)前期开展了大量的临床和相关机制研究。临床研究发现,小腹三针治疗可以协调SUI患者膀胱逼尿肌和尿道括约肌功能,提高尿道闭合压[16-17]。根据代谢组学研究[18],推测电针气海、中极、关元穴治疗SUI的作用机制可能在于对线粒体功能的调控。为了进一步明确电针气海、中极、关元穴对SUI尿道括约肌线粒体功能的影响,拟通过体内实验研究论证,探讨电针改善SUI尿道括约肌病变的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:SD大鼠,雌性,SPF级,重180~220 g,鼠龄6~8周,购于浙江维通利华实验动物技术有限公司,生产许可证:SCXK(浙)2019-0002,动物饲养及操作按照南京市第一医院实验动物管理规定执行,动物使用许可证号:SYXK(苏)2021-0007,饲养条件为自然光照,温度25 ℃,相对湿度70%,上述操作通过该实验动物伦理委员会批准后实施,伦理号:QWSY-22144271。
1.1.2 实验试剂:超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA试剂盒(英国Abcam公司,货号:ab65354、ab118970);琥珀酸脱氢酶(SDH)ELISA试剂盒(百奥莱博公司,货号:SNM178);2.5%戊二醛(青岛捷世康生物科技有限公司,货号:RY0404);线粒体分离、膜电位、ATP含量相关试剂盒(英国Abcam公司,货号:ab110171、ab112150和ab83355);RIPA裂解液和BCA蛋白浓度测定试剂盒(英国Abcam公司,货号:ab288006、ab102536);一抗:线粒体融合素1(Mfn1)、Mfn2、线粒体动力相关蛋白1(Drp1)、线粒体分裂因子(MFF)、沉默信息调节因子1(SIRT1)、过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)和β-actin(英国Abcam公司,货号:ab221661、ab205236、ab184247、ab129075、ab110304、ab106814和ab8226);二抗:辣根过氧化物酶标记山羊抗兔IgG(英国Abcam公司,货号:ab172730)。
1.1.3 实验仪器:针灸针(型号:0.25 mm×13 mm);电子针疗仪(型号:SND-Ⅲ);尿动力学检测仪(型号:UDS94,加拿大Laborie公司);微量恒流泵(型号:DP-S100,北京欧世盛科技有限公司);流式分析仪(型号:Cytoflex,美国Thermo Scientific);全波长酶标仪(型号:Multiskan Sky High,美国Thermo Fisher Scientific);垂直电泳转印系统(型号:1658033,美国BIO-RAD);全自动化学发光凝胶成像系统(型号:iBright CL1500,美国Thermo Fisher Scientific);透射电子显微镜(型号:H-7650,日本日立)。
1.2 实验方法
1.2.1 大鼠造模与分组:50只SD大鼠随机分为空白组、模型组、假手术组、电针组、假针组,每组10只。模型组、电针组、假针组参照LIN等[19]造模标准进行大鼠阴道扩张合并双侧卵巢切除造模,具体造模步骤:经10%水合氯醛0.35 ml/100 g腹腔注射麻醉成功后的大鼠,取仰卧位并进行固定,向弗莱氏尿管球囊内注入4 ml灭菌用水扩张阴道,导管深度为2~3 cm,行阴道缝合防止导尿管脱落,100 g重物进行垂吊牵拉,持续4 h;第7天对该组大鼠进行双侧卵巢切除;观察7 d后开展喷嚏试验,鉴别模型效果。假手术组:麻醉后打开腹腔,游离组织并找到卵巢,但不予摘除,然后缝合腹腔,与模型组给予相同的条件饲养。
1.2.2 干预方法:电针组选取气海、中极、关元穴进行电针治疗,根据《实验针灸学》[20]定位。大鼠置于治疗固定架上,针灸针(0.25 mm×13 mm)斜刺进针3 mm,接电针仪,疏密波,电流强度1~3 mA,频率2~10 Hz,30 min/次,1次/d,连续治疗14 d,治疗期间根据大鼠状态进行电流强度和电压峰值调整。假针组:针刺气海、中极、关元穴对照点(气海、中极、关元穴旁开1 cm),电针条件同电针组。空白组、假手术组及模型组给予同等条件置于治疗固定架,不进行任何处理。各组均使用0.9%NaCl溶液进行膀胱灌肠测定充盈性膀胱压力。治疗结束后取大鼠尿道括约肌组织。
1.2.3 尿流动力学检测:麻醉成功后的大鼠进行操作区域无菌消毒,排空大鼠膀胱,0.7 mm输液导管润滑后插入膀胱,三通连接微量灌注泵(流量:0.3 ml/min)泵入灭菌用水和尿动力学检测仪开机检测。记录漏尿点压力(Leak point pressure,LPP)、最大膀胱容量(Maximal bladder capacity,MBC)和腹腔漏尿点压力(Abdominal leak point pressure,ALPP),重复2次操作,取平均值。
1.2.4 HE染色观察尿道括约肌形态:干预结束后处死大鼠,获取尿道括约肌组织,部分组织进行甲醛固定,制片。根据HE染色步骤按试剂盒逐步操作,显微镜下观察尿道括约肌病理形态的改变。
1.2.5 尿道括约肌线粒体功能检测:干预结束后,大鼠麻醉后主动脉放血处死,获取尿道括约肌组织,制备组织匀浆,利用线粒体分离试剂盒提取纯化尿道括约肌线粒体,并根据试剂盒说明书步骤检测线粒体膜电位(ΔΨm)和ATP水平。
1.2.6 尿道括约肌氧化应激指标检测:取冻存尿道括约肌组织制备组织匀浆,取上清液经ELISA试剂盒检测SOD、MDA及SDH含量,观察尿道括约肌的氧化应激状态。
1.2.7 尿道括约肌线粒体形态观察:尿道括约肌组织经历戊二醛固定、磷酸漂洗、锇酸固定、脱水、包埋、固化、制片和染色等相关过程,电镜观察线粒体形态改变。
1.2.8 Western blot检测线粒体动力学相关蛋白:取尿道括约肌组织制备组织匀浆,RIPA混合裂解液裂解、分离,收集上清液。BCA试剂盒测定总蛋白浓度,主要步骤如下:20 μg蛋白孔上样,凝胶电泳进行蛋白分离2 h,分离后的蛋白转移至PVDF膜,脱脂牛奶封闭、TBST漂洗,一抗4 ℃孵育过夜,二抗室温孵育1 h。显影,采集图片并使用Image J对条带进行灰度分析。
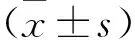
2 结 果
2.1 各组大鼠尿动力学指标比较 空白组和假手术组大鼠ALPP、LPP、MBC比较差异无统计学意义(均P>0.05)。与假手术组比较,模型组、假针组和电针组大鼠上述三项指标显著降低(均P<0.05)。模型组与假针组大鼠上述三项指标比较差异无统计学意义(均P>0.05)。与模型组比较,电针组大鼠上述三项指标水平显著升高(均P<0.05)。见表1。
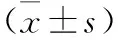
表1 各组大鼠尿动力学指标比较
2.2 各组大鼠尿道括约肌组织形态变化 HE染色结果见图1。假手术组大鼠尿道括约肌肌纤维排列有序、完整,周围组织排列连续、致密;模型组肌纤维数量减少、变薄、排列无序,周围组织显著增多且疏松;假针组与模型组肌纤维及周围组织形态无差异;电针组肌纤维增多、变厚、排列较有序,周围组织减少,排列较致密,基本恢复正常。
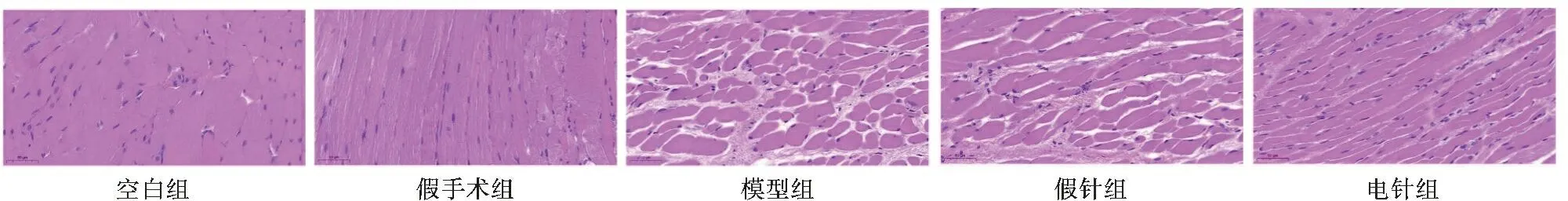
图1 各组大鼠尿道括约肌组织病理学改变(HE染色,×200)
2.3 各组大鼠尿道括约肌ATP含量及线粒体膜电位比较 空白组与假手术组大鼠尿道括约肌ATP含量和线粒体膜电位比较差异无统计学意义(均P>0.05)。与假手术组比较,模型组、电针组、假针组大鼠上述两项指标显著降低(均P<0.05)。模型组与假针组大鼠上述两项指标比较差异无统计学意义(均P>0.05)。与模型组比较,电针组大鼠ATP含量及线粒体膜电位显著升高(均P<0.05)。见表2。
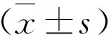
表2 各组大鼠尿道括约肌ATP含量及线粒体膜电位比较
2.4 各组大鼠尿道括约肌氧化应激指标比较 空白组与假手术组大鼠尿道括约肌SDH和SOD活性及MDA水平比较差异无统计学意义(均P>0.05)。与假手术组比较,模型组、电针组、假针组大鼠SDH和SOD活性显著降低(均P<0.05),MDA水平显著升高(均P<0.05)。模型组与假针组大鼠上述三项指标比较差异无统计学意义(均P>0.05)。与模型组比较,电针组大鼠SDH和SOD活性显著升高(均P<0.05),MDA水平显著降低(P<0.05)。见表3。
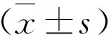
表3 各组大鼠尿道括约肌SDH、SOD和MDA含量比较
2.5 各组大鼠尿道括约肌线粒体超微结构改变 电镜下各组大鼠尿道括约肌线粒体结构显示,手术解剖操作并未对尿道括约肌线粒体形态有任何影响,SUI可显著导致尿道括约肌线粒体形态肿胀紊乱和部分空泡化。电针气海、中极、关元穴可显著改善SUI尿道括约肌线粒体形态肿胀紊乱和部分空泡化情况。见图2。
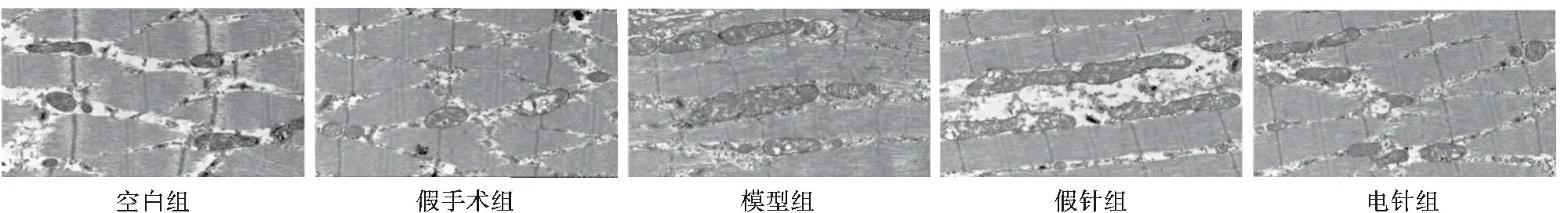
图2 各组大鼠尿道括约肌线粒体形态(×100)
2.6 各组大鼠尿道括约肌线粒体生物发生信号分子表达比较 空白组与假手术组大鼠尿道括约肌Mfn1、Mfn2、Drp1、MFF、SIRT1和PGC-1α蛋白表达比较差异无统计学意义(均P>0.05)。与假手术组比较,模型组、假针组和电针组大鼠Mfn1、Mfn2、SIRT1和PGC-1α蛋白表达显著降低(均P<0.05),Drp1和MFF蛋白显著升高(均P<0.05)。模型组与假针组大鼠上述蛋白表达水平比较差异无统计学意义(均P>0.05)。与模型组比较,电针组大鼠尿道括约肌Mfn1、Mfn2、SIRT1和PGC-1α蛋白表达水平显著升高(均P<0.01),Drp1和MFF蛋白显著降低(均P<0.01)。见表4(图3)。

A:空白组;B:假手术组;C:模型组;D:假针组;E:电针组图3 电针对SUI环境下尿道括约肌PGC-1α、SIRT1、Mfn1、Mfn2、Drp1和MFF蛋白表达的影响
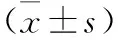
表4 各组大鼠尿道括约肌PGC-1α、SIRT1、Mfn1、Mfn2、Drp1和MFF蛋白表达比较
3 讨 论
在古籍中,并没有关于SUI的确切名称,但从腹压增大时出现尿液漏出的症状来看,SUI可归类为“小便不禁”“遗溺”“膀胱咳”等[21]。SUI多发生在中老年女性人群,故该病机多为脾肾不足,肺气虚弱,膀胱气化失司,其病位主要在肾、膀胱,与脾肺相关。顾兆军教授根据多年的临床经验,基于“固本培元、温肾止遗”理论创立小腹三针(气海、中极和关元穴)[22]。中极穴下方散布着髂腹下神经分支,髂腹下神经对膀胱和直肠有着重要的支配作用,因此,针刺该穴位能够改善膀胱功能,缓解小便功能障碍[23]。
前期研究结果提示,针灸治疗参与调控SUI患者线粒体代谢平衡。线粒体是细胞的动力工厂,是一种双膜细胞器,为细胞的各项活动提供ATP,线粒体功能的平衡对于肌肉功能的维持尤为重要[24]。首先,肌肉维持节律性收缩需要线粒体持续地提供足够的ATP为其发挥生理功能;此外,肌肉细胞根据外界细胞因子或信号刺激迅速调节代谢功能状态,这需要线粒体保持稳定的功能[25]。尿道括约肌属于人体骨骼肌的一部分,其线粒体功能对肌肉功能的维持具有显著的影响。但研究表明,骨骼肌损伤后,线粒体自噬通量减少,这会导致蛋白损伤和细胞器的累积,诱发过度炎症[26]。由此可以推断,尿道括约肌线粒体功能障碍或许与SUI病变的发生发展关系密切。
线粒体功能障碍的主要表现之一为线粒体膜电位的破坏,其膜电位的消散一般早于其他凋亡表现,标志着细胞凋亡事件的早期启动,一旦细胞开始进入凋亡状态,就会导致大量的能量损伤,从而促发线粒体膜电位显著降低[27]。中医药调控线粒体功能障碍的研究亦取得显著临床疗效和机制研究成果[28]。本次研究结果显示,模型组中氧化应激相关指标较空白组显著改善,结果提示,氧化应激启动细胞凋亡促进SUI疾病的发生。与模型组比较,电针组线粒体膜电位、SDH、SOD活性及MDA水平显著升高,提示电针能改善SUI环境下尿道括约肌细胞的线粒体功能障碍,调节氧化应激,抑制细胞凋亡。以上研究结果提示,SUI环境下尿道括约肌细胞的线粒体功能障碍,促进氧化应激及细胞凋亡启动,而电针可部分逆转上述效应。
线粒体动力学主要的调控因子包括Mfn1、Mfn2、Drp1、MFF、SIRT1和PGC-1α等,上述调控因子共同调控线粒体的分裂和融合,进而调控线粒体功能和形态的改变[29]。本研究通过电镜观察尿道括约肌线粒体微观结构改变,手术解剖并未对线粒体形态有明显影响,而SUI模型中线粒体形态肿胀严重,线粒体内间隙显著增宽、嵴走向明显不规则,PGC-1α和Mfn1、Mfn2和SIRT1蛋白表达显著降低,而Drp1和MFF蛋白表达显著升高;电针组线粒体肿胀程度显著改善,线粒体内间隙增宽、嵴走向不规则情况显著降低,模型组上述6种蛋白的表达得到部分逆转;上述研究结果提示,电针可改善SUI环境下尿道括约肌细胞的线粒体形态的病理学改变与功能损伤。
综上所述,SUI可导致尿道括约肌细胞的线粒体形态的病理学改变与功能损伤。电针可通过改善SUI尿道括约肌线粒体功能和形态的相关表达因子和蛋白,从而改善线粒体的形态与功能障碍,进而改善SUI尿道括约肌病变。
