祛风止痉胶囊对支气管哮喘大鼠气道炎症及TRPV1通路的影响
2024-04-10武玉刚朱玉龙马红霞
武玉刚,朱玉龙,马红霞
(新疆医科大学附属中医医院,新疆 乌鲁木齐 830000)
哮喘是呼吸系统疾病中常见的慢性气道炎症性疾病之一,近年来哮喘的发病率逐年增长[1]。支气管哮喘最主要的临床表现是气道高反应,目前对于哮喘的治疗分为急性发作期与缓解期,急性发作期以糖皮质激素及短效β2受体激动剂为主,虽然症状改善明显,但伴随而来的真菌感染及代谢紊乱等不良反应不容忽视。支气管哮喘在中医称为“哮病”。哮病的基本病机为“伏痰”,外邪侵袭是其主要病因,外邪犯肺而致痰随气升,气因痰阻,相互搏结,壅塞气道,从而痰鸣如吼,气息喘促,“风邪”是其主要诱发因素[2]。因此,在哮病的治疗上,朱丹溪等古代医家也早已提出了祛风止痉法。祛风止痉方是李风森教授基于多年治疗哮喘的临床经验总结而成。本研究通过观察支气管哮喘大鼠予祛风止痉胶囊灌胃后瞬时受体电位香草酸亚型1(TRPV1)蛋白分子表达变化以及外周血白介素(IL)-4、IL-13、IL-5、IL-17水平的变化,进一步揭示祛风止痉胶囊对哮喘大鼠TRPV1蛋白分子表达的影响,研究支气管哮喘炎症因子与TRPV1蛋白的相互关系,为进一步研究祛风止痉胶囊治疗哮喘的分子机制奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康雄性Wister大鼠60只,体重180~220 g,8~10周龄,均由浙江维通利华实验技术有限公司提供。适应性饲养1周后,建造大鼠哮喘模型,将50只哮喘大鼠按照随机数字表法分为模型组、阳性对照组和祛风止痉胶囊低剂量组、中剂量组、高剂量组。
1.1.2 实验药物与试剂:祛风止痉胶囊(白僵蚕、蝉衣、地龙)由新疆维吾尔自治区中医院药研室提供,将药物加蒸馏水混合均匀并配制成所需浓度,呈混悬液状备用。卵蛋白(批号20180709,美国sigma公司);TRPV1抗体试剂盒(批号04913850001,Affinity公司);IL-17A ELISA试剂盒(批号15596-026,NeoBioscience公司);IL-5 ELISA试剂盒(批号AB5370,Abcam公司);IL-4 ELISA试剂盒(批号CK-E20011M,Raybiotech公司);HRP结合二抗(批号D60029,中杉金桥公司);琼脂糖(批号A610013-0250,上海生工)。
1.1.3 实验仪器:冷冻离心机(型号Heraeus Multifuge X1R,赛默飞世尔科技公司);漩涡混合器(型号GL-88B,海门市其林贝尔仪器制造有限公司);超微量分光光度仪(型号Tnano701,上海净信);电泳仪电源(型号BG-Power600,济南欧莱宝生物技术有限公司);垂直电泳槽(PROTEAN Tetra,济南欧莱博科学仪器有限公司);凝胶成像仪(HD-HN1100,山东环美分析仪器有限公司);PCR仪(型号MyCycler Thermal Cycler,美国Bio-Rad);Real Time instrument(型号ABI 7500Fast);电热恒温培养箱(型号KD-8D,上海精宏)。
1.2 实验方法
1.2.1 哮喘模型的建立:采用腹腔注射OVA致敏、连续6次呼吸道雾化吸入OVA诱导气道变应性炎症[3]。实验第1天,临时配制10%OVA溶液,大鼠腹腔注射1 ml以致敏,第15天将致敏的大鼠于透明玻璃罩内,给予1%OVA溶液进行超声雾化(雾化量由小到大)15 s,然后自然吸入15 s,出现呼吸频率加快、点头呼吸、咳嗽、抽搐等症状时为引喘成功。此后,每隔1 d以1%OVA溶液诱导,按最大雾量,自然吸入15~30 s,使哮喘反复发作,连续8 d(共4次)。
1.2.2 给药:高剂量组(1.6 g/ml)、中剂量组(0.5 g/ml)、低剂量组(0.2 g/ml)分别给予中药混悬液4 ml/次,连续灌药10 d,每日1次[4]。正常组不给予任何药物干预,正常饲养。阳性对照组予布地奈德混悬液1 mg/kg,连续雾化10 d,每日1次。模型组:给予0.9%氯化钠溶液10 ml超声雾化,连续雾化10 d,每日1次。干预第10天,各组大鼠处死取材。
1.2.3 标本采集:①大鼠处死并取腹主动脉血,将血置于EDTA抗凝管中,其中取2 ml无抗凝血置于4 ℃低温水平离心机中,离心后取上清液并置于-80 ℃冰箱中保存备用。②将取完血的大鼠夹闭右肺,经气管插管给予10 ml的0.9%氯化钠溶液行左肺肺泡灌洗,0.9%氯化钠溶液经气道缓慢注入左肺直至肺慢慢变至苍白、膨胀,出现阻力后慢慢回收液体,反复3次后将回收的肺泡灌洗液离心并取上清液标记分装于-80 ℃冰箱中保存备用。③取右肺中叶肺组织置于10%福尔马林中固定72 h,脱水,石蜡包埋,切片,乙醇梯度洗脱,苏木素染色10 min,伊红染色液染色30 s,梯度酒精脱水,光学显微镜下观察肺组织黏膜病理学改变。
1.2.4 ELISA检测大鼠外周血中炎症因子水平:取大鼠外周血,离心后分离血清,ELISA法检测各组大鼠血清中IL-5、IL-4、IL-13及IL-17的含量。按试剂盒说明书进行操作。
1.2.5 Western blot检测肺组织TRPV1蛋白:将肺组织研碎后加入蛋白裂解液(IP/RIPA),离心取上清,BCA法蛋白定量计算各蛋白浓度,加入4×蛋白上样缓冲液100 ℃使蛋白变性。根据蛋白分子量配制10%分离胶5 ml、5%浓缩胶3 ml,配制电泳液,将蛋白转印至PVDF膜上,将PVDF膜依次放置在保鲜膜上铺展开,将配制好的发光剂快速均匀的加在4 ℃恒流转膜2 h,配制5%脱脂牛奶封闭2 h,加入一抗TRPV1(1∶500)与GAPDH(1∶500),置于旋转摇床上4 ℃过夜。TBST漂洗4次,室温二抗孵育2 h后,TBST漂洗4次,目的条带加入ECL化学显影液,在化学发光凝胶成像仪检测蛋白的表达。将获得的图像在Image J分析软件计算灰度值。
1.2.6 Real-time PCR检测各组肺组织TRPV1 mRNA:从样本中提取总RNA,电泳检测其完整性。使用逆转录酶和随机引物反向合成cDNA。TRPV1 mRNA转录水平采用实时荧光定量PCR检测。PCR反应:变性95 ℃ 40 s,退火54 ℃ 42 s,延伸68 ℃ 50 s,26个循环反应结束后分析样品信号荧光强度测定的数据,以2-ΔΔCt法计算TRPV1 mRNA表达水平。使用GAPDH作为内参,TRPV1-F:5’-AGATCACCAACAGGAAGGGG-3’,TRPV1-R:5’-TAAAGGGAGGAGTGCACTGG-3’,产物大小为125 bp。
1.2.7 观察大鼠肺组织HE染色病理变化:取材后,标本在预冷的PBS中冲洗干净,由4%多聚甲醛固定24 h以上,梯度酒精脱水,对组织行石蜡包埋、切片厚5 μm,常规脱蜡入水并修复,滴加TRPV1一抗(1∶200),4 ℃冰箱过夜,PBS溶液清洗3次,每次5 min,在组织切片上滴加适量的生物素标记山羊抗鼠/兔IgG,37 ℃孵育20 min,PBS溶液清洗3次,每次5 min,在组织切片上滴加适量的辣根酶标记链酶卵白素工作液,37 ℃孵育20 min,PBS溶液清洗3 次,每次5 min,在组织切片上加入适量新鲜配制的DAB显色,观察到棕色结果停止显色,脱水、透明、封片,显微镜下观察并计数阳性细胞及强度。
1.3 统计学方法 使用SPSS 27.0统计学软件进行数据分析。验证各组测量资料是否满足正常分布和分散,并使用单因子分散分析比较各组测量资料;P<0.05为差异有统计学意义。满足正态分布的双变资料相关性分析采用Pearson相关分析法。各组大鼠IL-4、IL-13、IL-5、IL-17、TRPV1蛋白及mRNA表达的实验数据使用单因素方差进行分析;P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清IL-4、IL-5、IL-13、IL-17水平比较 见表1。模型组IL-4、IL-5、IL-13、IL-17水平高于正常组,差异有统计学意义(均P<0.05);低剂量组、中剂量组、高剂量组、阳性对照组的各指标水平低于模型组,差异有统计学意义(均P<0.05);高剂量组的各项指标水平低于阳性对照组,差异有统计学意义(均P<0.05)。
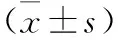
表1 各组大鼠血清IL-4、IL-5、IL-13、IL-17水平比较
2.2 各组大鼠肺组织TRPV1蛋白表达比较 见表2(图1)。阳性对照组TRPV1蛋白表达高于正常组(P<0.05);模型组TRPV1蛋白表达高于中剂量组、低剂量组、阳性对照组、高剂量组(均P<0.05);高剂量组TRPV1蛋白表达低于阳性对照组,差异有统计学意义(P<0.05)。
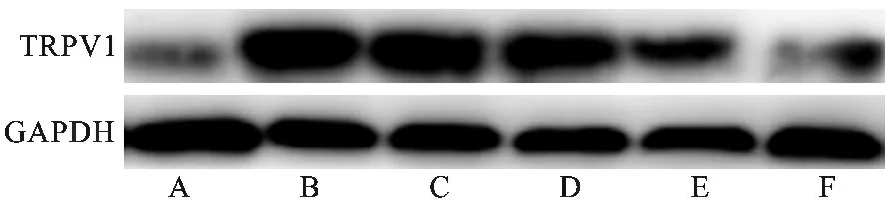
A:正常组;B:模型组;C:阳性对照组;D:低剂量组;E:中剂量组;F:高剂量组图1 各组大鼠肺组织TRPV1蛋白表达电泳图
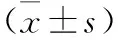
表2 各组大鼠肺组织TRPV1蛋白表达比较
2.3 各组大鼠肺组织TRPV1 mRNA表达比较 见表3。正常组肺组织TRPV1 mRNA表达低于模型组(P<0.05),阳性对照组、低剂量组、中剂量组、高剂量组的TRPV1 mRNA表达低于模型组,差异有统计意义(均P<0.05)。
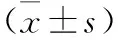
表3 各组大鼠肺组织TRPV1 mRNA表达比较
2.4 各组大鼠肺组织病理学改变 见图2。与正常组比较,模型组大鼠气道和肺组织中有大量炎症细胞浸润,气管黏膜充血水肿,杯状细胞增殖,支气管分泌物增多;与模型组比较,各给药组大鼠组织炎症细胞浸润程度减轻,其中高剂量组减轻最为明显。20倍光镜下观察免疫组化结果,通过棕色深浅将染色强度分为0~3级,通过阳性细胞与细胞核的比值估算阳性率(0~100),最终结果为染色强度×阳性率,数值范围是0~300。
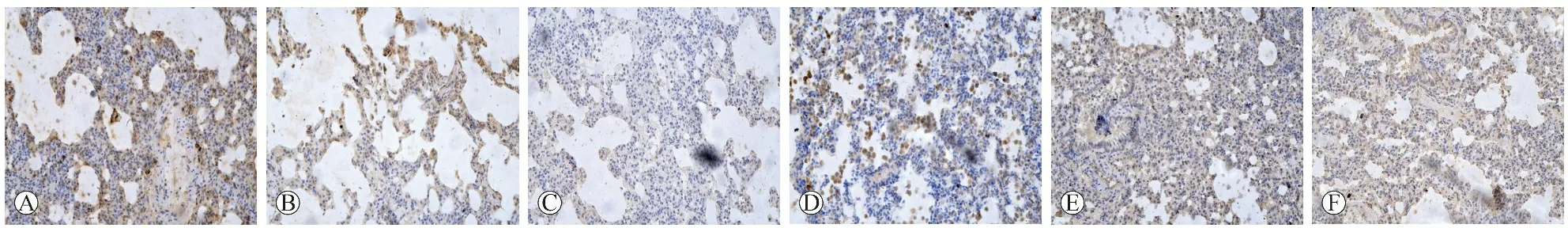
A:正常组;B:模型组;C:阳性对照组;D:低剂量组;E:中剂量组;F:高剂量组图2 各组大鼠肺组织病理学改变(HE染色,×200)
3 讨 论
支气管中的嗜酸性粒细胞、非对称细胞及T淋巴细胞等多种炎症细胞共同组成的呼吸道慢性炎症为支气管哮喘,其以反复发作的喘息、呼吸急促、胸闷或咳嗽为主要临床症状[5]。支气管哮喘的发病机制目前仍未能明确,与免疫、遗传、神经受体明显相关[6]。哮喘是因机体Th1/Th2失衡引起的,病理特征主要包括气道炎症等,其中慢性呼吸道炎症是哮喘形成的核心因素,也是呼吸道高反应性的重要原因[7]。目前哮喘药物治疗的主要手段是抑制呼吸道慢性炎症因子的释放。炎症因子如IL-4、IL-13、IL-5,可在Th2细胞受到外部刺激时释放出来,其中IL-5是调节嗜酸性粒细胞增殖、分化、积聚的关键性因子。哮喘患者中IL-5在肺组织大量释放,诱导嗜酸性粒细胞浸润或集中于肺组织,从而引起呼吸道炎症和肺组织病理变化[8]。IL-4可促进Th2分化,活化B细胞,生成免疫球蛋白E(IgE),肥大细胞脱颗粒,释放组胺、肝素、白三烯等多种炎症因子,使得支气管收缩[9]。IL-4的大量分泌还可抑制Th1细胞分泌IFN-γ,IFN-γ可以抑制IgE合成,并且调节免疫反应[10]。IL-4在诱导浆细胞产生IgE以及上调肥大细胞、嗜碱性粒细胞、单核细胞、巨噬细胞和B细胞中FcRⅠ和MHc Ⅱ类分子的表达方面发挥关键作用。IL-4被认为是Th2主开关,可在敏性疾病中驱动Th2细胞产生其他促过敏细胞因子,如IL-5和IL-13。IL-4促进髓系树突状细胞的发育,并参与Th2细胞和嗜酸性粒细胞向炎症部位的迁移,IL-4和IL-13均激活B细胞合成IgE,诱导杯状细胞增生,触发气道高反应性和黏液高分泌。哮喘的发生发展除了Th2细胞及其细胞因子起主要作用外,Th17细胞及其细胞因子包括IL-17也发挥关键作用[11]。Treg/Th17的免疫失衡也是哮喘发病的重要机制之一。IL-17不仅能募集中性粒细胞,还作用于嗜酸性粒细胞增强气道炎性反应[12]。对于激素抵抗哮喘的中性粒细胞气道炎症,来源于Th17细胞的IL-17和来源于巨噬细胞的IL-18和肿瘤坏死因子-α参与了哮喘的发病[13]。与健康对照组相比,在哮喘患者的痰液、鼻腔和支气管活检以及血清中观察到IL-17水平升高,IL-17水平较高的患者有更严重的哮喘表型。研究表明,靶向IL-17通路可能对哮喘有益,由于Th17/IL-17轴的激活增加与吸入糖皮质激素敏感性降低相关,靶向IL-17途径可能逆转吸入性糖皮质激素的无反应性[14]。
TRPV1是一种非选择性的阳离子通道,对钙离子有高渗透性,并为钙离子从细胞器中释放出来提供通道,从而改变细胞内钙离子的浓度,调节机体的重要生理过程。TRPV1通道由热、疼痛、辣椒素等外部刺激物质激活,可诱发钙类及螺旋体缩氨酸、钙素基因相关缩氨酸的释放,感觉神经缩氨酸作用于呼吸道的部分效应细胞(如平滑肌、胆碱神经节、黏液腺等),诱发细胞周围轴突反射、支气管收缩、蛋白质渗出、炎症细胞取向等[15-16]。在OVA诱导的哮喘小鼠模型中,TRPV1在肺组织中的表达显著升高,其肺泡灌洗液中Th2细胞相关细胞因子IL-3、IL-5和IL-13显著升高,而使用TRPV1抑制剂治疗的哮喘小鼠IL-3、IL-5和IL-13显著降低[17-18]。研究发现,气道的抗炎作用可能与TRPV1对气道上皮细胞因子和Th2相关细胞因子的下调有关[19]。
支气管炎哮喘常在清晨或夜间急性发作,随着病程的延长,可能发生呼吸道变窄[20]。常规西药治疗虽然能缓解急性发作症状,但随着病程延长可产生耐药性,病情反复,中医治疗标本兼顾,辨证论治,可增强患者的免疫力,减轻急性发作时的症状,并可减少急性发作次数。中医治疗哮喘遵“急则治其标”“缓则治其本”的原则,前中期以强肾益肺、平喘止咳为主[21]。“祛风止痉”是历代医家治疗哮喘的重要方法,从“风”论治,以“疏风宣肺、解痉平喘”治疗风痰哮症,疗效显著。祛风止痉胶囊中蝉蜕、僵蚕、地龙共用可祛风止痉,恢复肺的宣发肃降功能,从而改善哮喘的临床症状及预后[22]。中药蝉蜕性寒凉,《中华临床中药学》中称其可以“止咳降气,主治咳嗽气喘”[23];白僵蚕可息风止痉,散结消痰,医风邪入体等症[24];地龙水煎液可抑制呼吸道过敏,抗组胺,改善哮喘患者呼吸道重构现象[25]。
在本次实验中,模型组哮喘大鼠的血清IL-4、IL-13、IL-5、IL-17均高于正常组,阳性对照组及低、中、高剂量组血清IL-4、IL-13、IL-5、IL-17均低于模型组,进一步验证了祛风止痉胶囊可降低哮喘大鼠血清细胞因子IL-4、IL-13、IL-5、IL-17的分泌水平。实验发现模型组哮喘大鼠TRPV1蛋白及mRNA表达高于正常组;阳性对照组及低、中、高剂量组TRPV1蛋白及mRNA表达低于模型组,高剂量组的IL-4、IL-13、IL-5、IL-17水平及TRPV1蛋白表达低于阳性对照组,进一步证明了祛风止痉胶囊可降低哮喘大鼠的TRPV1表达。
综上所述,祛风止痉胶囊可能通过对哮喘患者Th2炎症因子的下调,下调IL-4、IL-5、IL-13、IL-17水平,降低TRPV1表达,从而减轻哮喘的气道高反应性。
