金果胃康胶囊对胃癌前病变模型大鼠胃黏膜ULK1/AMPK/mTOR信号通路的影响
2024-04-10沈家林许雨晴曹若彤郗春华赵唯含
沈家林,许雨晴,曹若彤,郗春华,赵唯含
(1.陕西中医药大学,陕西 咸阳 712046;2.陕西中医药大学附属医院,陕西 咸阳 712000)
胃癌前病变(Precancerous lesions of gastric cancer,PLGC)是指较易转变为癌组织的病理学变化,对其施以有效干预是预防胃癌发生的关键环节,目前的研究认为幽门螺旋杆菌(HP)感染是PLGC的重要风险因素[1-3],但根除HP往往并不能逆转胃黏膜损伤[4]。有研究证实叶酸作为一种维生素,其有利于蛋白质的合成,控制DNA合成,保持DNA的稳定性和完整性,并修复异常的DNA甲基化和畸变,补充叶酸可能防止PLGC的进一步恶化[5]。
PLGC症属中医“胃脘痛”“痞满”“反酸”“嘈杂”等范畴,本病主要由于情志失调、饮食不节、药物、外邪等多种因素损伤脾胃所致[6-9]。金果胃康胶囊是国家级名中医沈舒文教授治疗PLGC的经验方,该方基于PLGC瘀血与脾胃虚弱的病机特点,攻补兼施,可显著改善临床症状,帮助修复胃黏膜损伤,但其作用机制尚不明确。课题组前期研究发现,自噬参与了PLGC的发展,金果胃康胶囊可通过改善细胞的自噬水平起到修复胃黏膜的作用[10-11]。本研究拟观察金果胃康胶囊对UNC-51样激酶1(ULK1)/5’-单磷酸腺苷活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的影响,进一步明确金果胃康胶囊治疗PLGC的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:6周龄SPF级雄性Wistar大鼠75只,体重(180±20)g,购于西安交通大学医学部动物实验中心,许可证号:SCXK(陕)2017-003,饲养于陕西中医药大学SPF级动物饲养室,昼夜循环12 h,恒温25 ℃,45%湿度。本实验经陕西中医药大学动物伦理委员会批准(批准号:SUCMDL20190302002)。
1.1.2 实验药物与试剂:金果胃康胶囊由陕西中医药大学附属医院提供(批号20190429);叶酸片(批号1905056);盐酸雷尼替丁胶囊(批号20190004)。1-甲基-3-硝基-1-亚硝基胍(MNNG,批号M0527,日本TCI);无水乙醇(货号10009218,国药集团);ULK1(批号DF7588,Affiniy);胞浆胞核蛋白提取试剂盒(批号KGP150,南京凯基生物);兔单抗AMPK、p-AMPK、mTOR、p-mTOR(批号2603、2535、2983、5536,Cell Signaling Technology);HRP标记羊抗小鼠二抗、HRP标记羊抗兔二抗(批号BA1051、BA1054,武汉博士德)。
1.1.3 实验仪器:电子天平(型号CPA,北京赛多利斯);离心机(型号HI650,湖南湘仪);生物显微镜(型号BX53,日本奥林巴斯);切片机(型号RM216,德国Leica);包埋机(型号B-P5,武汉俊杰);组织脱水机(型号JT-12J,武汉俊杰);微量分光光度计(型号Nano-100,杭州奥盛);PCR仪(型号EDC-810,东胜创新);紫外分析仪(型号JY02S,北京君意东方);酶标仪(型号Multiscan MK3,Thermo Fisher Scientific Inc.)。
1.2 实验方法
1.2.1 动物模型制备与给药方法:75只Wistar大鼠适应性饲养1周后,运用随机数字表法分为空白组(12只)与造模组(63只)。空白组自由进食饮水,造模组给予150 μg/ml的MNNG溶液避光自由饮用,每日灌胃雷尼替丁溶液0.03 g/kg,每7天断食1次(16 h/次),次日给予45%乙醇溶液灌胃,1 ml/只,连续造模16周[12-13]。
确认造模成功后将造模组大鼠运用随机数字表法分为模型组、金果胃康高剂量组、金果胃康中剂量组、金果胃康低剂量组、叶酸组,每组12只。空白组与模型组大鼠每日灌胃0.9%氯化钠溶液2 ml,金果胃康高、中、低剂量组每日分别予以含1.8、0.9、0.45 g/kg(按体表面积换算成人每日临床等效剂量的2、1、0.5倍)的金果胃康溶液灌胃,叶酸组每日予以叶酸溶液2 ml灌胃,均连续干预8周。
1.2.2 标本采集:末次灌胃后禁食水16 h,腹腔注射10%水合氯醛,取出全胃并剪开,去除胃内容物,胃窦部以4%多聚甲醛固定,石蜡包埋用于HE染色及免疫组化检测。余组织液氮冷冻后-80 ℃保存,用于Western blot及qPCR实验。
1.2.3 HE染色观察胃黏膜病理学变化:将固定好的胃窦组织进行脱水-包埋-切片-脱蜡-染色-封片后,在光镜下进行观察并拍照。
1.2.4 免疫组化法检测ULK1蛋白水平:石蜡切片在3% H2O2中室温孵育15 min,PBS冲洗后滴加山羊血清室温封闭30 min,滴加一抗后4 ℃过夜。PBS冲洗后滴加二抗,37 ℃孵育30 min,PBS冲洗,然后滴加DAB显色液。用Harris苏木素复染、脱水、封片,显微镜下拍照观察,阳性信号呈棕黄色或棕褐色。采用Image Pro Plus 6.0软件对免疫组化照片的光密度进行分析。
1.2.5 qPCR检测胃组织AMPK、mTOR mRNA:运用Trizol试剂提取样本总RNA,以微量分光光度计测定RNA纯度及浓度。RT两步法逆转录合成cDNA,扩增条件为:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,95 ℃延伸15 s,40个循环;60 ℃ 60 s,95 ℃ 15 s。引物序列见表1。相对定量数据处理使用2-ΔΔCt法。
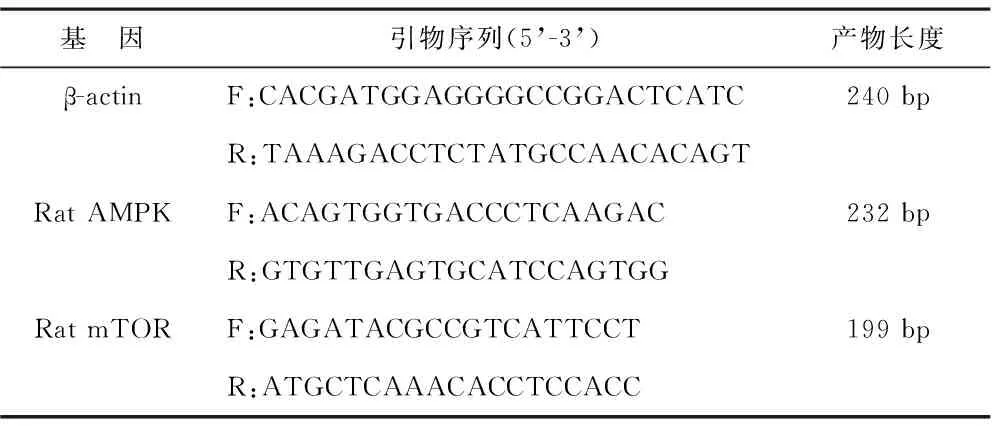
表1 目的基因引物序列
1.2.6 Western blot检测胃组织AMPK、mTOR蛋白:提取胃组织总蛋白,用BCA法测定各大鼠胃组织蛋白含量,经电泳分离,转膜,TBST(封闭液)封闭2 h。一抗(1∶1000)4 ℃过夜,洗净后置于二抗(1∶10000)工作液中,室温孵育2 h,洗净后显色曝光,晾干并扫描胶片,用Band Scan分析灰度值。
1.3 统计学方法 使用SPSS 26.0统计学软件进行统计分析。以均数±标准差表示正态分布的计量资料,方差齐采用单因素方差分析,方差不齐则采用Welch检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠胃黏膜病理学改变 空白组黏膜排列较为规则、紧密,固有腺体形态分布较为整齐,极性好,有少量炎性细胞浸润。模型组黏膜上皮结构紊乱,细胞体积增大,腺体轻度拥挤,排列紊乱,可见异型细胞,异型细胞区域与周围组织分界清楚,核染色深。金果胃康高剂量组黏膜结构较为完整,细胞排列整齐,固有腺分布较为均匀,未见充血、水肿和糜烂面。金果胃康中剂量组黏膜可见少量炎性细胞浸润,固有腺相对减少。金果胃康低剂量组可见黏膜萎缩,排列紊乱,固有腺数量减少,极性差,核染色较深,可见异型细胞和炎性细胞浸润,伴有柱状上皮脱落。叶酸组黏膜情况和金果胃康低剂量组较为相似,其炎性细胞浸润情况较为明显。见图1。
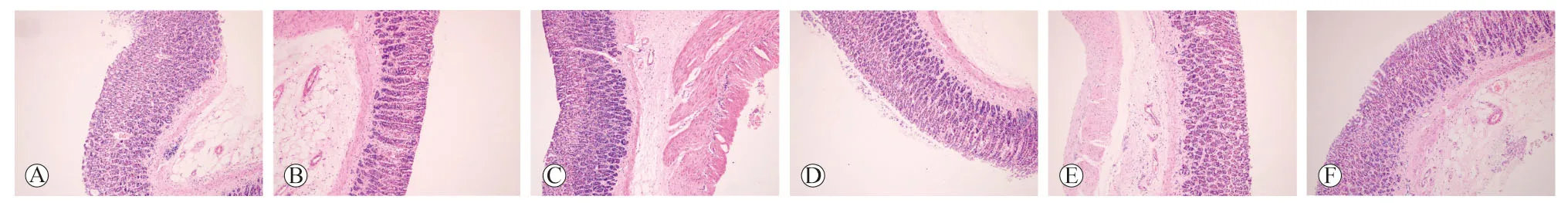
A:空白组;B:模型组;C:金果胃康高剂量组;D:金果胃康中剂量组;E:金果胃康低剂量组;F:叶酸组图1 各组大鼠胃黏膜组织病理学改变(HE染色,×100)
2.2 免疫组化法检测ULK1蛋白 较空白组,模型组ULK1的蛋白表达水平显著降低(P<0.01)。较模型组,各给药组ULK1的蛋白表达水平均不同程度升高(P<0.05),其中金果胃康高剂量组、中剂量组以及叶酸组升高更明显(P<0.01)。见图2(表2)。
表2 各组大鼠ULK1蛋白表达比较
2.3 qPCR检测胃组织AMPK、mTOR mRNA水平 模型组AMPK mRNA表达水平较空白组显著降低(P<0.01)。金果胃康高、中剂量组及叶酸组AMPK mRNA表达水平较模型组均升高(P<0.05)。其中金果胃康高剂量组及叶酸组升高更明显(P<0.01)。模型组mTOR mRNA表达水平较空白组显著升高(P<0.01)。金果胃康高、中剂量组和叶酸组mTOR mRNA表达水平较模型组均明显降低(P<0.01)。见表3。
表3 各组大鼠胃黏膜AMPK、mTOR mRNA表达比较
2.4 Western blot检测AMPK、p-AMPK、mTOR、p-mTOR的蛋白水平 模型组AMPK、p-AMPK蛋白表达水平较空白组显著降低(P<0.01),金果胃康高、中剂量组和叶酸组AMPK的蛋白表达水平较模型组均明显升高(P<0.01),金果胃康高剂量组和叶酸组p-AMPK的蛋白表达水平较模型组均明显升高(P<0.01)。模型组mTOR及p-mTOR蛋白表达水平较空白组显著升高(P<0.01),各给药组mTOR及p-mTOR蛋白表达水平较模型组均降低(P<0.05)。见表4(图3)。
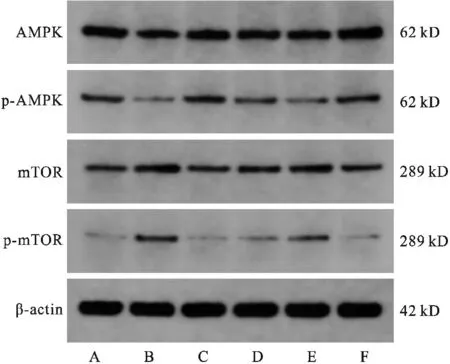
A:空白组;B:模型组;C:金果胃康高剂量组;D:金果胃康中剂量组;E:金果胃康低剂量组;F:叶酸组图3 各组大鼠胃黏膜组织AMPK、p-AMPK、mTOR、p-mTOR蛋白电泳条带
表4 各组大鼠胃黏膜AMPK、p-AMPK、mTOR、p-mTOR蛋白相对表达比较
3 讨 论
PLGC是指包含胃黏膜腺体萎缩、肠上皮化生和不典型增生/异型增生的病理学变化,早期防治PLGC是预防胃癌发生的关键环节,其主要临床表现为胃脘痛、饱胀、嗳气、纳差等[14-15]。中医认为PLGC的病因病机可分为本虚和标实两个方面,本虚以气虚和阴虚为主,标实则以血瘀为主,故应遵循“益气活血”的治疗原则[6]。有研究表明,中药通过辨证论治,可明显改善PLGC患者临床症状,改善胃黏膜病变[16-20]。国家级名中医沈舒文教授根据中医理论并结合临证实践认为PLGC的核心病机是“毒瘀交阻”,即内邪滋生与正气亏损始终存在于疾病的全过程。虚以气虚与阴虚为主,日久每致湿热伤阴,最终气滞经血入络,毒瘀交阻胃络,即《临证指南医案》所谓:“凡气既久阻,血亦应病,循行之脉络自痹”。沈舒文教授经过多年临床积累,结合中医学理论,研制出金果胃康基本方,该方以半枝莲为君药,朱砂七为臣药,佐以枸橘、太子参,四味药物合用,共奏解毒化瘀、清解散滞、行气破结、益气养阴之功,具有良好的临床疗效[21-22]。
自噬是一种细胞内部降解的复杂过程。自噬的分子机制涉及多个保守的Atg(自噬相关)蛋白。营养不足等各种刺激会导致吞噬泡的形成,这一步骤涉及两种蛋白质复合物:一种是含有Vps34、Beclin1、Atg14和Vps15的Vps34复合物[23];另一种是含有丝氨酸/苏氨酸激酶ULK1的ULK1复合物,这是自噬体形成的重要正调控因子。磷酸化的ULK1是自噬的关键调控因子,目前发现AMPK和mTOR这两个激酶可催化ULK1的磷酸化,这两种蛋白催化的特异性磷酸化活动在自噬中起着重要作用[24]。在营养饥饿条件下,AMPK有活性,而mTOR失活,AMPK会在Ser317、Ser467、Ser555、Ser574、Ser637和Ser777位点磷酸化ULK1,同时抑制mTORC1,从而促进自噬。在营养充足的时候,AMPK失活,mTOR在Ser757位点结合并磷酸化ULK1,防止AMPK激活ULK1,并破坏ULK1-AMPK相互作用,从而“关闭”自噬[25]。前期研究发现,金果胃康胶囊可以降低P62蛋白表达、升高LC3Ⅱ/LC3Ⅰ,参与调控细胞自噬,从而起到保护胃黏膜的作用[26]。在AMPK和mTOR调节自噬的过程中,AMPK因缺乏能量或营养而激活ULK1,促进自噬并抑制细胞生长,而mTOR营养物质丰富时抑制ULK1,抑制自噬并促进细胞生长,二者协同作用,维持着机体的平衡[27]。
本研究发现,经金果胃康胶囊干预后,各剂量组大鼠胃黏膜病变情况均有不同程度改善,其中以金果胃康胶囊高、中剂量组胃黏膜改善状况最为显著,表明金果胃康胶囊能有效改善胃黏膜病变的发展。模型组大鼠较空白组,AMPK蛋白及mRNA表达水平降低,mTOR蛋白及mRNA表达水平升高,p-AMPK及ULK1蛋白表达水平降低,p-mTOR蛋白表达水平升高,说明在受到致癌物MNNG刺激后,ULK1同时受到mTOR激活和AMPK抑制的影响,使得自噬被抑制,胃黏膜损伤累积,这可能是PLGC发生的机制之一。金果胃康胶囊干预后,AMPK蛋白及mRNA表达水平升高,mTOR蛋白及mRNA表达水平降低,p-AMPK及ULK1蛋白表达水平升高,p-mTOR蛋白表达水平降低,说明金果胃康胶囊可能通过促进AMPK的表达,同时抑制mTOR,促进自噬的发生,以清除受损细胞,促进组织再生,起到治疗PLGC,防止癌变的目的。
综上,金果胃康胶囊可能通过调控ULK1/AMPK/mTOR信号通路,进而促进细胞自噬,修复胃黏膜,从而起到防治PLGC的作用。
