植物侧枝发育的遗传基础及激素、代谢与环境调控
2024-04-08陈尚昱宋雪薇齐振宇周艳虹喻景权夏晓剑
陈尚昱,宋雪薇,齐振宇,周艳虹,喻景权,夏晓剑,*
(1.浙江大学 园艺系,浙江 杭州 310058; 2.浙江大学 农业试验站,浙江 杭州 310058)
植物株型主要包括株高、茎分枝、花序分枝、叶夹角等不同方面[1]。植物株型主要由遗传因素决定,并受温度、光照、湿度、养分等环境因素调控[2]。合理的株型有利于植物截获光能、促进冠层的光能转化与利用,从而增加生物学产量并提高经济系数[3-5]。随着世界人口迅速增加,如何通过改良农作物株型提高产量以弥补不断扩大的粮食短缺成为农业科学的重要研究方向。小麦育种家Donald最先提出理想株型(ideotype)这一概念,主要包括:茎秆相对矮壮、适度分蘖、穗大且叶片直立、适合密植[6]。20世纪60年代,小麦矮化基因reducedheight(Rht-B1b)和水稻半矮化基因semi-dwarf(sd1)的利用显著提高了作物产量。随着矮化和半矮化作物品种的选育及其在全球范围推广,引发了一场“绿色革命”。后经研究发现株高降低主要是由于赤霉素(gibberellin,GA)合成和信号转导受到抑制所导致[7-9]。
侧枝是植物株型的决定因素之一。禾本科作物在茎的基部形成侧枝称为分蘖,有效分蘖决定穗数,直接影响产量,而减少无效分蘖有利于养分的合理利用[10]。对于番茄等园艺作物,分枝过多会引起通风透光不良影响光合作用及光合产物分配,还会由于局部湿度高引发病害,是影响产量和品质的重要农艺性状之一[11]。对于观赏植物,分枝对于视觉效果具有重要影响[12]。目前的研究表明,侧枝发育主要包括腋生分生组织和侧芽的形成、侧芽的活化和侧芽持续生长形成侧枝等阶段[2],这些不同的发育过程受到内部遗传因子、激素信号、糖信号以及外部环境信号的共同调控[13]。深入研究侧枝发育机制有利于改良作物株型,提高产量和品质。目前关于木本植物芽休眠的调控已有较多综述[14-17],本文主要针对模式植物、农作物以及蔬菜作物等一年生植物的侧枝发育调控机制进行总结。
1 侧芽形成的调控
1.1 器官边界形成
植物的侧枝起源于腋生分生组织(axillary meristem,AM),当AM建立后,叶腋形成一个凸起,发育成芽。AM的形成首先需要在主茎和叶原基之间建立边界,相比于叶原基等生长活跃的组织,边界区域的生长缓慢[18-19]。边界的形成由一个复杂的调控网络控制,转录因子在边界以及AM形成中发挥重要作用(图1)。Schumacher等[20]报道了番茄GRAS家族基因Lateralsuppressor(Ls) 是参与腋生分生组织形成的关键基因。目前,在多个物种中都鉴定到了Ls的同源基因,如拟南芥中的LAS,水稻中的MONOCULM1 (MOC1)[21-22],这些基因在腋生分生组织形成中的功能具有保守性。Ls的基因表达集中在顶端分生组织(SAM)和叶原基间的边界区域,并早于边界的形成[23],并且有证据显示Ls的转录表达受到NAC转录因子CUP-SHAPED COTYLEDON (CUC)的调控[24]。Goblet是番茄中的CUC同源基因,其以Ls依赖的途径促进AM形成[25]。CUC是miR164的调控靶标[26],并且其表达还受到另一个边界形成关键基因REGULATOROFAXILLARYMERISTEMS(RAX) 的调控[27-28]。RAX属于MYB家族,番茄中RAX1同源基因BLIND缺失导致腋生分生组织无法形成[29]。RAX基因表达也受到其他转录因子的调控,例如WRKY转录因子EXCESSIVE BRANCHES 1的功能获得型突变导致RAX1/2/3表达量显著提高,引起AM发生异常[30]。LEAFY和LATERAL ORGAN FUSION1 (LOF1)等转录因子也能促进RAX1表达[31-32]。这些转录因子形成了一个复杂的调控网络以促进边界形成。此外,Ls及同源蛋白可能受到翻译后修饰的调控。水稻中一个细胞周期相关APC复合体的共激活因子TILLERINGANDDWARF1和MOC1互作,促进其蛋白降解[33],而赤霉素(GA)信号途径负调控因子SLENDER RICE 1通过结合MOC1蛋白抑制其降解[34]。高浓度GA能够激活APC,促进MOC1降解,而脱落酸(ABA)信号的适度增强能够通过拮抗GA信号,维持AM大小[35]。LAS还能在叶腋处上调GA降解基因GA2ox4,从而降低叶腋处GA的含量,促进腋芽的生成[21]。

图1 植物腋生分生组织发育的调控网络Fig.1 The regulatory network of the development of plant axillary meristem
1.2 腋生分生组织的建立与维持
腋生分生组织建立的标志是WUSCHEL(WUS)基因的表达。WUS的基因表达集中于干细胞区域下方的组织中心,WUS能够结合小肽信号CLAVATA3 (CLV3)编码基因的启动子并促进其表达,CLV3则抑制WUS基因表达,两者形成的反馈循环能维持AM中干细胞区域的稳定[36-37]。在AM形成中,KNOX转录因子SHOOT MERISTEM-LESS (STM)发挥了关键作用(图1)。STM在水稻和玉米中的同源基因分别命名为ORYZASATIVAHOMEOBOX1 (OSH1) 和knotted1 (kn1)[38-39]。STM主要通过调控细胞分裂素(CK)的合成与信号基因表达,同时抑制GA的合成进而促进AM的形成[40-41],而CK信号对于激活WUS基因表达至关重要[42-43]。近期研究也发现,WUS转录因子能够激活STM的表达,并且直接与STM互作,促进下游CLV3基因的表达[44]。STM的表达受多个因子的共同调控,HD-ZIP Ⅲ型转录因子REVOLUTA (REV)、MYB转录因子LOF1和NAC转录因子CUC都能够直接促进AM中STM的表达[32,45-46]。AP2转录因子DORNROSCHEN (DRN)和DORNROSCHEN-LIKE (DRNL) 能够与REV互作促进STM的表达,LITTLE ZIPPER3则会抑制DRN/DRNL和REV互作,从而抑制STM基因表达[47]。ARABIDOPSIS THALIANA HOMEOBOX GENE1 (ATH1) 对边界组织正确分化十分重要,研究发现ATH1能够和STM互作形成STM自激活环路,维持STM在叶腋处的表达[48-49]。
AM形成过程中,WUS和STM的表达也依赖特定的时间和空间上的表观遗传修饰发挥作用。Polycomb group (PcG) 蛋白是一组通过染色质修饰调控靶基因的转录抑制子,可以分成两个主要的核心蛋白复合体PRC1(Polycomb repressive complex 1)和PRC2[50]。PcG蛋白可以使组蛋白H3第27位赖氨酸发生三甲基化 (H3K27me3),抑制基因表达[51]。在成熟叶片中,WUS和STM基因上抑制性甲基化标记H3K27me3水平较高,而在腋生分生组织中,WUS和STM上的H3K27me3水平较低,这与PcG蛋白的作用有关[52-53]。染色质装配因子Chromatin assembly factor-1 (CAF-1)也参与WUS基因的表达调控。FAS基因编码CAF-1的亚基,在fas1和fas2突变体中,WUS基因呈现异位表达[54],而WUS转录因子也可以通过组蛋白乙酰化修饰调控生长素信号与响应途径[55]。
1.3 植物激素与腋生分生组织形成
生长素和CK是植物体内的重要激素,能够调节细胞分裂和分化,并在AM形成中发挥重要作用。研究表明,生长素极性运输载体PIN1促进生长素从叶腋中流出,从而形成生长素最小值[56]。DII和DR5等生长素信号报告基因表明,AM在生长素水平较低的叶腋细胞中形成,生长素可能通过调控STM基因表达抑制AM形成,在叶腋处过量表达生长素合成基因会抑制SMT的表达和AM的形成[57-58],说明生长素极性运输可能是启动AM形成的早期发育事件(图1)。CK在调控AM形成中也发挥重要作用。研究表明,在植物启动AM发育进程前,能够检测到持续的CK信号,并且CK通过其受体AHK激活下游信号组分B型应答调节因子直接激活WUS的转录[55,57,59]。其他激素在调控AM形成中也发挥作用。GA信号的负调控因子DELLA能够抑制转录因子SPL9对LAS基因转录的阻遏作用,从而促进腋生分生组织形成[60]。油菜素甾醇(BR)信号途径关键转录因子BZR1能直接抑制CUC基因表达导致器官边界不能正常形成[61],而LATERAL ORGAN BOUNDARIES (LOB) 转录因子通过促进BR降解基因BAS1表达,阻碍边界区域BR信号积累以及边界细胞的生长,BZR1则促进LOB的基因表达,从而形成反馈调控循环[62]。
2 侧芽活化的调控
腋生分生组织形成后继而形成侧芽,其持续生长则产生侧枝。但侧芽的生长并不是连续的,取决于营养状况和激素水平,侧芽可能暂时处于休眠状态。当植物自身和外界环境条件合适时,则会再次启动侧芽生长。调控侧芽生长过程中,转录因子BRC1具有核心作用,糖信号及生长素、CK和独脚金内酯(SL)等激素信号主要通过BRC1调控侧芽生长(图2)。

图2 植物侧芽活化的调控网络Fig.2 The regulatory network of the activation of plant axillary buds
2.1 BRC1-侧芽生长调控的核心因子
把野生植物驯化为农作物,对人类历史进程具有重要意义,将大刍草(Zeamaysssp.parviglumis)驯化为现代玉米是其中的经典案例[63-64]。大刍草与现代玉米相比,分枝多、雌花序小、籽粒小,而在长时间的驯化中,分枝逐渐消失,植株由一根茎秆组成,茎秆顶端有一个雄穗和一个侧生的雌穗,穗变大。导致这些变化的关键基因是TEOSINTEBRANCHED1(TB1),在现代玉米中TB1的表达显著高于大刍草[65]。TB1属于TCP转录因子家族,TCP转录因子在种子萌发、叶片形态、昼夜节律以及侧枝发育等过程中发挥重要作用[66-67]。BRC1是TB1的同源基因,在腋芽处特异性表达,能够抑制侧芽的生长[68]。FC1是水稻中TB1的同源基因,fc1突变体分蘖明显增强[69]。番茄和豌豆的研究也相继表明BRC1在调控分枝中发挥关键作用[70-71]。BRC1能够整合激素、养分、光照等,是侧芽生长的核心调控因子。BRC1是SL信号途径的下游靶标基因[72],而CK拮抗SL信号并抑制BRC1表达促进侧芽的活化[73]。在番茄中,BR信号的关键转录因子BZR1能够直接结合BRC1的启动子,抑制其基因表达从而促进番茄侧枝生长[74]。糖不仅作为能量物质,还能作为信号分子调控BRC1在内的多个基因的表达,促进侧芽生长[75-76]。此外,光质也会影响BRC1表达,远红光会显著提高BRC1的表达,抑制分枝[77]。蛋白调控水平上,TIE1能够与BRC1互作,抑制其转录活性,促进分枝[78]。
随着研究的深入,BRC1调控侧芽的具体机制也被发现(图3)。先前研究表明,brc1突变体侧芽中ABA含量显著降低,而外源ABA不会影响BRC1的表达,说明ABA可能在BRC1下游发挥作用[79]。近期研究发现,BRC1通过直接调控HB21、HB40和HB53等基因影响侧芽中的ABA含量与信号,从而抑制侧芽的生长[80]。玉米tb1突变体中,ABA转运及信号相关基因均显著下调,这表明TB1也影响了ABA信号。TB1还能够直接结合tasselsreplaceupperears1和teosinteglumearchitecture1启动子调控其他发育过程[81]。也有研究表明,BRC1通过其他激素调控侧枝发育。番茄BRC1能够直接抑制侧芽CK的合成基因LOG4,并同时激活CK和GA的降解基因从而抑制侧芽的生长[82]。黄瓜BRC1能够直接结合生长素运输载体基因PIN3启动子抑制其转录,利用BRC1启动子表达PIN3会导致分枝变多,表明BRC1可能通过抑制侧芽生长素运输抑制侧芽的生长[83]。此外,BRC1可能通过调控细胞周期相关基因抑制分枝[79,81]。BRC1还能够与开花因子FT和TSF互作抑制AM过早成花[84]。
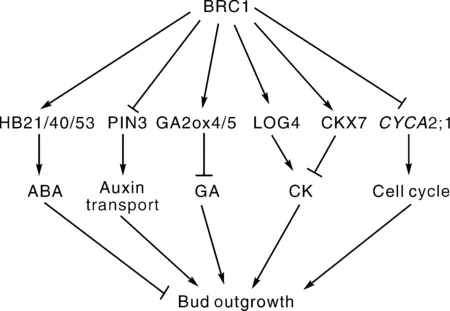
图3 BRC1抑制植物侧芽活化的机制Fig.3 The mechanisms by which BRC1 inhibits activation of axillary buds in plants
2.2 顶端优势-生长素和糖
顶端优势在高等植物中普遍存在,侧芽由于顶端优势的抑制,往往处于休眠状态,当顶端优势减弱后,侧芽可发育成侧枝[85]。长期以来,生长素被认为是维持顶端优势的关键因素。生长素主要在植株嫩叶中产生,通过极性运输载体PIN往外输出[86]。一方面,根据生长素渠化模型理论,生长素极性运输与植物维管组织发育密切相关[87],侧芽生长过程的生长素运输会与植物主茎的生长素运输发生竞争而受到抑制[88],但是主茎的极性运输如何抑制侧芽的极性运输仍不清楚。近期的研究发现,专一性地抑制侧芽的生长素响应或运输并不能影响顶芽去除或CK处理后侧芽的早期生长[89]。同时还应当注意到,维管组织的发育也依赖生长素极性运输,而发达的维管组织有利于养分的运输和侧芽的生长。实际观察到番茄等园艺作物侧芽长势与植株主茎的粗细呈正相关,而与株高一般呈负相关,是否与生长素在主茎中径向或纵向运输的分配有关还值得进一步探究。另一方面,根据第二信使理论,生长素通过促进SL合成或抑制CK合成间接调控侧枝形成[90],具体见下文阐述。生长素参与顶端优势,看似与生长素促进植物生长相矛盾,但是仔细分析会发现,生长素并不会直接进入侧芽[91]。生长素更可能间接地调控类似于BRC1等决定侧芽活化的关键因子进而调控侧芽生长。侧芽早期生长阶段可能更依赖其他因素,而生长素在侧芽活化启动之后促进其生长[92]。
目前的主流观点认为,糖是侧芽活化的关键因子。糖在植物生长发育中的作用举足轻重,不仅是能量来源,而且还是信号物质[93]。研究发现,当去除植株顶芽后,植株中的光合产物快速重新分配,并在侧芽中积累,同时观察到侧芽的生长。这表明糖是启动侧芽活化的原初因子[94],并进一步通过调控SL、CK和BR等激素信号促进侧枝发育[74,95-97]。转录组分析发现,休眠芽与生长活跃的侧芽相比,存在大量碳饥饿相关基因显著上调,这可能与能量感受器SnRK1在能量亏缺情况下被激活,并诱导下游碳饥饿基因的表达有关[98]。在糖积累充裕的情况下,糖代谢形成海藻糖-6-磷酸(Tre6P),其作为信号能够抑制SnRK1的活性,促进植物生长[99-100]。在解除豌豆的顶端优势后,确实在侧芽中发现Tre6P积累[101],而在侧芽中特异性表达Tre6P合成酶基因TPS能促进分枝[102]。此外,RAMOSA3编码Tre6P磷酸酶,能使Tre6P转变为海藻糖而丧失信号功能,RAMOSA3在腋生分生组织中表达,通过调节糖信号控制花序分枝[103]。Target of Rapamycin (TOR)是真核生物中另一个糖信号受体,通过介导下游蛋白磷酸化调控茎尖细胞周期相关基因与BR信号[104-105]。但TOR在侧枝发育中的功能与机制仍不清楚。
2.3 SLs与侧芽生长调控
SLs是一类萜类小分子化合物,是近年来发现的新型植物激素,在调控种子萌发、根系发育、菌根共生、维管组织发育以及各种胁迫抗性方面发挥了重要作用[106]。拟南芥moreaxillarygrowth(max)、水稻high-tilleringdwarf(htd)、豌豆ramosus(rms)、矮牵牛decreasedapicaldominance(dad) 等多分支突变体,都与SL合成或信号有关[107],说明SLs在调控侧枝发育中发挥关键作用,并且在不同物种中具有保守性。SLs主要在根系中合成,通过D27、CCD7、CCD8等类胡萝卜素代谢酶以及MAX1等细胞色素单加氧酶所催化的系列生化反应,质体中的β-胡萝卜素最终转化为有生物活性的SLs[107]。SLs是参与植株地上和地下信号交流的重要信号。由于生长素信号促进SL合成基因的表达[108-109],地上部的生长素运输到根系能够促进根中SLs的合成[110],而根系中的SLs运输到地上部抑制侧芽生长[111]。PLEIOTROPIC DRUG RESISTANCE 1是目前仅有报道的SLs运输载体[112]。值得注意的是,地上部SLs合成基因的表达量远低于根系,这可能与根系运输的SLs对地上部自身SLs合成的抑制有关,将正常植株地上部与SL合成缺失突变体的根系嫁接,则会显著增强地上部SL合成[113],说明茎自主合成的SLs足以抑制侧芽的生长。地上部营养状况良好时,侧芽生长旺盛,导致更多的生长素流入根中促进SLs合成,而SLs抑制侧枝发育可能是对地上部生长状况的一种反馈调节,生长素与SLs的相互作用对于维持生长平衡与良好株型可能具有重要作用。
侧芽中SLs主要通过诱导BRC1基因抑制侧芽生长[71],近年来的研究逐渐明确了SL调控BRC1基因表达的信号通路。α/β水解酶DWARF 14 (D14) 是SLs的受体,其与SLs结合后会招募F-box蛋白MORE AXILLARY GROWTH 2 (MAX2)和转录抑制因子D53或D53-like蛋白,MAX2作为SCF复合体的亚基,参与D53/D53-like蛋白泛素化及降解[107]。D53/D53-like蛋白通过与SPL转录因子互作或直接作为转录因子调控BRC1等下游基因表达[114-115]。SPL家族是植物特有的一类转录因子,能识别并结合启动子上的GTAC顺式作用元件,进而调控靶标基因的表达。SPL的表达受到miR156调控,并参与植物的许多生长发育过程[116-117]。水稻IdealPlantArchitecture1 (IPA1) 基因编码SPL14转录因子,该基因在miR156识别位点发生突变使其表达量适度提高,导致分蘖数减少、抗倒伏、穗分枝数增加、产量显著提高[118]。水稻中miR156-SPL14分子模块也能独立于SL信号调控分蘖[119]。此外,也有研究发现,D53能够与BR信号下游的转录因子BES1互作通过抑制BRC1基因表达促进水稻分蘖[120],而MAX2也能促进BES1蛋白的降解[121]。最近研究发现,糖能够抑制MAX2基因的表达,促进D53蛋白的积累,这为糖和SLs互作调控植物分枝提供了新的分子机制[122]。
2.4 CKs与侧芽生长调控
植物体内CKs主要由AMP/ATP/ADP作为前体,在异戊烯基转移酶(IPT)、细胞色素单加氧酶(CYP735A)及磷酸核糖水解酶(LOG)等作用下合成产生[123]。CKs的受体由组氨酸激酶AHK组成,结合CKs后受体激酶结构域内的组氨酸残基被磷酸化,并将磷酸基团转移到天冬氨酸残基,然后将磷酸基团转移到组氨酸磷酸转移蛋白 (AHP) 的组氨酸残基上,磷酸化的AHP从细胞质转移到细胞核,并将磷酸基团转移到B型和A型应答调节因子。B型应答调节因子是一类转录激活因子,能够直接结合并调控大量包括A型应答调节因子等在内的基因,而A型应答调节因子则抑制B型应答调节因子的功能,从而对CKs响应起到反馈调控[124]。去除豌豆植株顶芽后会迅速诱导茎节中IPT基因的表达,以及茎节和侧芽中CKs含量的提高[125]。番茄中过量表达CKs合成基因会显著减弱顶端优势[126],而外源处理CKs会拮抗SLs对侧芽生长的抑制作用[73]。因此,CKs与SLs在调控侧芽生长中具有相反的作用。但是相比SLs,CKs在腋生分生组织的建立、维管组织和叶片发育等方面,发挥了更为广泛的作用[123]。因此,CKs调控分枝的机制更为复杂,CK可以通过不依赖于BRC1的途径促进豌豆分枝也说明了这一点[71]。
CKs可能通过多个途径调控侧芽的生长。首先,B型应答调节因子可以激活WUS基因表达,促进腋生分生组织形成,而CKs增强WUS基因的表达会提高分生组织活性,促进叶片分化和发育,形成更多分枝[55,59]。其次,CKs与糖信号的关系密切,CKs能够通过上调转化酶和细胞周期相关基因表达增加库强而促进侧芽生长[13]。再次,CKs促进拟南芥分枝伴随生长素极性运输的增强,但是CKs信号途径在调控生长素极性运输中的作用仍不清楚,B型应答调节因子的缺失反而促进侧枝发育[127],说明CKs可能通过其他信号元件调控生长素极性运输和侧芽生长。最后,CKs也可能通过与其他激素互作调控侧芽生长。豌豆中发现了D53同源基因的缺失突变体,该突变体的顶端优势增强,这与D53作为SL信号的负调控因子促进分枝的功能相一致,而CK可以诱导豌豆D53同源基因的表达[128],这在分子层面提供了CK与SL拮抗的证据。番茄中则发现,B型应答调节因子可以促进BR合成,进而通过BZR1抑制BRC1基因表达促进侧芽生长[74]。
3 环境调控侧枝生长的机制
3.1 矿质营养
侧芽的生长受到多种环境条件的影响,具有高度的可塑性。矿质营养是影响植物各方面生长发育的重要因素。当养分供应不足时,光合作用、氮同化等生理过程受到抑制,限制了侧枝发育等营养生长,而根系的生长则会相对得到促进以利于养分吸收。高水平的磷会抑制根部SLs合成,而在低磷条件下,番茄中SLs的合成显著上升[129]。同样,水稻中SLs合成基因的表达也会被诱导从而抑制分蘖[130]。CKs与作物的氮素水平密切相关。低氮条件下,豌豆和高粱的根中SLs含量会显著上升[131],这可能与低氮环境下地上部生长素极性运输增强,根中生长素水平升高进而促进SLs合成有关[132]。硝酸盐能够诱导IPT基因的表达,提高CKs含量,并促进CKs从根部向上运输[133-134],同时氮同化形成的氨基酸也在水稻侧芽CKs合成及分蘖中发挥重要作用[135]。
3.2 温度
温度是植物形态建成的重要环境因子。温度适度升高会通过光信号途径、表观遗传修饰等促进生长素、BR等激素合成,促进植物生长[136]。但是关于温度如何调控植物的分枝发育研究较少。低温环境会抑制杨树中MADS-BOX转录因子编码基因SHORTVEGETATIVEPHASE-LIKE(SVL) 的表达,而SVP通过激活TCP18以及ABA的合成与信号相关基因,同时抑制GA和FT相关基因,从而抑制芽的生长[137]。同时,低温也能分别激活和抑制TERMINAL FLOWER 1和LIKE APETALA 1这两个花发育相关基因,从而抑制杨树的芽生长[138]。水稻中,低温会促进MADS57和TB1蛋白互作,诱导SL信号受体基因D14表达,从而抑制水稻的分蘖[139]。
3.3 光照
光照是调控侧枝发育最重要的环境因素。光照不仅通过光合作用为侧枝发育提供所需要的糖,还作为信号通过改变激素代谢和BRC1表达等调控侧枝发育。光照下,玫瑰茎和芽中的糖含量上升,同时伴随着侧芽的生长[140]。在高粱中,移除叶片显著抑制侧芽生长,同时伴随SL信号基因MAX2和细胞周期相关基因的表达变化,但不会引起TB1基因的表达变化[141]。除了提供光合产物外,光也作为形态建成的信号调控侧芽生长。在处理光合作用的抑制剂之后,光照仍然能激活腋生分生组织活性并促进玫瑰侧芽生长[142-143],这可能与光信号通过TOR激酶和CKs信号诱导WUS基因表达有关[144]。环境中的光质,即红光和远红光的比例(R∶FR),也对侧芽生长具有重要调控作用。远红光主要通过增强BRC1基因表达抑制侧芽生长[77,141],但不同于光合作用提供侧芽生长所需要的糖,R∶FR主要通过影响光敏色素信号途径调控侧芽生长。植物的光敏色素包括PHYA-PHYE五个成员,其中PHYA和PHYB发挥主要作用[145]。光敏色素存在Pr和Pfr两种形态,在红光下钝化的Pr转变为活化的Pfr,而在远红光下活化的Pfr转变为钝化的Pr。在红光下,PHYB的活性和稳定性较高,并转移到细胞核调控基因表达,而在栽培密度较高的情况下,周围植株对光照的截获导致R∶FR比例降低以及PHYB活性下降。PHYB与转录因子PIF互作继而抑制PIF活性,是目前所知PHYB调控基因表达的主要途径。PIF转录因子下游,生长素合成基因是重要的调控靶标。因此,远红光可能抑制PHYB并通过增强PIF活性提高生长素水平和顶端优势[146]。但是也有研究发现,远红光抑制侧芽生长中,ABA含量的变化要早于生长素[147],而BRC1是调控ABA合成与信号的重要因子[80]。因此,PHYB可能通过抑制PIF等转录因子直接调控BRC1基因表达[148]。最新研究发现,PHYB可能通过激活转录因子HY5直接抑制BRC1基因表达促进番茄侧芽生长[82]。PHYA感受光的机制较为独特[145]。PHYA被红光激活后在FHY1的帮助下进入细胞核,而在远红光下PHYA转变为Pr形态并与FHY1蛋白解离,随后再被红光激活并调控基因表达。与PHYB不同,PHYA蛋白在红光下不稳定,因而主要在R∶FR比例较低的环境下起作用,这可能是植物进化出的感受光环境变化的独特机制。最近的研究还发现,PHYA信号途径的调控因子FHY3和FAR1能够促进D53-like基因的表达继而抑制SL信号,并能够与SPL转录因子互作共同抑制BRC1基因表达[149]。
4 展望
在理论研究层面上,关于早期侧芽形成的调控机制方面,BR信号在其中的功能还有待进一步研究。尽管目前发现的BR合成与信号突变体的侧枝发育一般都受到抑制,但是应当注意到,BR信号在侧枝发育中的作用可能存在两面性。在侧芽的活化及后续的生长阶段,BR作为促进生长的激素可能通过调控细胞周期、细胞膨大、生长素极性运输以及糖的代谢利用对植物分枝发挥积极作用;而在早期侧芽形成中,BR的作用并不明确。拟南芥中边界区域中如果BR信号增强,会促进边界区域细胞的生长,不利于边界与腋生分生组织的形成,进而导致茎生叶与花茎融合[61]。边界区域BR信号的强度受BR降解基因BAS1的限制[62]。作物中如何通过组织特异性控制BAS1基因表达进而调控侧芽发生进程值得深入研究。
关于侧芽活化调控方面,糖信号的作用机制还有待深入研究。目前的研究认为Tre6P是诱导侧芽活化的信号,但是Tre6P如何发挥作用仍不清楚。虽然有研究报道Tre6P能抑制SnRK1活性进而调控PIF转录因子促进细胞伸长[100],但由于远红光通过PIF抑制分枝,Tre6P-SnRK1信号模块在侧芽活化中的作用仍不明确。Tre6P可能通过调控开花基因表达而促进分枝[102],而开花相关基因调控分枝仅在少数物种中报道,在其他作物中还有待验证。糖信号另一关键受体TOR在侧枝发育中的作用还未见报道。TOR属于丝氨酸/苏氨酸蛋白激酶,通过磷酸化下游底物发挥信号功能。随着蛋白质谱技术的发展,结合磷酸化蛋白质组学、转录组、分子互作等有望发现TOR信号途径的关键因子及其在侧枝发育中的作用。这些将为解决糖信号具体如何调控CK、SL、BR等激素信号奠定基础。最近Ye等[150]发现了TOR下游的一个新的底物FIE,其作为PRC2复合体的亚基参与H3K27me3修饰,从而在基因组全局水平调控组蛋白甲基化修饰和基因的转录表达,这为研究糖信号调控侧枝发育的机制提供了新的思路。此外,生物钟在调控侧芽生长中的功能值得关注。生物钟是植物适应地球24 h昼夜交替,在光照、温度等周期性变化作用下形成的较为稳定的调控代谢、生长和抗性节律性变化的一种内在机制[151]。顶端优势作用下,侧芽的生长缓慢,但仍保持一定生理活性,其生理代谢过程理应受到生物钟的调控。水稻中生物钟基因CCA1突变导致侧芽糖含量升高就说明了这一点[152],而糖信号也能抑制CCA1基因表达,从而形成反馈循环。侧芽的生长依赖于叶片产生的光合产物,侧芽的生物钟如何与叶片生物钟匹配,以及如何与糖信号相互作用从而促进侧芽生长,这些都值得深入探讨。
茎分枝是影响作物产量和品质的重要农艺性状。对于农作物,株型紧凑、减少分蘖,有利于密植、提高单产;对于番茄等园艺作物,减少分枝还有利于减少整枝打叉的人力成本,促进轻简化栽培和提高经济效益。前人在分子遗传学研究或育种工作中发现的少或无侧枝突变体通常在侧芽形成相关的转录因子基因上发生突变,这些转录因子由于在器官边界的形成中发挥作用,不仅影响侧枝发育,还影响花器官发育,对产量造成不利影响。在技术层面上,随着基因编辑技术的进步,如何通过精细调控这些基因的表达,进而在减少这些基因突变对生殖发育不利影响的前提下,创制少分枝的材料是未来需要研究的方向。SPL转录因子在抑制侧枝发育的同时,还促进开花和花序分枝[153],因此是调节植株营养生长和生殖生长的重要因子,也应当是利用基因编辑进行株型改良的分子靶标。尤其是SPL基因的表达能够被miR156抑制,其miR156识别位点是潜在的编辑靶点。同样,BZR1等转录因子通过结合BRC1启动子抑制其基因表达,通过基因编辑破坏BRC1启动子上BZR1的识别位点可能也是增强顶端优势的有效手段。
