卡瑞利珠单抗治疗经典型霍奇金淋巴瘤相关性甲状腺功能异常分析*
2024-04-08刘金玉蔡乐汤智慧张筱璇王天琳
刘金玉,蔡乐,汤智慧,张筱璇,王天琳
(中国人民解放军总医院医疗保障中心药剂科,北京 100853)
甲状腺功能(甲功)异常是程序性细胞死亡蛋白1(programmed death-1,PD-1)抑制剂最常见的内分泌系统免疫相关不良事件(immune related adverse events,irAEs),发生率为5%~10%[1],甲功异常早期漏诊率高,超半数患者确诊时甲功损伤已不可逆,严重者需停药并终身使用激素替代治疗[2]。PD-1抑制剂为不符合移植条件的复发或难治性经典型霍奇金淋巴瘤(classical hodgkin lymphoma,cHL)的二线及以上治疗方案[3],对传统一线化疗方案起到有效补充,了解相关甲功异常的临床特征和相关因素,对于cHL患者早期、快速识别该药品不良反应(adverse drug reaction,ADR)、改善预后具有重要意义。卡瑞利珠单抗是我国自主研发的PD-1抑制剂,2019年5月获批上市[4],目前缺乏针对卡瑞利珠单抗治疗cHL后引起甲功异常的相关报道。现回顾性分析卡瑞利珠单抗治疗cHL致甲功异常的临床特征,探讨相关因素,为irAEs的识别与管理提供经验。
1 资料与方法
1.1研究对象 收集北京市海淀区某三甲医院2017年1月1日至2020年12月31日应用卡瑞利珠单抗的cHL患者的临床资料,纳入标准:①经病理确诊cHL;②住院期间至少接受一个周期卡瑞利珠单抗治疗。排除标准:①患者应用卡瑞利珠前甲功异常;②患者入院前使用过卡瑞利珠单抗;③缺少甲功基线值或治疗期间未检测甲功。本研究经该院伦理委员会批准通过(伦审S2022-184-02号)。
1.2资料收集 收集患者的年龄、性别、身体质量指数(body mass index,BMI)、cHL病理分型、分期等一般情况,卡瑞利珠单抗给药剂量、是否联合用药等治疗情况,记录卡瑞利珠单抗治疗前后甲功检查结果;对于甲功异常患者,记录甲功异常类型、分级、发生时间、干预手段及预后。
1.3甲功异常分类及判定标准 参照2019年中国《甲状腺功能亢进症基层诊疗指南》和《甲状腺功能减退症基层诊疗指南》[5-6],将甲功异常分为:(1)甲状腺功能亢进症(甲亢):血清促甲状腺激素(thyroid stimulating hormone,TSH)降低,游离甲状腺素(free thyroxine,FT4)和(或)游离三碘甲状腺原氨酸(free triiodothyronine,FT3)增高;(2)亚临床甲亢(亚甲亢):TSH降低,FT3和FT4正常;(3)甲状腺功能减退(甲减):血清TSH升高,FT4和(或)FT3降低;(4)亚临床甲减(亚甲减):血清TSH升高,FT3和FT4正常(TSH正常区间为0.35~5.5 mU·L-1,FT3正常区间为2.76~6.3 pmol·L-1,FT4正常区间为10.42~24.32 pmol·L-1)。
1.4甲功异常的临床特征 收集患者病历信息,对甲功异常发生时间、损伤类型、严重程度以及转归等卡瑞利珠单抗相关甲功异常的临床特征进行描述性统计分析。参照常见不良事件评价标准(common terminology criteria for adverse events,CTCAE)5.0版[7]判定甲功异常程度,将甲亢或甲减分为5级,1级(轻度):仅为临床或诊断可见,无需治疗;2级(中度):需甲状腺抑制/甲状腺激素替代治疗,借助于工具的日常生活活动受限;3级(重度、但非立即致命的):自理性日常生活活动受限,需要住院治疗;4级(重度、威胁生命):危及生命需紧急治疗;5级:死亡。
1.5统计学方法 利用Excel软件建立数据库,根据是否发生甲功异常将患者分为甲功异常组和甲功正常组,采用SPSS 12.0版软件进行统计分析。对计量资料进行正态性检验与方差齐性检验,若符合正态分布,以平均值±标准差表示,两组间差异比较采用独立样本t检验;若不符合正态分布,以中位数(第一四分位数,第三四分位数)表示,组间差异用独立样本非参数检验。计数资料用百分率(%)表示,组间比较采用卡方χ2检验或Fisher精确法。以P<0.05为差异有统计学意义。
2 结果
2.1患者的一般情况 纳入患者47例,其中男28例(59.57%),女19例(40.43%),年龄11~73岁,中位年龄28岁,平均BMI为22.54 kg·(m2)-1。其中1例患者有血糖值波动史,应用卡瑞利珠单抗期间出现血糖异常,考虑主要与葡萄糖溶媒输注有关,给予合成人胰岛素注射液控制至空腹血糖6~8 mmol·L-1,餐后2 h血糖<10 mmol·L-1。2例有甲状腺病史,1例甲亢,1例甲减,应用卡瑞利珠前甲功均已恢复正常。根据cHL病理分型分为结节硬化型29例、混合细胞型13例、淋巴细胞为主型2例、未写明分型3例。cHL分期为Ⅱ期6例、Ⅲ期12例、Ⅳ期29例。卡瑞利珠单抗给药剂量除2例患者为400 mg外,其余均为200 mg。47例患者中,治疗时间最长为41个周期,中位治疗时间为23个周期,卡瑞利珠单抗初始单药治疗7例(14.89%),其中6例后期改为联合地西他滨化疗和(或)西达本胺靶向治疗方案。初始联合地西他滨化疗40例(85.11%),其中17例后期加用西达本胺治疗。应用卡瑞利珠单抗期间,43例患者合并使用保肝药异甘草酸镁和(或)多烯磷脂酰胆碱,42例患者合并使用质子泵抑制剂,28例患者合并使用非甾体抗炎药布洛芬和(或)吲哚美辛,8例患者使用镇痛药氨酚羟考酮。
2.2甲功异常患者的一般情况 47例患者发生甲功异常12例(25.53%),其中亚甲减、甲减共10例(21.28%),亚甲亢2例(4.26%);男女各6例,年龄11~44岁,中位年龄26岁,BMI平均22.43 kg·(m2)-1,均无合并疾病。其中1例为上述既往甲减病史患者,在应用卡瑞利珠后出现亚甲减,见表1。
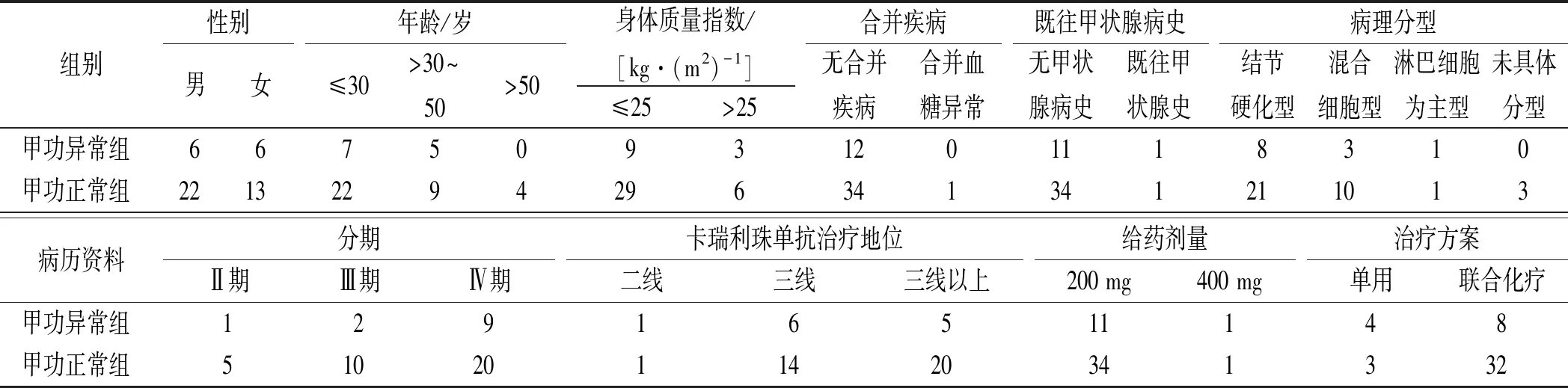
表1 患者一般资料
2.3甲功异常患者的临床特征 12例甲功异常均为1或2级ADR。10例患者甲功异常与卡瑞利珠单抗的因果关系为“很可能”,2例为“可能”。甲功异常发生在卡瑞利珠单抗治疗后的第1至第22个月,中位诱导时间为第6个月。病理分型主要为结节硬化型(66.67%),分期主要为Ⅳ期(75.00%),见表2。

表2 由卡瑞利珠单抗引起的甲功异常患者的临床特征
3例甲减患者在最初诊断时FT3均在正常范围,FT4平均值为10.05 pmol·L-1,略低于正常值下限,TSH的最高值分别为150(仪器检测上限)、7.14和150 mU·L-1,其中1例甲减由亚甲减发展而来。7例亚甲减患者最初诊断时TSH中位数为6.51 mU·L-1,其中1例在后续检测中TSH升高至12.65 mU·L-1,2例亚甲亢患者最初诊断时TSH值分别为0.29、0.22 mU·L-1。
甲功异常患者抗甲状腺球蛋白抗体(thyroglobulin antibodies,TgAb)和抗甲状腺过氧化物酶抗体(thyroid peroxidase antibodies,TPOAb)抗体滴度基线均在正常范围内(TgAb正常区间为<60 U·mL-1,TPOAb正常区间为<60 U·mL-1)。2例甲减患者后期出现抗体异常,表现为TgAb与TPOAb同时升高。
3例甲减患者中2例采用左甲状腺素替代治疗,1例恢复正常,1例好转并维持亚甲减状态。7例亚甲减患者中1例(TSH最高值12.65 mU·L-1)给予左甲状腺素替代治疗,该患者甲功虽仍持续异常但未加重,未干预的6例中2例甲功恢复正常,2例持续异常但未加重,2例因诊断后未再行检测情况不明。2例亚甲亢患者甲功后期均恢复正常,见表2。
2.4甲功异常的相关因素分析 甲功异常组TSH基线水平显著高于甲功正常组,甲功异常与TSH基线水平相关(P=0.03),但与性别(P=0.51)、年龄(P=0.40)、BMI(P=0.67)、病理分型(P=0.70)、分期(P=0.62)、卡瑞利珠给药剂量(P=0.45)及是否联合化疗(P=0.17)无关,也与FT3水平(P=0.36)、FT4水平(P=0.45)、TgAb滴度(P=0.27)和TPOAb滴度(P=0.16)等甲状腺相关指标无关,见表3—4。
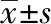
表3 卡瑞利珠单抗治疗后甲功异常的发生与基线甲功水平的相关性

表4 卡瑞利珠单抗治疗后甲功异常的发生与TgAb和TPOAb滴度的相关性
3 讨论
本研究结果显示,卡瑞利珠单抗治疗cHL相关性甲减与甲亢的发生率分别为21.28%和4.26%,与治疗食管癌的临床研究结果相近(20%,5%)[8],低于治疗黑色素瘤的临床研究结果(33.3%,16.7%)[9-10],其中甲减发生率位于既往两项卡瑞利珠单抗单药或联合化疗治疗cHL的临床研究结果区间内(7%~26.7%)[11-12],高于Meta分析获得的卡瑞利珠单抗单用或联合化疗时甲减整体发生率(4%~16%)[13]。甲功异常发生率的差异可能与肿瘤类型、是否联合用药、样本量等因素有关,提示卡瑞利珠在治疗任何瘤种过程中均应密切关注甲功变化,也提示在不同肿瘤类型中开展甲功异常分析的必要性。
本研究中10例甲减的中位诱导时间为卡瑞利珠单抗治疗后的第7.5个月,2例甲亢的中位诱导时间为卡瑞利珠单抗治疗后的第4.5个月,均晚于卡瑞利珠单抗说明书中对临床研究的整合报道(甲减中位诱导时间为2.9个月,甲亢为2.0个月)[14],本研究中甲功监测平均间隔为3.9个月,个别患者2次甲功检测时间间隔长达13个月,因此不排除与本研究中既往甲功监测间隔时间偏长有关。有研究表明,PD-1抑制剂的内分泌毒性出现时间通常在首次给药后的第10—24周,停药后2~3年仍可发生,时间跨度大,提示临床应定期监测甲功,降低漏诊率,若停用卡瑞利珠治疗后仍出现乏力、疲劳、心悸等症状,应及时监测甲功明确诊断,并根据《免疫检查点抑制剂相关的毒性管理指南(2021)》推荐,间隔4~6周开展监测[1]。
本研究中,甲功轻度异常患者TgAb与TPOAb滴度未见明显异常,而甲功中度异常的3例中有2例出现抗体滴度的异常升高,提示抗体滴度的变化可能与甲功异常的严重程度有关,该推断与既往报道相似[15]。鉴于抗体滴度通常与甲功同时检测,结果易于获取,可作为卡瑞利珠单抗相关甲功异常早期预警的标志物。
3例甲减患者中,2例为直接发生,1例由亚甲减发展而来,提示患者甲功出现波动时,应增加监测密度,及时发现ADR进展并适时干预。《免疫检查点抑制剂相关的毒性管理指南(2021)》指出,对于1或2级甲功异常建议继续使用免疫治疗,对于甲减,TSH高于10 mU·L-1时,补充甲状腺素;对于存在症状的甲亢,可给予普萘洛尔等口服对症处理[1]。本研究12例甲功异常患者中,TSH>10 mU·L-1的3例患者给予左甲状腺素钠片治疗,亚甲减、亚甲亢患者未予药物干预,所有患者均延续卡瑞利珠初始治疗方案,提示对于轻度甲功异常,根据指南推荐及时给予纠正,对于维持PD-1抑制剂的治疗延续性有利。
《免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识》指出,PD-1抑制剂所致甲功异常易发生于女性、年轻群体,但尚无定论,且样本多来源于上市时间早的进口药品[2,16],本研究对国产卡瑞利珠单抗相关甲功异常与性别、年龄的相关性进行验证,未发现相关性,可见此结论仍需大样本数据进一步明确。高BMI导致体内促炎因子升高,影响免疫功能,进而促进甲状腺irAE的发生,有报道显示高BMI与临床型甲亢的发生呈正相关[17],但本研究未见甲功异常与BMI存在相关性,可能与样本中甲功异常多为轻度,且无临床型(2级)甲亢有关。样本中仅有1例患者应用卡瑞利珠期间出现血糖异常,有2例患者有甲状腺疾病病史,难以统计PD-1抑制剂所致甲功异常与合并疾病、既往甲状腺病史的相关性。卡瑞利珠单抗治疗期间的合并用药及卡瑞利珠单抗与合并用药的联合使用未见相关甲功异常的报道。本研究未见卡瑞利珠单抗治疗线数与甲功异常的相关性,与小样本回顾性分析报道不一致[18]。多篇报道显示联合用药是甲功异常的潜在危险因素[19-20],但现有文献中未对联合用药的种类或机制予以区分,联合其他免疫检查点抑制剂(如CTLA-4抑制剂)或多种靶向药物均有引发甲功异常的风险,可见联合方案升高甲功异常风险与联合的药物品种密切相关。本研究未见甲功异常与联合用药存在相关性,推测因方案中的联合药物非上述类别。
本研究中患者TSH基线水平升高与甲功异常的发生呈显著正相关,与多篇文献报道一致[16-17,21],提示PD-1抑制剂治疗后加强TSH基线水平偏高患者的甲功监测意义重大。结果未显示甲状腺自身抗体滴度与甲功异常相关,但中度甲功异常患者相较于轻度抗体异常比例增加(66.67%vs.0.00%),与文献结论相似[14]。尽管多项研究显示自身抗体滴度升高可作为PD-1抑制剂相关甲功异常的预测指标,但机制尚不明确,提示PD-1抑制剂所致甲功异常的潜在机制探索对揭示自身抗体滴度、TSH的预测作用的必要性。
本研究存在一定局限,部分患者因病历资料不详而被排除入组,导致纳入回顾性分析的病例数有限,有待大样本数据进一步验证结果。
综上所述,甲功异常作为卡瑞利珠单抗治疗cHL过程中的常见irAE,应引起关注。临床医师、药师应密切关注患者状态,定期监测甲功水平,若发现异常及时干预,做好预后和随访工作。在做好临床监管的同时,积极探索卡瑞利珠单抗所致甲功异常的危险因素,实现对高危人群的重点监控、早期预警、及时干预,确保用药安全,提高cHL患者生活质量。
