金茵清热口服液通过NF-κB/NLRP3信号通路改善小鼠急性肺损伤*
2024-04-08王淑惠李小兵沈婷雷攀刘泽干杜士明
王淑惠,李小兵,沈婷,雷攀,刘泽干,4,杜士明,,4,5
(1.湖北医药学院药学院,十堰 442000;2.湖北医药学院附属太和医院呼吸与危重症医学科,十堰442000;3.湖北中医药大学药学院,武汉 430065;4.湖北医药学院附属太和医院科研处,十堰 442000;5.武当特色中药研究湖北省重点实验室·湖北医药学院,十堰 442000)
急性肺损伤(acute lung injury,ALI)的发生与创伤、感染等外因相关,其中细菌感染是最常见的危险因素[1]。脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁的主要构成成分,可与特异性结合细胞膜上的Toll样4受体结合,激活核因子κB(nuclear factor kappa-B,NF-κB)和NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)炎性小体表达,产生炎症反应,进一步导致机体体温升高,并伴随肺组织损伤[2]。因此抑制NF-κB/NLRP3信号通路有望成为治疗ALI新的途径[3]。
研究表明,中药治疗肺部疾病疗效显著[4]。十堰市太和医院在经典名方大承气汤和茵陈蒿汤的基础上加减,研制出中药复方金茵清热口服液,获得了医院制剂批准文号(鄂药制字Z20140005)[5]。金茵清热口服液在前期阶段已进行了毒性、稳定性、药效学方面的研究,经临床观察、验证确定该药物用于治疗内毒素血症、急性肝炎、上呼吸道感染引起的高热等炎症性疾病疗效显著。课题组前期研究,金茵清热口服液能显著下调H1N1流感病毒所致炎性因子白细胞介素-1α(interleukin-1α,IL-1α)、白细胞介素-6(interleukin-6,IL-6)及肿瘤坏死因子α(tumor necrosis α,TNF-α)的表达;同时能显著上调干扰素-α(IFN-α)的表达,抑制炎症反应,但其作用的分子机制尚待明确[6-7]。本研究探讨金茵清热口服液通过NF-κB/NLRP3信号通路发挥LPS诱导的急性肺损伤的保护作用。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级C57BL/6J小鼠,雄性6~8周龄,体质量20~25 g,购于湖北医药学院实验动物中心(合格证号:NO:42000900001043),饲养条件:温度23~25℃,相对湿度45%~60%,实验方案通过湖北医药学院实验动物伦理审查(批件号:2019-075)。
1.2药物及试剂 金茵清热口服液(每毫升含原药材1 g,十堰市太和医院自制,批号:NO.20201015);LPS(批号:L2630)购自美国Sigma-aldrich公司;磷酸盐缓冲液(PBS,批号:10010023)购自美国Gibco公司;红细胞裂解液(批号:G2015-250)购自武汉塞维尔生物科技有限公司;BCA蛋白定量试剂盒(批号:P0012)购自碧云天生物技术有限公司;ELISA试剂盒(TNF-α、IL-1β和IL-6,批号:ELM)购自Raybiotech公司;NF-κB抗体(批号:8242s)、p-NF-κB抗体(批号:3033S)、IκB抗体(批号:4812S)和p-IκB抗体(批号:9246s)均购自Cell signaling Technology公司;NLRP3抗体(批号:AG-20B-0014)购自Adipogen Life Sciences公司。
1.3仪器 病理切片机(武汉塞维尔生物科技有限公司,型号:RMR2016);倒置荧光显微镜(日本尼康公司,型号:NIKONECLIPSETI-SR);细胞计数仪(美国Thermo Fisher公司,型号:AMQAF1000);低温超速离心机(德国Eppendorf公司,型号:H1750R,离心半径10 cm)。
1.4动物造模及给药 采用LPS诱导小鼠ALI模型,完全随机法将小鼠分为6组:空白对照组、模型对照组、金茵清热口服液小剂量组、金茵清热口服液中剂量组、金茵清热口服液大剂量组和地塞米松组,每组12只。首先,模型对照组、金茵清热口服液小、中、大剂量组和地塞米松组分别采用气管滴注LPS(5 mg·kg-1,1次),构建小鼠急性肺损伤模型,空白对照组给予气管滴注等体积PBS;气管滴注4 h后,金茵清热口服液小、中、大剂量组(4、8、16 g·kg-1,qd)分别连续灌胃给药3 d,地塞米松组(5 mg·kg-1,qd)连续腹腔注射给药3 d,同时空白对照组和模型对照组分别连续灌胃等体积0.9%氯化钠溶液3 d,次日,6组小鼠分别取肺组织(每组6只)和支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)(每组6只)进行相应检测。
1.5苏木精-伊红(HE)染色观察小鼠肺组织病理损伤的变化 每组收集6只小鼠左侧肺组织,分别固定在10%甲醛溶液中,经90%、80%、70%浓度乙醇脱水、石蜡包埋和切片(厚度5 μm),进行HE染色,切片于光学显微镜下观察,参照KULKARNI等[8]的方法进行肺损伤程度定量评分。
1.6BALF总细胞数、总蛋白含量和TNF-α、IL-6、IL-1β和IgM的表达 每组取6只小鼠BALF,在4 ℃下3 000 r·min-1(r=32 mm)离心15 min,分别收集沉淀细胞和上清液,沉淀细胞加入红细胞裂解液6 mL反应15 min,重复数次直至红细胞完全除去,重悬沉淀细胞,采用细胞自动计数仪进行总细胞计数;上清液分别按照BCA和ELISA试剂盒检测各组BALF中总蛋白含量和TNF-α、IL-6、IL-1β和IgM的含量。
1.7Western blotting法检测 小鼠肺组织p-NF-κB/NF-κB、p-IκB/IκB和NLRP3/β-actin蛋白表达 每组收集3只小鼠右侧肺组织,分别称取15.00 mg,加入300 μL蛋白裂解液,充分研磨,在4 ℃下离心12 000 r·min-1(r=32 mm)15 min后,收集上清液,加入蛋白上样缓冲液,在100 ℃变性5 min,BCA法检测蛋白浓度。蛋白样品(上样量30 μg)通过10%聚丙烯酰胺凝胶电泳(80 V)分离2 h,半干转(恒压18 V,60~70 min)至PVDF膜上,5 %牛奶封闭2 h,随后在4 ℃下NF-κB(1:1 000)、p-NF-κB(1:1 000)、IκB(1:1 000)、p-IκB(1:1 000)和NLRP3(1:1 000)过夜,TBST洗膜30 min,室温孵育二抗1 h,TBST洗膜30 min,最后采用ECL法显影,Image J定量分析目的蛋白条带。
1.8免疫组化检测小鼠肺组织NF-κB、NLRP3蛋白表达 每组取6只肺组织石蜡切片,加入抗原修复、血清封闭20 min,4 ℃下孵育NF-κB(1:1 000)、NLRP3(1:2 000)抗体过夜,洗涤3次,并于37 ℃下孵育二抗1 h,DAB溶液显色,最后苏木精复染细胞核、脱水、透明、封片,Image J分析肺组织NF-κB、NLRP3蛋白的表达。
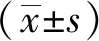
2 结果
2.1各组小鼠肺组织病理学的比较 与空白对照组比较,模型对照组小鼠的肺组织表现出明显的病理损伤,肺泡间隔增厚,炎性细胞浸润(P<0.01);与模型对照组比较,给予金茵清热口服液(4、8、16 g·kg-1)治疗后,肺病理学损伤逐渐减轻(P<0.01),肺泡结构恢复,炎性细胞浸润情况减轻,肺组织损伤减轻,其作用效果接近地塞米松组,见图1。
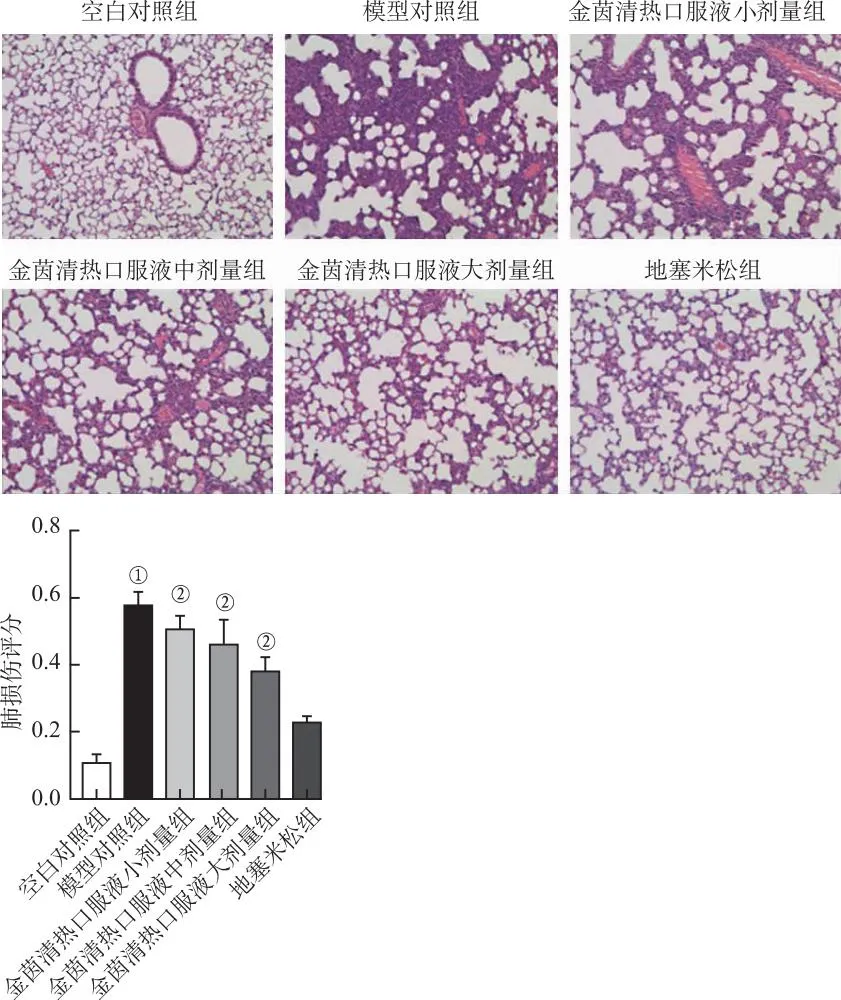
①空白对照组比较,t=27.69,P<0.01;②与模型对照组比较,t=3.571~9.522,P<0.01。
2.2各组小鼠BALF炎性渗出的比较 与空白对照组比较,模型对照组小鼠肺泡灌洗液中总细胞数、总蛋白和IgM含量显著升高,炎性蛋白渗出(P<0.01);与模型对照组比较,给予金茵清热口服液(4、8、16 g·kg-1)治疗后,BALF中总细胞数量、总蛋白和IgM含量逐渐减低,炎性蛋白渗出减少(P<0.01),其作用效果接近于地塞米松组,见表1。
表1 各组小鼠BALF炎性渗出的比较
2.3各组小鼠BALF中IL-1β、IL-6、TNF-α的比较 与空白对照组比较,模型对照组小鼠肺泡灌洗液炎性细胞因子TNF-α、IL-1β和IL-6含量显著升高(P<0.01);与模型对照组比较,给予金茵清热口服液(4、8、16 g·kg-1)治疗后,BALF中TNF-α、IL-1β和IL-6含量逐渐降低(P<0.05),其作用效果接近于地塞米松组,见表2。

表2 各组小鼠BALF中IL-1β、IL-6、TNF-α的比较
2.4各组小鼠肺组织NF-κB/NLRP3信号通路蛋白表达 与空白对照组比较,模型对照组小鼠肺组织中p-NF-κB/NF-κB、p-IκB/IκB和NLRP3/β-actin蛋白的表达显著升高(P<0.01);与模型对照组比较,给予金茵清热口服液(16 g·kg-1)治疗后,肺组织中p-NF-κB/NF-κB、p-IκB/Iκ和NLRP3/β-actin蛋白表达显著降低(P<0.05)。见图2。

①与空白对照组比较,t=7.339~10.75,P<0.01;②与模型对照组比较,t=3.532~6.461,P<0.05。
2.5各组小鼠肺组织NF-κB、NLRP3免疫组化结果 与空白对照组比较,模型对照组小鼠肺组织NF-κB、NLRP3蛋白在细胞核和细胞质中的表达升高(P<0.01);与模型对照组比较,给予金茵清热口服液(16 g·kg-1)治疗后,肺组织中NLRP3蛋白表达降低(P<0.01)。见图3。
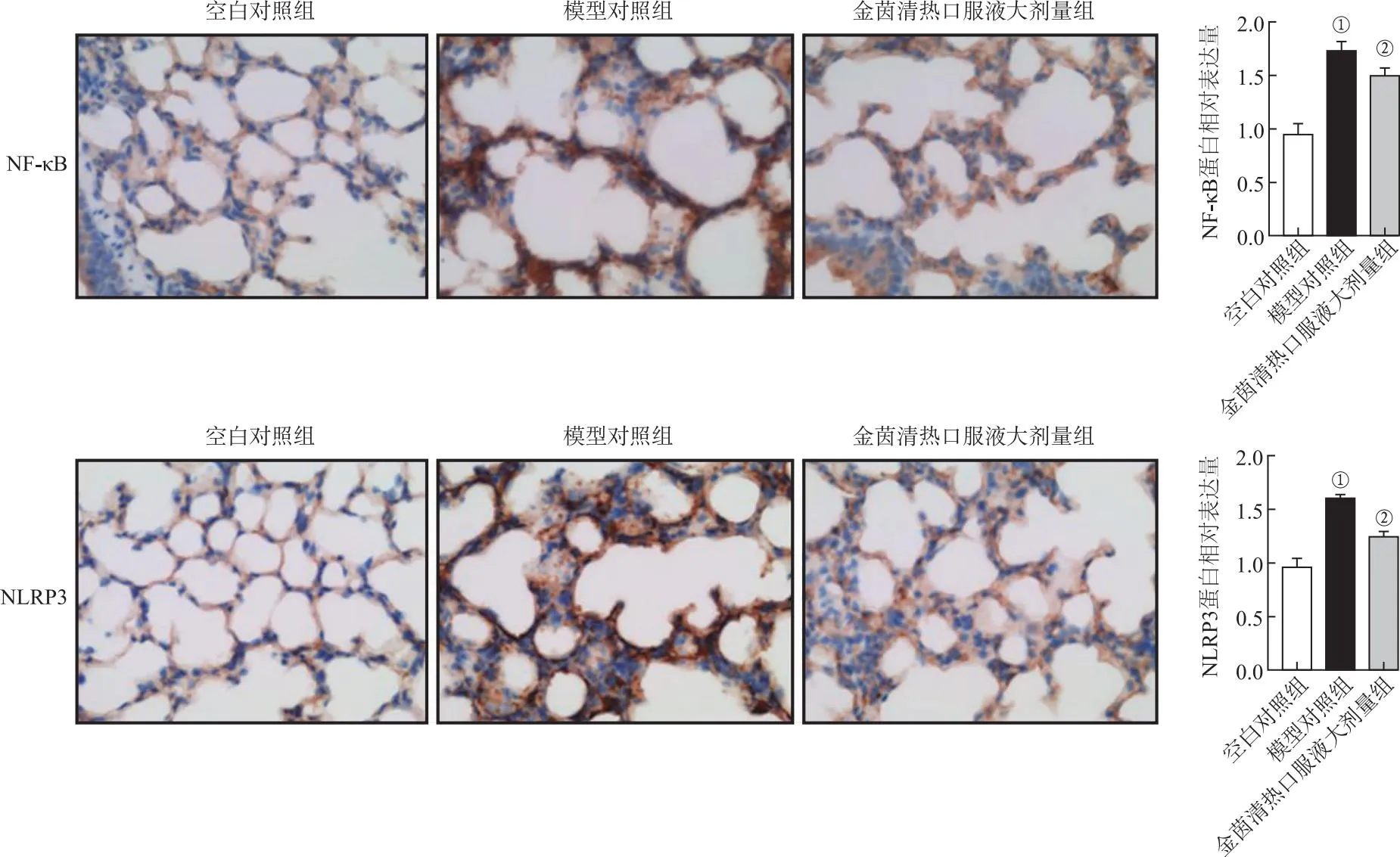
①与空白对照组比较,t=16.16~17.17,P<0.01;②与模型对照组比较,t=6.082~13.47,P<0.01。
3 讨论
ALI是一种常见呼吸系统临床综合征,临床表现主要为进行性低氧血症和呼吸窘迫[9]。流行病学调查,在全球范围内,ALI在重症监护患者的发病率达10%,死亡率达50%[10]。药物治疗(如糖皮质激素、沙丁胺醇)在临床实验中无法得到有效支持,且存在耐药、骨质疏松等副作用[11]。研究表明,中药治疗肺部疾病效果显著,且历史悠久。ZHANG等[12]研究清瘟止咳治疗LPS诱导ALI的作用机制可能是通过抑制TLR4/NF-kB信号通路与NLRP3炎症小体激活。王瑞哲等[13]研究大承气汤降低大鼠肺泡巨噬细胞、人支气管上皮细胞中炎症相关蛋白NF-κB的表达,减轻肺部炎症损伤,改善肺损伤。
金茵清热口服液由金银花、茵陈、大黄、栀子、连翘、黄芪、丹参、甘草8味中药组成[6]。茵陈、黄芪是金茵清热口服液的君药,治疗炎症相关疾病如胆囊炎[14]、动脉粥样硬化[15]等。丹酚酸B、绿原酸、黄芩苷和大黄素等是金茵清热口服液主要药效成分,丹酚酸B通过抑制NF-κB的激活减轻LPS诱导的小鼠ALI[16];绿原酸通过抑制NLRP3炎性小体的激活改善肺炎克雷伯菌所致的小鼠肺炎[17];黄芩苷、大黄素联合治疗DSS诱导的小鼠结肠炎通过TLR4/NF-κB信号通路发挥协同作用[18]等,这提示金茵清热口服液具有抗炎作用。本研究构建了LPS诱导的小鼠ALI模型,给予金茵清热口服液小、中、大剂量治疗后减轻了小鼠肺组织病理损伤,降低了肺泡灌洗液中炎性渗出和细胞因子IL-1β、IL-6及TNF-α的表达,说明金茵清热口服液对LPS诱导的小鼠ALI具有保护作用,可减轻小鼠ALI的炎症反应。
研究表明,NF-κB/NLRP3信号通路在ALI等炎症相关疾病中发挥关键作用[19]。生理条件下,在细胞质内,NF-κB的异二聚体和IκB以非活性形式相结合;当外界刺激信号出现时,IκB迅速降解,使NF-κB二聚体进入细胞核,促进NLRP3炎症小体的组装,进一步调节炎症细胞、细胞因子和炎症介质的表达[20]。YANG等[21]研究,东凌草素通过抑制NF-κB/NLRP3信号通路的激活,发挥抗炎作用,对小鼠急性肺损伤发挥保护作用。因此,通过NF-κB/NLRP3信号通路有望成为治疗ALI新的途径。实验结果金茵清热口服液能抑制肺组织p-NF-κB/NF-κB、p-IκB/IκB和NLRP3/β-actin蛋白的表达,说明金茵清热口服液的肺保护作用与NF-κB/NLRP3信号通路密切相关。
综上所述,金茵清热口服能降低LPS诱导的小鼠ALI中炎症因子的水平,改善肺部病理损伤和炎性渗出,其作用机制可能通过调控NF-κB/NLRP3信号通路,但是本实验未探究金茵清热口服液有效成分的协同作用,后期将进行深入研究,为其临床用于治疗ALI提供理论依据。
