祖卡木颗粒对低氧性肺动脉高压的药效及机制研究*
2024-04-08刘芮绮袁天翊王冉冉郑瑞芳龚迪菲王守宝邢建国杜冠华方莲花
刘芮绮,袁天翊,王冉冉,郑瑞芳,龚迪菲,王守宝,,邢建国,杜冠华,方莲花
(1.中国医学科学院,北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;2.中国医学科学院,北京协和医学院药物研究所,药物靶点研究与新药筛选北京市重点实验室,北京 100050;3.新疆药物研究所新疆维吾尔药重点实验室,乌鲁木齐 830004)
肺动脉高压(pulmonary hypertension,PH)是一种由于肺血管阻力增加,肺动脉压力上升导致的病理生理障碍,其诊断标准为在海平面静息状态(不同的海拔高度可以换算为海平面),通过右心导管测量的平均肺动脉压(mPAP)≥ 25 mmHg(1 mmHg=0.133 kPa)[1]。PH的病因和发病机制复杂多样,与许多个体和环境因素有关,通常导致肺血管收缩、肺血管平滑肌异常增生和肺血管重构,最终导致右心衰竭甚至死亡[2]。
目前根据不同的发病机制可将PH分为5类,其中第三类低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是由缺氧和肺部疾病导致的PH[3],主要包括慢性阻塞性肺疾病、特发性肺纤维化、特发性间质性肺炎、合并肺纤维化和肺气肿、结节病、阻塞性睡眠呼吸暂停和高海拔导致的低通气和缺氧相关的PH等[4]。在众多刺激因素中,缺氧在HPH的产生与发展中起重要作用。通常由于高海拔或慢性缺氧肺疾病等导致缺氧,进而导致肺血管收缩,激活缺氧敏感的炎症反应和增殖途径以及肺实质的重塑和破坏[2]。病理特征包括内皮细胞功能障碍、信号传导异常、多细胞和血管的异常增生等[5]。这一过程导致更持续的血管阻力,引起右心室压力升高及右心衰竭[6]。目前临床治疗方案包括靶向血管收缩和增殖的信号通路,但仅能缓解症状,很难逆转右心室重构,因此寻找新的潜在治疗药物具有重要意义[7]。
祖卡木颗粒(Zukamugranules)作为一种维吾尔族的特色民族药,具有调节异常气质及清热、发汗、通窍等功效,用于治疗感冒咳嗽、发热无汗、咽喉肿痛、鼻塞流涕等[8]。近年来对于其治疗新型冠状病毒肺炎等肺损伤疾病的研究提示,祖卡颗粒对于肺部具有一定的保护和抗炎治疗作用[9],生物信息学研究亦显示祖卡木复方可调控多条炎症相关信号通路[10-12]。因此本文研究其对于肺动脉高压的潜在防治作用,并开展了生物信息学研究、药效学验证以及其作用机制的探究。
1 材料与方法
1.1祖卡木主要成分筛选及靶点获取 根据祖卡木
颗粒配方:山柰、睡莲花、破布木果、薄荷、大枣、洋甘菊、甘草、蜀葵子、大黄、罂粟壳。通过Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP,http://old.tcmsp-e.com/tcmsp.php)和Traditional Chinese Medicines Integrated Database(TCMID,https://ngdc.cncb.ac.cn/databasecommons/database)两个数据库检索收集全部主要成分[13-14]。口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)是评价化合物在药物代谢过程中的重要参数,活性化合物的选择参数设置为OB>30%,DL>0.18。其中,洋甘菊[15-16]、破布木果[17]和蜀葵子[18]的个别成分通过文献中获得,并利用TCMSP数据库及PubChem数据库检索获得化合物的SMILES号。基于结构相似性原理在SwissTargetPrediction数据库中检索化合物可能性大于0.1的靶点(http://www.swisstargetprediction.ch/)[19]。
1.2肺动脉高压疾病相关靶点获取 以“低氧性肺动脉高压”为关键词在DisGeNET数据库(http://www.disgenet.org)和GeneCards数据库(https://www.genecards.org)中进行检索[20-21],并去除其中的重复基因,筛选评分大于10的靶点。将活性成分靶点与HPH相关靶点的交集作为祖卡木颗粒治疗HPH的潜在靶点[22]。
1.3中药-活性成分-关键靶点-疾病网络和靶点-通路网络构建 使用Cytoscape 3.9.1进行网络可视化分析节点的度值、中心性、平均最短路径等拓扑参数,并分析其中的主要节点信息。
1.4蛋白相互作用(protein-protein interaction,PPI)网络构建 使用STRING数据库(https://www.string-db.org/)通过蛋白质之间的直接的物理相互作用和间接的功能相关性构建祖卡木颗粒潜在靶点之间的交互关系网络[23]。
1.5基因本体(gene ontology,GO)和京者基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析 使用The Database for Annotation,Visualization,and Integrated Discovery (DAVID,https://david.ncifcrf.gov/home.jsp,ver.6.8)数据库进行分析[24]。将主要成分与疾病相关的交集基因输入,选择物种为“人类”并分别进行生物过程、分子功能、细胞组成和KEGG途径富集分析。将P值最小的前20项及其参数上传到微生信(bioinformatics.com.cn)在线平台中进行进一步的可视化分析。
1.6实验验证
1.6.1实验动物 无特定病原体(SPF)级雄性C57BL16小鼠64只,体质量约20~22 g,购自斯贝福(北京)生物技术有限公司。实验动物于中国医学科学院药物研究所动物饲养中心饲养,恒温(24~26 ℃)、恒湿(相对湿度30%~40%)环境,自由摄食饮水,适应性饲养3 d后进行实验。实验动物生产许可证号SCXK(京)2019-0010,实验动物使用许可证号SYXK(京)2019-0023,实验动物伦理编号00004971。针对动物的所有实验条件和实验操作均符合中国医学科学院药物研究所动物伦理委员会指导原则。
1.6.2药品与试剂 西地那非(美国Selleck公司,纯度:99.5%),以0.5%羧甲基纤维素钠(CMC-Na)溶液配制成10 mg·mL-1混悬液;祖卡木颗粒(新疆银朵兰药业股份有限公司,生产批号:211214),以温水配制成540 mg· mL-1溶液;Su5416(美国MCE公司,纯度:99.96%),使用时将Su5416用二甲亚砜(DMSO,5%)+PEG300(40%)+聚山梨酯80(Tween80,5%)+超纯水(50%)混合溶剂配制成2 mg·mL-1溶液;其他试剂均为国产分析纯。
1.6.3仪器与设备 BL420S生物机能试验系统(成都泰盟科技有限公司);Millar微型压力导管(美国MILLAR公司,r=82 mm);高速冷冻离心机(美国Beckman公司,Allegra X-22R,r=82 mm);SpectraMaxM5酶标仪(美国MolecularDevices公司);Attendor 140 Pro低氧舱(广州华粤行公司)。
1.6.4单纯低氧两周预防给药实验 在单纯低氧两周预防给药模型中,将32只小鼠随机分为正常对照组、模型对照组、西地那非组及祖卡木组,实验方案如图1所示。祖卡木组灌胃给予祖卡木颗粒混悬液5.4 g· kg-1,西地那非组灌胃给予西地那非溶液0.1 g· kg-1,正常对照组、模型对照组均灌胃给予等体积相应溶剂。动物适应性饲养后,预防给药3 d,每日1次。此后除正常对照组饲养在常氧环境中外,其余3组置低氧舱饲养2周,氧含量10%,期间每日给药1次。使用模型为低氧诱导的肺动脉高压经典模型[25],给药剂量由祖卡木颗粒说明书剂量换算得小鼠剂量。
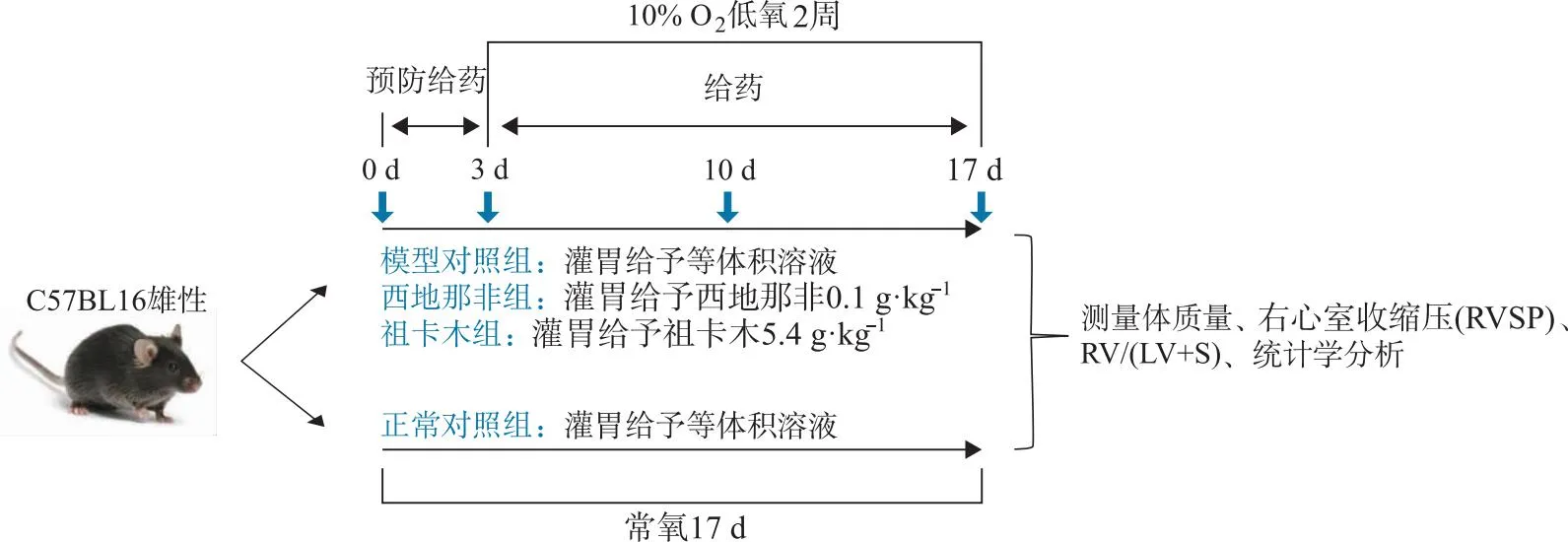
图1 单纯低氧2周预防给药实验方案
1.6.5低氧4周+Su5416治疗给药实验 分组及给药剂量同“1.6.4节”。如图2所示,动物适应性饲养3 d后,除正常组饲养在常氧环境中,其余3组置低氧舱饲养4周,氧含量10%,前2周每周皮下注射Su5416(20 mg· kg-1)1次。第3周起每日给药1次。
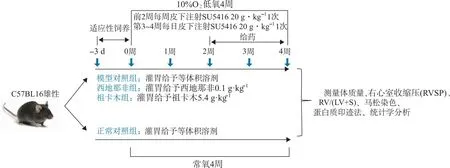
图2 低氧4周+Su5416治疗给药实验方案
1.6.6称重观察 实验过程中观察小鼠状态和死亡情况,记录体质量等指标。
1.6.7实验动物处理 实验终点时用异氟烷麻醉小鼠,通过米勒导管测量右心室收缩压(right ventricular systolic pressure,RVSP)并通过腹主动脉取血。将小鼠由腹部剪开至胸腔,打开胸腔暴露心脏,针头由右心室心尖进入,用0.9%氯化钠溶液进行灌注至灌洗液无明显红色、器官泛白为止。取小鼠心、肝、脾、肺、肾,用0.9%氯化钠溶液冲洗干净,滤纸吸干水分,分析天平称质量,脏器指数(%)=脏器质量/小鼠体质量×100%。沿心耳下缘将整个心室从心脏上剪下,沿心室间隔边缘剪下右心室,称量右心室(right ventricular,RV)及左心室加室间隔(left ventricular+septum,LV+S)质量,计算RV/(LV+S),确定有无右心室肥厚。
1.6.8Masson染色观察病理损伤情况 分离小鼠左肺,立即用盐水冲洗,然后在4%多聚甲醛中固定24 h。在脱水和清除后,将肺包埋在石蜡中。石蜡包埋的组织用Masson染色。在光学显微镜下观察切片的形态变化,获得显微照片。
1.6.9蛋白质印迹法(Western blotting,WB)检测蛋白表达 将小鼠肺组织剪碎并在冰上研磨,收集组织在1.5 mL离心管内,加入适量RIPA裂解液,经组织匀浆和超声处理后置于冰上继续裂解直至裂解完全,经4℃12 000 r·min-1离心20 min取上清。采用BCA蛋白浓度检测法进行总蛋白定量。取总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,转膜2 h,将蛋白转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜。PVDF膜浸泡于5%脱脂牛奶(TBST配制)室温下封闭2 h。以Bcl-2-相关X蛋白质(Bcl-Associated X,Bax)(1:1 000)、B淋巴细胞瘤-2基因(B-cell lymphoma,Bcl-2)(1:1000)、内皮型一氧化氮合酶(endothelial nitric oxidase synthase,eNOS)(1:1 000)、低氧诱导因子-1α亚基(hypoxia inducible factor-1α,HIF-1α)(1:1 000)、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)(1:1 000)、兔抗p-PI3K(1:1 000)、鼠抗β-actin(1:1 000)抗体进行孵育,4 ℃过夜。洗膜后,二抗与PVDF膜于室温下作用2 h,再次洗膜。将发光液A和B等量混匀,在PVDF膜上滴加适量的ECL发光试剂,室温下作用1 min,并使用全自动化学发光分析仪进行检测。
1.7统计学方法 采用GraphPad Prism9.5版软件作图,one-way ANOVA进行数据统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1祖卡木颗粒活性成分和靶点的筛选 根据OB和DL等化合物的性质,从10种草药中筛选出主要成分167个。其中山奈酚、柚皮苷、芦荟大黄素、木犀草苷、光千金藤碱、蓝堇碱、儿茶素、槲皮素、4-羟基苯甲酸、丁香酸同时存在于多种草本植物中。基于结构相似性预测可能性>0.1的靶点897个,低氧性肺动脉高压疾病靶点去重后筛选评分>10的靶点701个,取交集后共同靶点179个。见图3。

图3 祖卡木颗粒主要活性成分靶点、HPH疾病靶点和共同靶点
2.2祖卡木颗粒中抗HPH相关成分与靶点的相互作用分析 利用Cytoscape软件构建了化合物-靶点网络图。如图4所示,网络由356个节点(主要成分10个、化合物167个和HPH相关靶点179个)和3 365个相互作用组成。外圈代表祖卡木处方中的各药物及其主要成分,中间蓝色矩形表示通过文献及预测的祖卡木与HPH的共同靶点,连线表示其相互作用,节点越大、颜色越深表示该节点度值越大。结果表明,网络中度参数较高的化合物包括山奈酚、木犀草苷、槲皮素、芦荟大黄素、7-甲氧基-2-甲基异黄酮等,这些化合物可能在祖卡木的抗HPH作用中发挥更重要的作用。
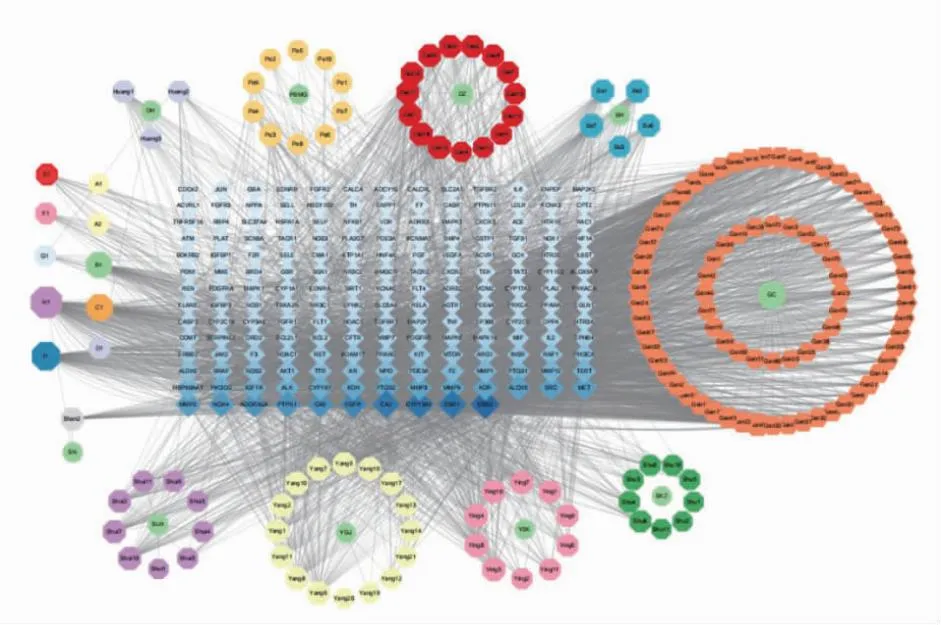
图4 祖卡木药物-主要成分-靶点网络图
2.3构建PPI与分析网络 度值是指连接的链接数与相邻节点数,是反应节点在网络中重要性的拓扑参数。使用STRING工具构建了祖卡木颗粒治疗HPH的潜在靶点PPI网络,节点代表靶点,边表示PPI的相互作用,节点的颜色强度与网络中的度值成正比。如图5所示,PI3KCA等关键靶点与其他靶点的相互联系更强,也参与多种信号通路,可能在祖卡木的抗HPH作用中发挥更关键的作用。

图5 祖卡木对HPH潜在靶点构建PPI的网络生物学分析
2.4GO分析 利用DAVID平台对祖卡木治疗HPH中的潜在靶点进行富集分析,包括这些靶点参与的生物过程、分子功能、细胞组成KEGG途径富集分析。点的大小表示富集目标的数量,点的颜色代表基于P值的显著性程度。如图6-A所示,潜在的治疗靶点参与多个生物过程,包括“低氧反应”“药物反应”“激素反应”;包括“血浆组成”“膜筏”在内的细胞组成(图6-B)以及“酶结合”“激酶活性”在内的分子功能(图6-C),提示低氧过程可能是疾病进展的重要因素。
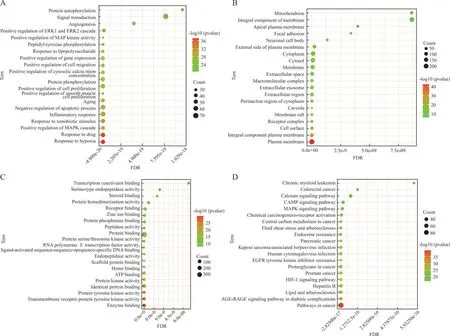
A.生物过程;B.细胞成分;C.分子功能;D.KEGG分析图。
2.5KEGG分析 为了进一步阐述靶点和通路之间的关系,使用KEGG数据库和KEGG Mapper在线工具进行通路富集分析。颜色深浅表示不同的P值(P<0.05),而圆圈的大小表示数目。结果显示,这些靶点主要参与增殖相关通路等(图6-D)。
2.6实验验证结果
2.6.1单纯低氧两周预防给药模型药效学评价 实验中观察到模型对照组小鼠与正常对照组比较欠活泼,精神萎靡。如图7-A所示,预防给药阶段3组小鼠的体质量均呈逐渐增加,其中祖卡木组的上升趋势最为明显。进入低氧环境后,3组小鼠体质量均明显降低。与模型对照组比较,西地那非与祖卡木对体质量无明显改善。
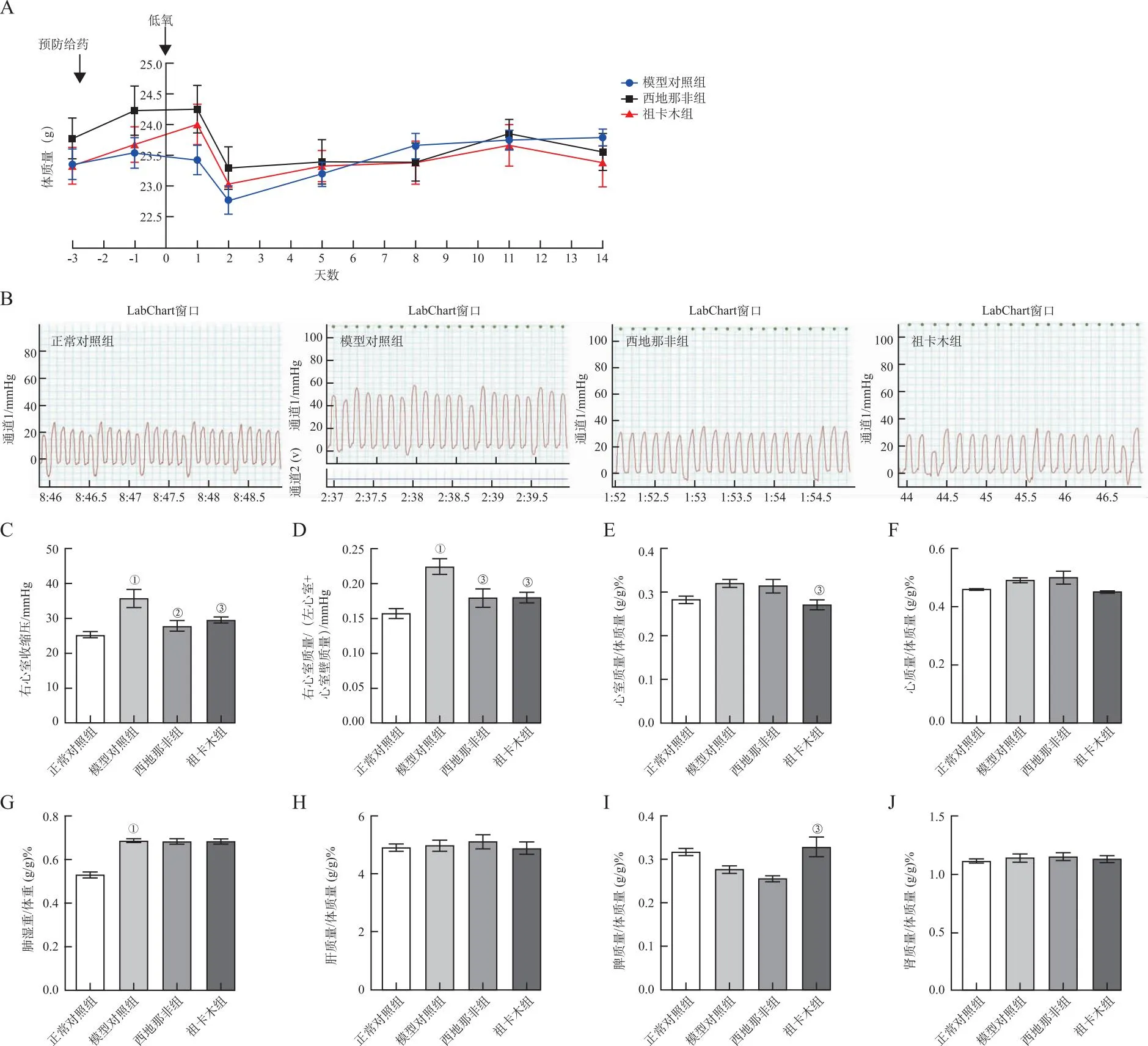
①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05。
RVSP是检测肺动脉高压的金指标[26]。如图7-B及7-C所示,与正常对照组比较,模型对照组小鼠RVSP显著升高(35.79 mmHgvs.25.43 mmHg,P<0.01)。与模型对照组比较,西地那非组(27.90 mmHgvs.35.79 mmHg,P<0.01)与祖卡木组(29.78 mmHgvs.35.79 mmHg,P<0.05)RVSP均显著下降。小鼠的右心室指数和心脏指数是评价心室重构的重要指标。与正常对照组比较,模型对照组右心室指数显著增加(P<0.01),模型对照组西地那非组与祖卡木组比模型对照组显著降低(P<0.05)。与正常对照组比较,模型对照组和西地那非组的心脏指数(图7-F)和心室指数(图7-E)有轻微增加,而祖卡木组轻微下降,但差异无统计学意义。
不同脏器指数可以作为评价药物调节作用的重要指标。肺指数通常可代表肺性病变的严重程度,由于炎性渗出等原因使肺重量增大,肺指数越大提示肺病变越严重。如图7-G至7-J显示,与正常对照组比较,模型对照组的肺指数显著升高(P<0.02)。与模型对照组比较,西地那非组与祖卡木组的肺指数仅轻微降低,无明显变化。脾脏是体内免疫的中枢,西地那非组与正常对照组比较脾指数明显降低,而祖卡木组比西地那非组明显升高。肝指数与肾指数均无明显影响。
2.6.2低氧4周+Su5416治疗给药模型药效学评价 如图8-A所示,当对模型对照组、西地那非组和祖卡木组进行低氧加皮下注射Su5416后,3组小鼠体质量明显下降。给药后祖卡木组体质量水平与其他两组比较上升趋势最为明显。

①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05。
将小鼠肺组织固定、包埋、切片,Masson染色法观察肺组织尤其是肺动脉血管病理变化(图8-C)。与正常对照组比较,模型对照组小鼠肺血管明显增厚(P<0.01),西地那非组和祖卡木组肺部病理状态有所改善(P<0.01)。
如图8-B及8-E所示,与正常对照组比较,模型对照组小鼠RVSP显著升高(29.07 mmHgvs.22.18 mmHg,P<0.01)。与模型对照组比较,西地那非组与祖卡木组RVSP均显著下降(25.84 mmHgvs.29.07 mmHg,22.93 mmHgvs.29.07 mmHg,P<0.01),提示两者对肺动脉高压均有一定治疗效果,且祖卡木效果优于阳性药西地那非。与正常对照组比较,模型对照组右心室指数显著上升(P<0.01),右心室指数祖卡木组与模型对照组比较,显著下降(P<0.05),提示祖卡木对于减缓肺高压引起的右心室重构有一定作用。与模型对照组比较,西地那非组右心室指数也有一定降低(图8-F)。对于心重指数和心室指数,4组均无明显统计学差异(图8-G及8-H)。
图8-I至8-L显示,与正常对照组比较,其余3组的肺指数显著升高;与模型对照组比较,祖卡木组的肺指数有所降低。而对于脾指数,与正常对照组比较,模型对照组脾指数明显降低,西地那非组与祖卡木组均有所回升。
2.6.3祖卡木下调肺组织中Bcl-2的表达并上调Bax的表达 为了探讨祖卡木对缺氧诱导的血管重构保护作用的可能机制,本研究检测了肺组织中Bcl-2以及Bax的蛋白水平。结果表明,缺氧可上调Bcl-2的表达(P<0.05)并下调Bax的表达(P<0.01),而西地那非和祖卡木可以有效逆转这一情况(P<0.05),见图9。
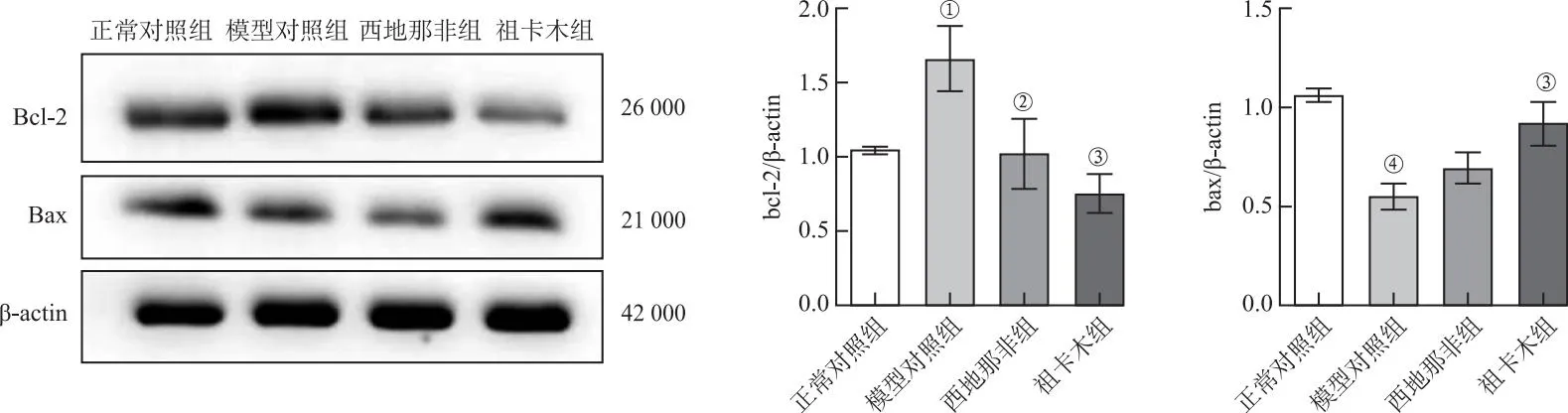
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05;③与模型对照组比较,P<0.01;④与正常对照组比较,P<0.01。
2.6.4祖卡木上调肺组织中PI3K及eNOS的表达并降低HIF-1α的表达 PI3K是具有磷脂酰肌醇激酶活性的二聚体,由调节亚基p85和催化亚基p110组成[27]。NOS分为三类:内皮型NOS (endothelial NOS,eNOS )、诱导型NOS(inducible NOS,iNOS)、神经元型NOS(neuronal NOS,nNOS)。实验使用Western blotting方法检测了小鼠肺组织中PI3K亚基p85、磷酸化p85、eNOS及HIF-1α的蛋白表达水平。图10所示,与正常对照组比较,模型对照组p85、p-p85及eNOS的蛋白表达水平显著下调,HIF-1α的表达显著上调(P<0.01)。西地那非和祖卡木均可以显著上调p85、p-p85及eNOS的表达水平并下调HIF-1α的表达(P<0.01)。
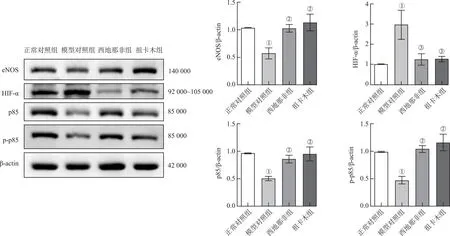
①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05。
3 讨论
祖卡木颗粒作为我国民族药的重要瑰宝,在治疗上呼吸道疾病以及急性肺损伤等疾病中发挥了重要作用。既往研究主要集中在其对于呼吸道感染及肺部疾病的抗炎和免疫治疗作用,而缺乏对于HPH的防治研究及其可能机制的探讨[28-29]。本研究首先通过网络药理学分析手段对祖卡木颗粒中的主要生物活性化合物、潜在靶点和信号通路进行分析,预测其可能的分子作用机制,并在动物体内进行预防及治疗实验药效的初步验证,最后通过分子生物学分析验证其发挥作用的潜在信号通路,首次发现了祖卡木颗粒对于HPH的防治作用。
本研究通过网络药理学构建了多组分和多靶点网络图,更好地阐明了疾病和药物相关的基因靶点相互关系。通过PPI富集结果分析发现PIK3CA、HIF-1等基因可能是祖卡木颗粒作用的关键靶点。PIK3CA的激活突变在许多疾病中常见,导致PI3K活性增加、下游信号转导增强、细胞增殖和肿瘤生长[30]。此外,GO和KEGG分析预测祖卡木颗粒的潜在作用机制可能与低氧及增殖相关信号通路有关,为后续实验验证及信号通路的选择提供了理论依据。
研究发现,PI3K可以调控HIF-1α的表达,缺氧诱导因子作为肺缺氧反应的重要调节因子,与HPH的发病机制相关[31]。HIF-1α可进一步调节参与糖代谢和血管生成的下游蛋白的表达,如血管内皮生长因子等。缺氧条件启动HIF-α亚基与HIF-β亚基的核转位和结合,而激活的HIF通过诱导或抑制广泛的基因参与调节血管张力、血管生成、红细胞生成、细胞代谢、增殖、存活和自噬反应,从而启动对缺氧的适应性反应,因此在PH病理状态下HIF-α表达量增高[32]。
此外,PI3K属于脂质激酶家族,其特点是能够磷酸化质膜中肌醇磷脂中的肌醇环3'-OH基团[33]。eNOS是内皮细胞合成NO所必需,PI3K-eNOS信号通路在各种细胞迁移增殖、炎症反应和氧化应激的调节中起着重要作用,且eNOS受PI3K的调控。HIF-1α被认为与氧水平密切相关并激活PI3K通路,而NO在无氧情况下有助于HIF-1α的稳定[34]。在包括木樨草素、桔梗汤、丹参酮IIA等多种复方药物及天然产物对于PH及其他肺部疾病的研究中发现PI3K/Akt-eNOS及HIF-Arg-NO途径是药物发挥作用的关键通路[35-37]。
肺动脉重塑与肺动脉平滑肌细胞过度增殖和凋亡抑制有关,eNOS也被证明通过抑制促凋亡蛋白在细胞增殖和凋亡中发挥重要作用[34]。细胞凋亡是在生理或病理条件下细胞自发死亡的过程,在细胞发育和分化过程中发挥重要作用[38]。其中Bcl-2是一种重要的抗凋亡蛋白,而Bax是一种促凋亡蛋白,增强线粒体凋亡通路,抑制肺动脉平滑肌细胞增殖可以改善PH[39],也是许多针对PH中血管增殖重构的药物研究的经典通路[40]。根据生物信息学分析的结果,预测祖卡木治疗肺高压的潜在靶点可能与缺氧及增殖相关通路最为密切,且PI3K可能作为一个核心靶点。因此我们选择PI3K作为核心靶点,探究其下游两个通路(HIF-1α及eNOS)以及增殖相关通路Bax/Bcl进行进一步验证。
本研究选择单纯低氧2周与低氧4周+Su5416 2个动物模型进行药效学探究。单纯低氧2周小鼠模型可模拟突发性低氧所致机体障碍,是快速评价治疗HPH药物效果的首选模型,因此选择其作为药效初筛模型。Su5416是一种血管新生抑制剂,能抑制低氧所致肺血管新生,低氧合并Su5416模型可加重小鼠肺血管损伤,与临床患者病理表现相近,可作为长期药效评价模型[25]。在2个模型中均验证了祖卡木颗粒对于HPH的预防及治疗作用,其可以显著降低RVSP,明显减轻小鼠右心室肥厚,效果优于阳性药西地那非。
为了探究祖卡木颗粒对HPH治疗作用的分子机制,本研究检测了肺组织中相关信号通路的变化。研究结果显示,祖卡木可下调肺组织中Bcl-2的表达并上调Bax的表达,提示祖卡木可能通过抑制细胞的增殖发挥治疗作用,此外可上调肺组织中PI3K及eNOS的表达并降低HIF-1α的表达,提示激活PI3K-eNOS及抑制HIF-1α信号通路可能是祖卡木发挥治疗作用的潜在机制。本研究可以为祖卡木颗粒的基础研究以及临床应用提供思路和拓展,也为HPH的临床治疗提供潜在的治疗药物。但目前这些结果只是祖卡木颗粒作用机制的线索,后续还应采用Bax/Bcl及PI3K/Akt抑制剂等对该通路进行干预以确证祖卡木颗粒的作用机制。
综上所述,论文通过网络药理学手段分析预测了民族药祖卡木颗粒治疗HPH的作用靶点,并通过两种实验动物模型进行了药效学验证及分子生物学分析。首次揭示了祖卡木颗粒可能通过Bax/Bcl及PI3K-eNOS/HIF-1α通路对HPH起到治疗作用,为后续开发新的治疗药物及拓展祖卡木颗粒适应证提供了新的选择。
