褐藻聚合酚下调TGF-β1/Smads信号通路抑制大肠癌细胞增殖与侵袭*
2024-04-08李红董玮侯杰贺德
李红,董玮,侯杰,贺德
(深圳市宝安区人民医院普通外科,深圳 518000)
流行病学结果显示,大肠癌(主要包括结肠癌和直肠癌)的发病率居消化道恶性肿瘤第二位,严重威胁着我国居民的生命健康[1-2]。随着生命科学、医学技术的高速发展,以及个体化靶向干预手段在临床应用的推广,极大地提高了患者的生命质量,其中天然药物尤其源自海洋的海洋藻类植物成为国内外众多研究学者的研究热点[3]。LI 等[4]研究报道褐藻中多酚类具有明显的抗氧化、抗炎性以及抗肿瘤增殖等药理活性。BLESSIE等[5]研究显示海洋褐藻的提取物能明显抑制肝癌HepG2细胞的增殖。转化生长因子β1(transforming growth factor-β1,TGF-β1)及母体抗生物皮肤生长因子同源物2/3(mothers against decapentaplegic homolog 2/3,Smad2/3)信号是一条内源性的与肿瘤发生、发展关系密切的通路[6]。研究显示该信号在胃癌、食管癌等消化道恶性肿瘤中表达异常,并且异常表达的TGF-β1直接增强Smad2/3的磷酸化,增强癌细胞的增殖与侵袭能力[7]。PEREZ等[8]研究显示在结肠炎相关的结肠癌小鼠中,抑制TGF-β1信号能明显降低模型动物中结肠的成瘤数目。本研究以结肠癌细胞HT29为研究对象,从TGF-β1/ Smads信号入手,探讨海洋褐藻的主要组分褐藻聚合酚(phlorofucofuroeckol A,PFFE-A)对肿瘤细胞的体内外增殖与侵袭的影响。
1 材料和方法
1.1细胞、动物及主要试剂和仪器 肠癌细胞株HT29购自国家生物医学实验细胞资源库。C57BL/6雄性裸鼠,SPF级,4~5周龄,体质量18~22 g,32只。购自广州药康生物科技有限公司,动物生产许可证号:SCXK(粤)2020-0054;伦理编号19-08-11HTREW-01。以基础标准饲料,自由摄食与饮水,在温度(23 ℃~25 ℃),湿度(45%~55%),12 h/12 h明暗交替下进行适应性喂养。PFFE-A(纯度≥99.9%,批号:CHO-JL92)购自美国Fisher Scientific公司。5-乙炔基-2'脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)染色试剂盒,购自美国Abbiotec公司(批号:AHI-239PD);Transwell小室(批号:CAMF-08ND)购自美国Corning公司;Trizol试剂(批号:TH03-KGF483)、逆转录试剂(批号:TH03-DNS327)购自美国Thermo公司;TGF-β1(批号:ROG94-VM649)、p-Smad2/3(批号:ROG37-CH056)抗体购自美国Roche公司;TGF-β1信号激动剂重组人TGF-β1(批号:2021-06-EV004)购自美国Santa Cruz公司。LRH-70F型二氧化碳细胞培养箱(美国BioTek公司),IX71型Olympus倒置显微镜(日本Olympus公司),电泳槽(型号:Mini-PRO-2100)、电泳仪(型号:JMR-27020)购自美国Cayman公司。
1.2细胞分组处理 取对数生长期的HT29细胞进行实验,分为正常对照组,PFFE-A小剂量组、中剂量组、大剂量组,培养基中分别添加50,100,150 μmol· L-1的小、中、大剂量的PFFE-A。
1.3显微镜观察各组结肠癌的细胞形态 将对数生长期的HT29细胞接种在24孔板上,并调整细胞密度到每孔2×104个,细胞分组同“1.2节”,培养24 h后,通过IX71倒置显微镜观察细胞的形态变化。
1.4EdU染色检测各组结肠癌细胞的增殖能力 将对数生长期的HT29细胞接种在24孔板上,并调整细胞密度到每孔3×105个,细胞分组同“1.2节”,培养24 h后,严格在试剂盒的要求下进行染色、固定、封片,拍照,LAS AF Lite图像处理软件进行统计分析
1.5Transwell小室检测各组细胞的侵袭能力 将对数生长期的HT29细胞接种在6孔板上,并调整细胞密度到每孔1×106个,细胞分组同“1.2节”,培养24 h后,PBS重悬,滴加至预先基质胶包被的Transwell小室上室中,培养24 h后,漂洗、固定、染色[10],显微镜下观察各组细胞的侵袭数量。
1.6异种种植结肠癌裸鼠模型 调整对数生长期的HT29细胞至每孔2×106个,细胞分组同“1.2节”,待细胞生长密度达到1×107个·mL-1时,消化,制成单细胞悬液,将裸小鼠按随机数字表法分为正常对照组、PFFE-A(小、中、大)剂量组,每组8只,将已备好的各组细胞悬液分别皮下注射到小鼠的后肢腹股沟处,在28 d后,将150 mg· kg-1的荧光素Promega腹腔注射到小鼠体内,10 min后连接IVIS Spectrum成像系统[11],数码相机对小鼠原位肿瘤拍照,IVIS Spectrum成像系统记录结肠癌病灶转移灶的情况,处死小鼠并无菌剥离小鼠的瘤体组织,称体质量。
1.7实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测各组细胞中上皮间质转化(epithelial to mesenchymal transition,EMT)相关基因的表达 调整对数生长期的HT29细胞至每孔2×105个,细胞分组同“1.2节”,漂洗,Trizol试剂提取细胞的总RNA,将RNA逆转录为DNA,PCR仪扩增,采用2-△△Ct来表示基因mRNA的相对表达量[12],以GAPDH作为参照,基因序列:GAPDH正义链:5′-AAGGTGGTGAAGCAGGCAT-3′,反义链:5′-GGTCCAGGGTTTCTTACTCCT -3′;E-钙黏蛋白(E-cadherin)正义链:5′-AACGGGGACGAAGTGCTAAG-3′,反义链:5′-CCTCTGCAGGACCTTGATCTC-3′;神经型钙粘附蛋白(N-cadherin)正义链:5′-TGGAGGCCACTATCCGAGAA-3′,反义链:5′-GAAGCGCTCAGGCATAAACC-3′。
1.8Western blotting检测各组细胞中EMT相关蛋白和TGF-β1、p-Smad2/3的表达水平 调整对数生长期的HT29细胞至每孔2×106个,细胞分组同“1.2节”,收集细胞,裂解,离心,定量,取样品40 μg进行电泳分离,转膜后,封闭液中孵育,加入一抗(1:500),4 ℃孵育过夜,加入二抗(1:1 000),显色[13],以GAPDH作为内参。
1.9功能挽救实验 调整对数生长期的HT29细胞至每孔2×106个,分别以150 μmol·L-1的PFFE-A(PFFE-A组)、150 μmol·L-1的PFFE-A+20 ng· mL-1的TGF-β1信号激动剂(重组人TGF-β1激动剂组)干预,另设立正常对照组HT29细胞,不进行任何干预,分别进行Edu以及Transwell小室实验,评估细胞的增殖与侵袭能力。
2 结果
2.1各组HT29细胞的形态改变 显微镜下正常对照组HT-29细胞形状规整,多为圆形或椭圆形,细胞贴壁生长良好,胞间连接紧密,活性细胞呈片状聚集生长;PFFE-A 小、中、大剂量组细胞的生长受限明显,活性细胞数量明显减少,细胞间的连接松散,成片生长的细胞体积明显减小,并且随药物剂量的升高,可见的漂浮细胞或坏死细胞数量明显增多,见图1。
2.2EdU染色检测各组结肠癌细胞的增殖能力 EdU染色结果显示,与正常对照组比较,PFFE-A小、中、大剂量组细胞中的EdU阳性比例显著下降(t=-4.536~-1.257,P<0.05),并且具有明显的剂量依赖性(P<0.05),见图2。
2.3Transwell小室检测各组细胞的侵袭能力 Transwell小室侵袭结果显示,与正常对照组比较,PFFE-A小、中、大剂量组细胞穿过Matrigel胶的细胞数量明显下降(t=-78.426~-24.927,P<0.05),具有明显的剂量依赖性(P<0.05),见图3。
2.4各组结肠癌细胞体内生长与转移的能力 异种种植结肠癌裸鼠模型结果显示,与正常对照组比较,PFFE-A小、中、大剂量组细胞皮下成瘤瘤组织质量显著下降(t=-10.549~-2.157,P<0.05),具有显著的剂量依赖性(P<0.05),见图4。IVIS Spectrum成像系统结果显示,与正常对照组比较,PFFE-A小、中、大剂量组细胞病灶转移比例显著下降(t=-47.916~-8.073,P<0.05),具有显著的剂量依赖性(P<0.05),见图5。
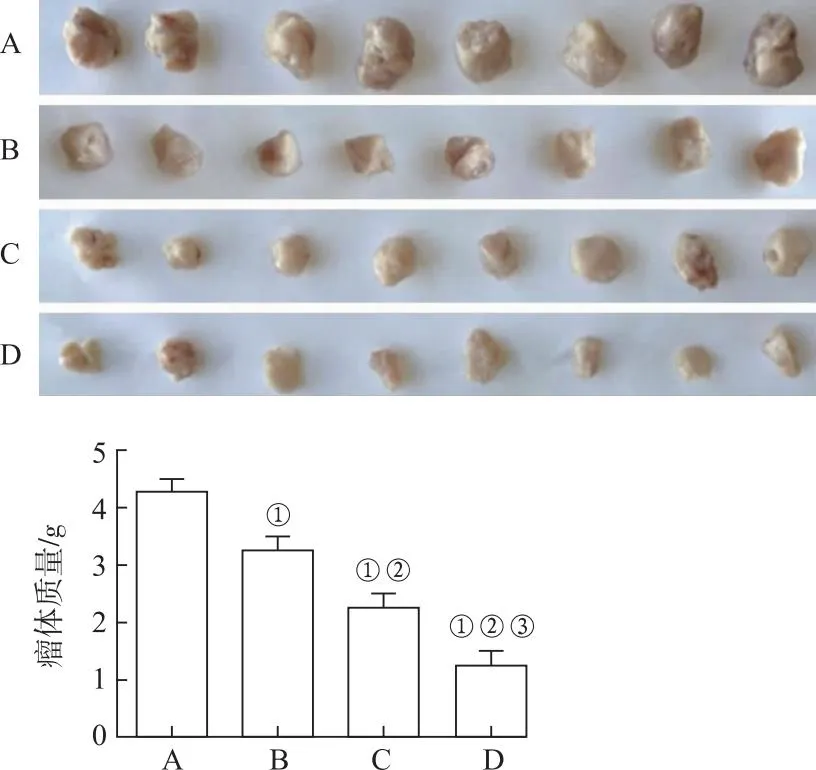
A.正常对照组;B.PFFE-A小剂量组;C.PFFE-A中剂量组;D.PFFE-A大剂量组。①与正常对照组比较,t=-10.549~-2.157,P<0.05;②与PFFE-A小剂量组比较,t=-8.447~-1.943,P<0.05;③与PFFE-A中剂量组比较,t=-2.571,P<0.05。
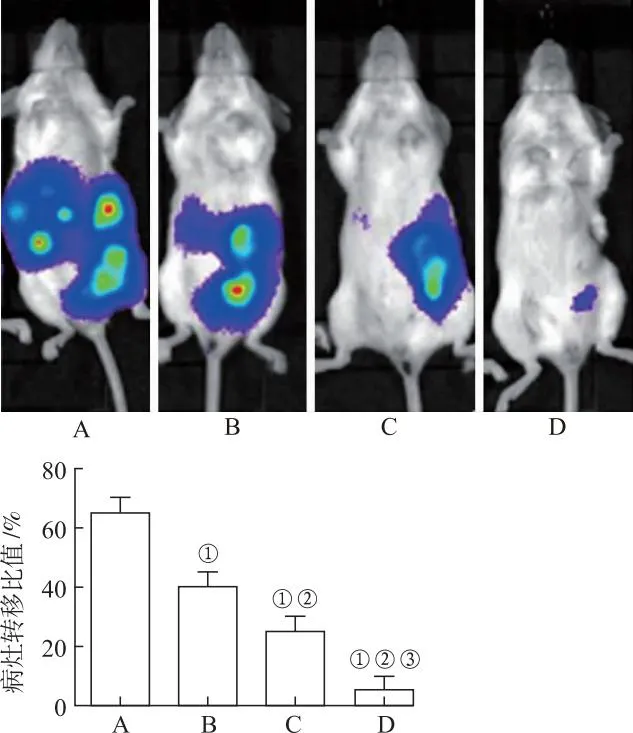
A.正常对照组;B.PFFE-A小剂量组;C.PFFE-A中剂量组;D.PFFE-A大剂量组。①与正常对照组比较,t=-47.916~-8.073,P<0.05;②与PFFE-A小剂量组比较,t=-33.745~-6.877,P<0.05;③与PFFE-A中剂量组比较,t=-7.359,P<0.05。
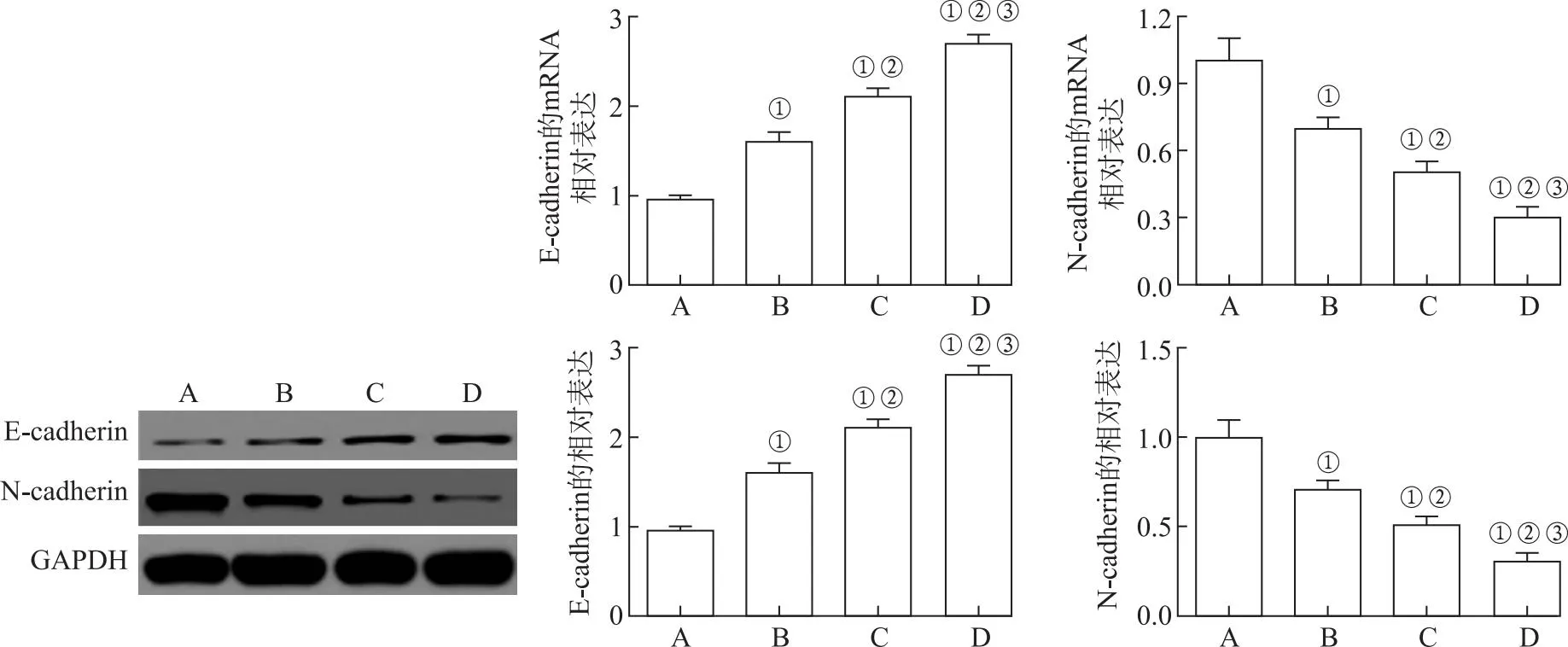
A.正常对照组;B.PFFE-A小剂量组;C.PFFE-A中剂量组;D.PFFE-A大剂量组。①与正常对照组比较,t=-11.258~-3.018,-10.982~-2.847,P<0.05;②与PFFE-A小剂量组比较,t=-9.673~-2.542,-8.961~-1.846,P<0.05;③与PFFE-A中剂量组比较,t=-2.746,-1.445,P<0.05。
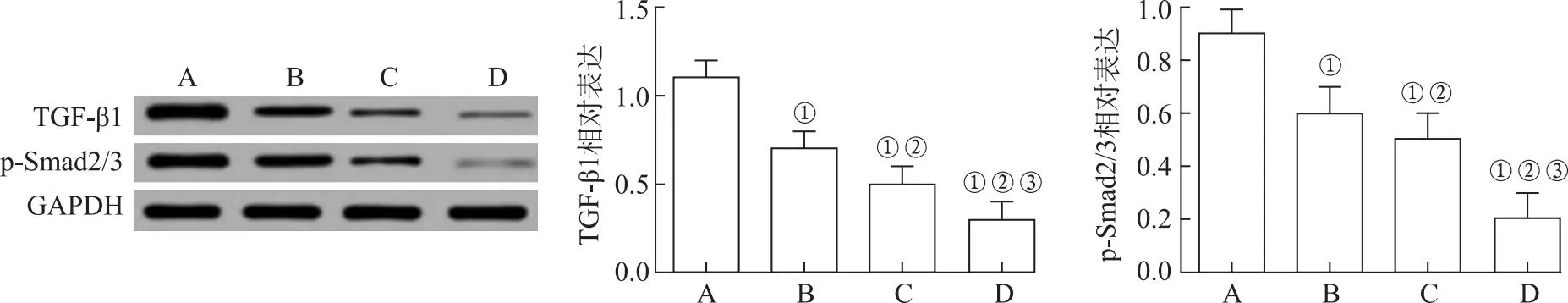
A.正常对照组;B.PFFE-A小剂量组;C.PFFE-A中剂量组;D.PFFE-A大剂量组。①与正常对照组比较,t=-4.687~-2.156,-5.743~-2.259,P<0.05;②与PFFE-A小剂量组比较,t=-3.872~-1.761,-4.975~-2.093,P<0.05;③与PFFE-A中剂量组比较,t=-2.147,-2.004,P<0.05。
2.5各组细胞中E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)的表达 RT-PCR结果和Western blotting检测结果显示,与正常对照组比较,PFFE-A小、中、大剂量组细胞中E-cadherin的mRNA和蛋白的表达显著升高(t=-11.258~-3.018,P<0.05),N-cadherin的mRNA和蛋白的表达显著降低(t=-10.982~-2.847,P<0.05),具有显著的剂量依赖性(P<0.05),见图6。
2.6Western blotting检测各组细胞中TGF-β1、p-Smad2/3的表达水平 Western blotting检测结果显示,与正常组对照比较,PFFE-A小、中、大剂量组细胞中TGF-β1、p-Smad2/3的表达显著下降(t=-4.687~-2.156,-5.743~-2.259,P<0.05),具有显著的剂量依赖性(P<0.05),见图7。
2.7功能挽救实验结果 EdU以及Transwell小室实验结果显示,与正常对照组细胞比较,PFFE-A组细胞、重组人TGF-β1激动剂组细胞EdU阳性比例以及细胞侵袭数量明显下降,与PFFE-A组细胞比较,重组人TGF-β1激动剂组细胞EdU阳性比例以及细胞侵袭数量明显回升,差异均具有统计学意义(t=-62.958~-13.256,P<0.05),见图8。
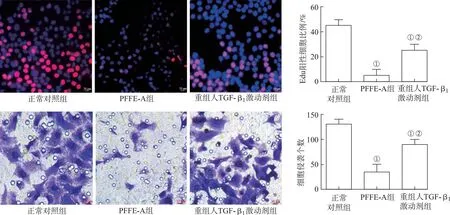
①与正常对照组比较,t=-62.958~-13.256,P<0.05;②与PFFE-A组比较,t=-44.571~-21.989,P<0.05。
3 讨论
目前,大肠癌的发病率逐年升高,并且患者的5年生存率仍比较低[14]。已有的研究显示[15]大肠癌患者在确诊后的再次局部复发及发生靶器官的转移性扩散,直接危及患者的生命安全。因此从疾病的分子机制出发,积极探索肿瘤的增殖以及转移的分子标志物,开发新型的抗肿瘤药物在临床上有助于提高患者的生命质量。
海洋褐藻(昆布)作为我国传统的药食同源性的中药组分,具有抗炎、抗病毒以及抗肿瘤效用,其中,海洋褐藻的抗肿瘤效应仍处于实验探索阶段[16]。MANANDHAR等[17]研究显示PFFE-A作为海洋褐藻的重要的生物活性组分,展示了多种靶向效应,能明显抑制肝癌细胞的增殖。本研究结果显示,PFFE-A的应用能明显抑制HT29细胞的体外的增殖与侵袭、体内的生长与转移,并且这些效应显示出良好的剂量依赖性。这些结果表明了药物对疾病的良好的干预作用。
细胞的EMT是完成肿瘤细胞增殖、侵袭与转移的关键步骤[18]。MOSA等[19]研究显示EMT后,促使癌细胞在原发位点进行增殖,并直接推动其与原发肿瘤的分离,并浸润到其他靶器官中。CORBET等[20]研究显示抑制结肠癌细胞的EMT过程能明显抑制肿瘤细胞的侵袭与转移能力。E-cadherin表达的缺失以及N-cadherin表达的增强是发生EMT的标志性事件。本研究的PCR与Western blotting结果均显示PFFE-A能明显抑制N-cadherin的表达,而增加E-cadherin的表达,从而抑制结肠癌细胞的EMT过程。
已有的研究数据显示[21]肿瘤的增殖以及转移过程是一个在多种信号(包括TGF-β1/Smads信号在内)共同作用的病理过程。研究显示[22]TGF-β1被外界因子激活后,促使下游转录因子Smad2、Smad3发生磷酸化而生成p-Smad2/3,促使肿瘤信号入核,促进相关癌基因的转录以及翻译,增强癌细胞的增殖与侵袭。KIM等[23]研究显示,阻断TGF-β1/Smads的传导能显著抑制结肠癌细胞的EMT过程,抑制肿瘤细胞的增殖与转移。本研究结果显示PFFE-A能显著抑制TGF-β1的表达,抑制Smads(Smad2、Smad3)的磷酸化,并且具有明显的剂量依赖性,挽救实验结果显示TGF-β1信号激动剂逆转PFFE-A对大肠癌细胞增殖与侵袭的抑制。
综合上述,PFFE-A能抑制肿瘤细胞的EMT过程,抑制大肠癌细胞HT29的体外增殖与侵袭能力,下调其体内生长与转移的能力,这可能是通过下调TGF-β1/Smads信号实现的,但是PFFE-A在大肠癌中是否还存在其他作用靶点仍需更为深入的研究。
