双路通脑方调节SIRT1/Nrf2/GPx4信号通路对缺血性脑卒中大鼠神经元铁死亡的影响*
2024-04-08郑光珊翟阳王凯华马威梅小平陈莹邹敏庞延杨鹏吕艳
郑光珊,翟阳,王凯华,马威,梅小平,陈莹,邹敏,庞延,杨鹏,吕艳
(1.广西国际壮医医院脑病科,南宁 530200;2.广西中医药大学教务处,南宁 530200;3.广西国际壮医医院康复科,南宁 530200;4.广西国际壮医医院儿科,南宁 530200;5.广西中医药大学第一附属医院急诊科,南宁 530200;6.广西国际壮医医院科技部,南宁 530200;7.广西中医药大学附属瑞康医院脑病科,南宁 530011)
缺血性脑卒中是脑卒中最常见类型,主要是因脑部血液供应减少以及脑动脉血栓栓塞性闭塞引起,进而产生细胞应激引发兴奋性毒性、氧化应激和线粒体紊乱,影响患者预后[1-2]。溶栓剂治疗是目前急性期最主要的治疗方法,但其治疗时间窗较窄。尽管新兴血管内血栓切除术可延长治疗时间窗,但仍有许多患者错过了血管重建的最佳时间[3]。铁死亡是一种铁依赖性氧化应激诱导的细胞死亡,其特征是由铁依赖性催化机制诱导的致死性脂质氢过氧化物的积累,进而导致神经元死亡,现代研究表明其对缺血性脑卒中具有重要作用[4-5]。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPx4)是铁死亡的关键调节因子,在脂质过氧化物转化为无毒脂质中起着至关重要的作用[6]。沉默信息调节因子2同源物1(silent information regulator 2 homolog 1,SIRT1)是一种NAD依赖性蛋白脱乙酰酶,被认为是细胞抵抗氧化应激损伤的保护因子[7]。SIRT1可通过介导核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)及其下游靶标的表达来消除脂质过氧化的影响,驱动抗氧化防御系统,同时诱导并参与GPx4的合成,进而抑制铁死亡[8]。研究表明上调SIRT1能够增加Nrf2和GPx4表达,减轻铁死亡,进而减轻缺氧缺血性脑损伤[9]。双路通脑方由广西国际壮医医院在壮药壮通饮的基础上自主研发而成,是具有地方民族特色的院内协定处方,由桂枝尖、陈皮、茯苓、苍术、南山楂、生姜、扶风藤、黄花倒水莲、田七、法半夏和炙甘草组方而成,具有疏通龙路、火路之毒邪瘀滞之效。临床研究表明双路通脑方对缺血性脑卒中急性期和恢复期患者疗效显著,同时能够提高患者生活质量[10],但其作用机制尚未明确。因此,本研究旨在探讨双路通脑方能否通过调控SIRT1/Nrf2/GPx4信号通路来改善缺血性脑卒中的神经元铁死亡。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级SD雄性大鼠90只,6周龄,体质量180~210 g,购自广西医科大学,实验动物许可证号:SCXK(湘)2019-0004。将大鼠饲养在温度24~26 ℃,相对湿度55%~65%,且12 h光照和12 h黑暗交替的环境中。本研究经广西中医药大学伦理委员会批准(伦理审查批件:DW20210612-063)。
1.2主要试剂和仪器 双路通脑方(批号:20210901,每克相当于原药材5 g,成人每天3次,每次0.8 g[10])来源于广西国际壮医医院,方中11味中药配方颗粒经本院药房检验均符合规定要求;EX527(SIRT1抑制剂,批号:HY-15452)购自美国Med Chem Express;2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyte-trazoliumchloride,TTC)染色液(购自北京凯诗源生物科技有限公司,批号:SH-0453);苏木素-伊红(hematoxylin-eosin,HE)染色液(批号:YT8310)、尼氏染色液均购自北京伊塔生物科技有限公司(批号:YT8911);铁(Fe2+)含量检测试剂盒购自北京百奥莱博科技有限公司(批号:SNM159);大鼠超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自上海酶研生物科技有限公司(批号:EK-R37032、EK-R38818);大鼠丙二醛(malonaldehyde,MDA)ELISA检测试剂盒购自艾美捷科技有限公司(批号:EKF60082);酰基-辅酶a合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)兔单抗(批号:ab155282)、铁蛋白重链多肽1(FTH1)兔单抗(批号:ab183781);转铁蛋白受体(transferrin receptor,TFR)小鼠单抗(批号:ab269513)、SIRT1兔单抗(批号:ab189494)、GPx4兔单抗(批号:ab125066)、胱氨酸/谷氨酸转运蛋白(cystine/glutamate antiporter solute carrier family 7 member 11,SLC7A11)兔单抗均购自英国abcam公司(批号:ab175186);Nrf2兔多抗购自上海爱必信生物科技有限公司(批号:abs146223);山羊抗兔(批号:33101ES60)、山羊抗小鼠(批号:33220ES60)均购自上海翌圣生物科技股份有限公司。
KJ-2V7M型超声经颅多普勒血流分析仪(南京科进实业有限公司);Thermo热电FC酶标仪(上海联迈生物工程有限公司;奥林巴斯倒置显微镜CKX53(上海普赫光电科技有限公司);ChemiDoc MP System全能型成像系统(上海伯乐生命医学产品有限公司)。
1.3方法
1.3.1大鼠模型制备 先在所有大鼠中采用随机数字表法选取20只作为假手术组,剩余70只大鼠均参照文献[11]采用大脑中动脉闭塞法制备缺血性脑卒中大鼠模型。24 h后,根据Zea-Longa方法[12]进行评分,评分标准如下:0分:无异常症状;1分:缺血对侧前肢无法伸直;2分:行走时易向缺血对侧转圈;3分:行走时易向缺血对侧跌倒;4分:不能进行自主意识的活动。评分越高表明神经损伤程度越大。评分在1~3分的大鼠则为造模成功,造模成功率为85.71%。假手术组大鼠只暴露颈动脉,并不进行结扎。
1.3.2分组及给药 将造模成功的60只大鼠利用随机数字表法分为模型对照组、双路通脑方组、双路通脑方+SIRT1抑制剂组(双路通脑方+EX527组),每组20只。取双路通脑方适量,用注射用水溶解制成双路通脑方水溶液。双路通脑方组大鼠根据剂量换算公式[大鼠剂量=6.3×(0.4×2×3)g/70 kg=0.216 g·kg-1]按0.216 g·kg-1灌胃给予双路通脑方水溶液[10];双路通脑方+EX527组大鼠在灌胃双路通脑方水溶液之前腹腔注射10 mg·kg-1的SIRT1抑制剂EX527[13]。假手术组和模型对照组大鼠均以相同方式给予等体积的生理盐水。每天给药1次,共持续14 d。末次给药结束后,根据“1.3.1节”中的Zea-Longa评分评估各组大鼠神经损伤情况。
1.3.3TTC染色检测大鼠脑梗死面积 神经功能评分后,每组选取5只大鼠用1%戊巴比妥钠麻醉后处死,在无菌条件下解剖大脑并获取完整脑组织。将脑组织切成冠状切片厚2 mm,然后浸入2% TTC溶液中,在室温下避光孵育20 min。使用照相机对脑切片进行拍照,并利用Image J软件测量和分析梗塞面积。
1.3.4HE染色检测大鼠脑组织病理情况 每组取5只大鼠按照“1.3.3节”方法获取脑组织后,立即固定于4%多聚甲醛中,24 h后将大脑组织进行石蜡包埋,并切成5 μm厚的切片。然后将石蜡切片在二甲苯中脱蜡,并利用梯度乙醇再水合,用苏木素-伊红染色。之后将组织切片分别使用梯度乙醇和二甲苯进行脱水透明,PBS清洗后中性树脂封片,最后在显微镜下观察缺血侧脑组织的病理变化。
1.3.5尼氏染色检测大鼠脑组织神经元数量 取“1.3.4节”中的石蜡切片脱蜡水化后,放入尼氏染色溶液中,在37 ℃下浸泡5 min。然后按照方法进行脱水、透明和封片。在光学显微镜下观察尼式体的染色情况,并利用Image J软件分析尼式体染色阳性的神经元数量。
1.3.6检测大鼠脑组织中Fe2+、SOD、GSH、MDA的水平 将剩余大鼠全部麻醉处死后取缺血侧脑组织,PBS清洗后,每组取5只进行称体质量,然后加入液氮研磨成粉末,并按照1:9(W/V)的比例加入预冷的PBS进行匀浆,在4 ℃,2 500 r·min-1(离心半径10 cm)下离心10 min,收集上清液。剩余组织冻存至-80 ℃。先利用比色法检测上清液中的Fe2+含量,然后再按照SOD、GSH、MDA试剂盒制备标准曲线,用酶标仪检测上清液在450 nm处的吸光度,并根据标准曲线计算SOD、GSH、MDA的含量。
1.3.7免疫组化检测大鼠脑组织中ACSL4、TFR、FTH1蛋白的阳性表达 取“1.3.4节”中的脑组织石蜡切片进行脱蜡,将脱蜡后的切片在抗原修复缓冲液(0.01 M柠檬酸溶液,pH 6.0)中煮沸20 min,以促进抗原修复。然后,将切片冷却至室温后用3% H2O2溶液处理30 min,阻断内源过氧化物酶的活性。随后,将切片置于含1% BSA的PBS中孵育30 min,与ACSL4(1:250)、TFR(1:2 000)、FTH1(1:400)抗体稀释液在4 ℃下孵育过夜,与羊抗兔或羊抗小鼠二抗(1:500)在室温下孵育1 h,用DAB染色,苏木精复染。用光学显微镜观察切片染色情况,棕黄色表示阳性蛋白表达,利用Image Pro Plus软件测量每张图片的累积光密度值和区域面积,并计算平均光密度值(A)来反映目标蛋白在单位面积内的表达情况。
1.3.8Western blotting法检测大鼠脑组织中SIRT1、Nrf2、GPx4、SLC7A11蛋白的表达 取“1.3.6节”中冻存的脑组织,加入RIPA裂解缓冲液提取总蛋白质。将煮沸变性后的蛋白样品通过10% SDS-PAGE分离并转移至PVDF膜。将膜在室温下用5%脱脂牛奶封闭1 h,然后用SIRT1、Nrf2、GPx4、SLC7A11一抗稀释液(稀释比例1:1 000)在4 ℃下孵育过夜,再在室温下与山羊抗兔(1:5 000)二抗共孵育1 h,最后用ECL试剂显影,在凝胶成像系统中摄像。然后以GAPDH为内参,用ImageJ软件分析蛋白条带灰度值。
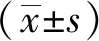
2 结果
2.1双路通脑方对大鼠神经功能缺损的影响 4组大鼠神经功能缺损评分比较,差异均具有统计学意义(F=1 895.275,P<0.05);与假手术组比较,模型对照组大鼠的神经功能缺损评分升高(P<0.05);与模型对照组比较,双路通脑方组大鼠的神经功能缺损评分显著降低(P<0.05);与双路通脑方组比较,双路通脑方+EX527组大鼠的神经功能缺损评分升高(P<0.05),见图1。
①与假手术组比较,P<0.05;②与模型对照组比较,P<0.05;③与双路通脑方组比较,P<0.05。
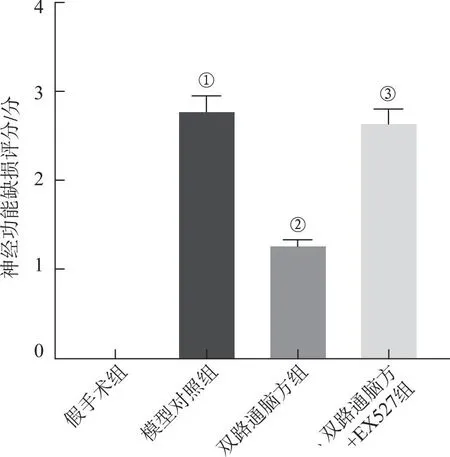
2.2双路通脑方对大鼠脑梗死面积的影响 4组大鼠脑梗死面积比较,差异均具有统计学意义(F=362.517,P<0.05);与假手术组比较,模型对照组大鼠的脑梗死面积增大(P<0.05);与模型对照组比较,双路通脑方组大鼠的脑梗死面积减小(P<0.05);与双路通脑方组比较,双路通脑方+EX527组大鼠的脑梗死面积增大(P<0.05),见图2。
A.TCC染色检测大鼠脑梗死面积;B.测量大鼠脑梗死面积(白色区域)。①与假手术组比较,P<0.05;②与模型对照组比较,P<0.05;③与双路通脑方组比较,P<0.05。
2.3双路通脑方对大鼠脑组织病理损伤的影响 假手术组大鼠脑组织结构完整,神经元形态正常;与假手术组比较,模型对照组大鼠神经元排列不规则,细胞间隙变大,细胞核固缩;与模型对照组比较,双路通脑方组大鼠神经元排列恢复整齐,细胞间隙缩小,细胞核固缩减轻;与双路通脑方组比较,双路通脑方+EX527组大鼠神经元损伤加重,与模型对照组相似,见图3。

图3 HE染色检测各组大鼠脑组织的病理形态(×200)
2.4双路通脑方对大鼠神经元损伤的影响 4组大鼠神经元数量比较,差异均具有统计学意义(F=314.553,P<0.05);与假手术组比较,模型对照组大鼠神经元数量减少(P<0.05);与模型对照组比较,双路通脑方组大鼠神经元数量增加(P<0.05);与双路通脑方组比较,双路通脑方+EX527组大鼠神经元数量减少(P<0.05),见图4。

A.Nissl染色大鼠神经元(×200);B.统计神经元染色数量。①与假手术组比较,P<0.05;②与模型对照组比较,P<0.05;③与双路通脑方组比较,P<0.05。
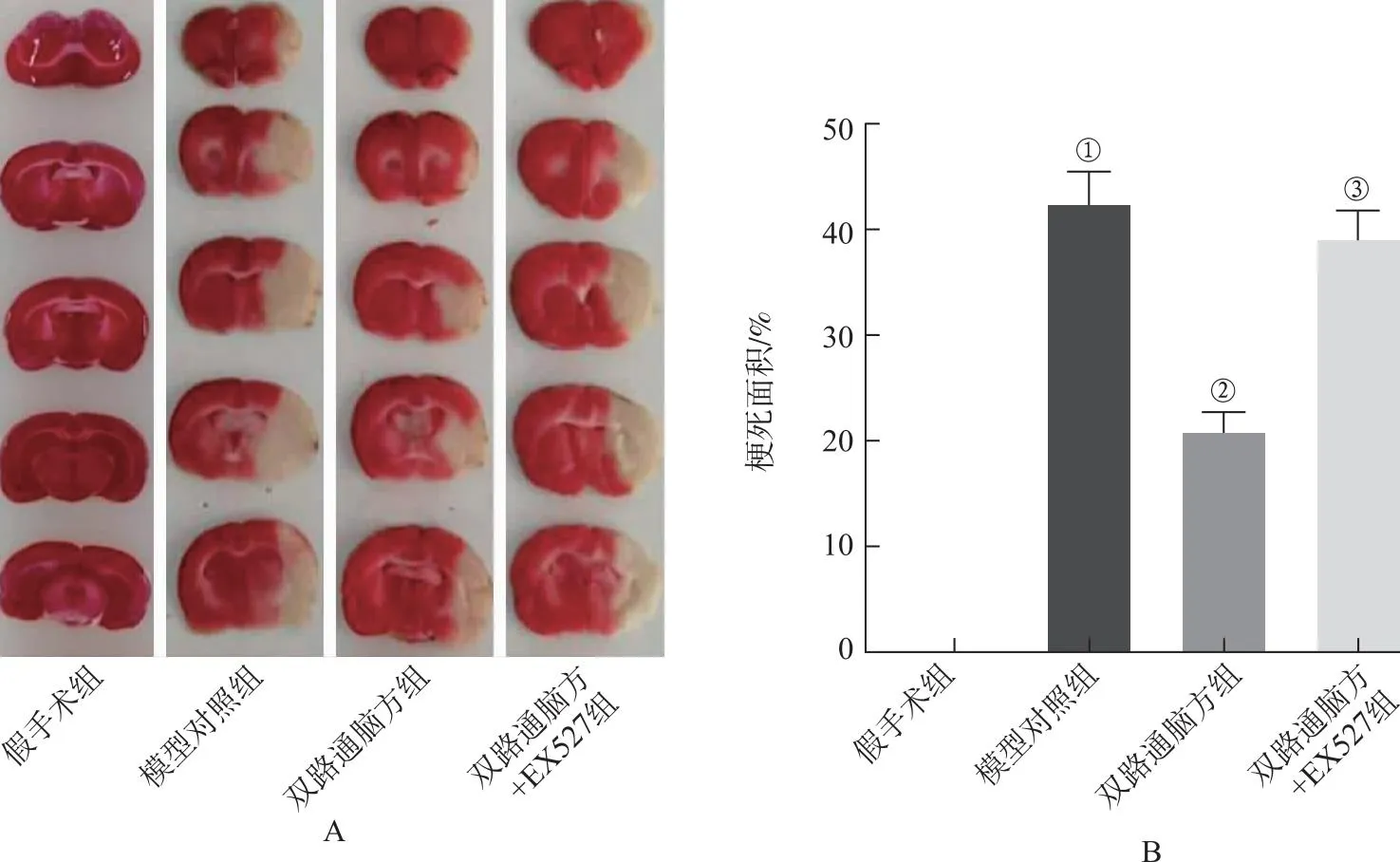
2.5双路通脑方对大鼠脑组织中Fe2+、MDA、SOD、GSH水平的影响 4组大鼠脑组织中Fe2+、MDA、SOD、GSH水平比较,差异均具有统计学意义(F=158.191、96.975、160.186、124.947,均P<0.05);与假手术组比较,模型对照组大鼠脑组织中Fe2+和MDA水平升高,SOD、GSH水平降低(P<0.05);与模型对照组比较,双路通脑方组大鼠脑组织中Fe2+和MDA水平降低,SOD、GSH水平升高(P<0.05);与双路通脑方组比较,双路通脑方+EX527组大鼠脑组织中Fe2+和MDA水平升高,SOD、GSH水平降低(P<0.05),见图5。
①与假手术组比较,P<0.05;②与模型对照组比较,P<0.05;③与双路通脑方组比较,P<0.05。
2.6双路通脑方对各组大鼠脑组织中ACSL4、TFR、FTH1蛋白表达的影响 4组大鼠脑组织ACSL4、TFR、FTH1蛋白表达比较,差异均具有统计学意义(F=30.000、53.611、99.872,均P<0.05);与假手术组比较,模型对照组大鼠脑组织中ACSL4、TFR表达升高,FTH1表达降低(P<0.05);与模型对照组比较,双路通脑方组大鼠脑组织中ACSL4、TFR表达降低,FTH1表达升高(P<0.05);与双路通脑方组比较,双路通脑方+EX527组大鼠脑组织中ACSL4、TFR表达升高,FTH1表达降低(P<0.05),见图6。
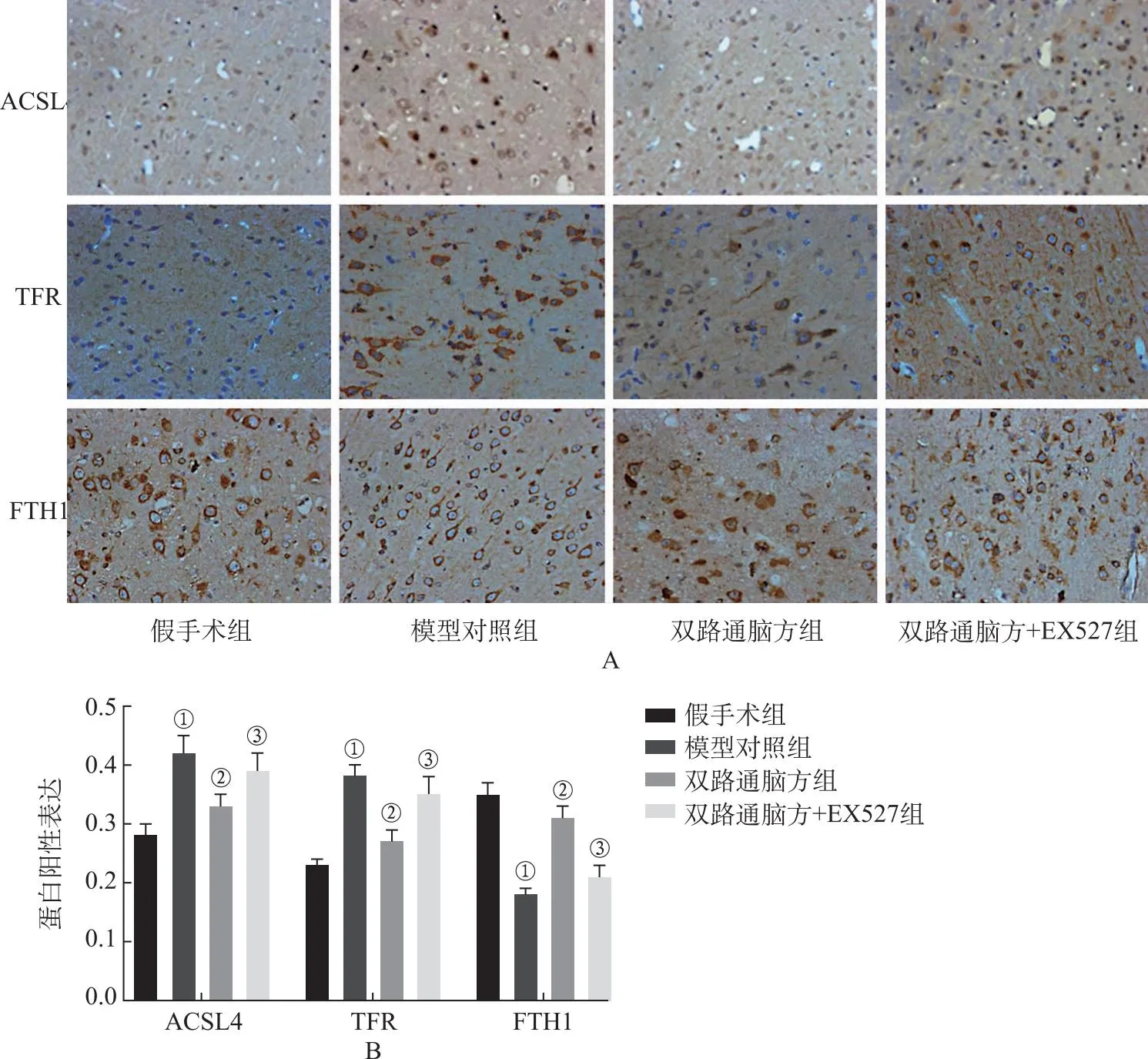
A.ACSL4、TFR、FTH1蛋白的免疫组化染色;B.ACSL4、TFR、FTH1蛋白的平均吸光度值。①与假手术组比较,P<0.05;②与模型对照组比较,P<0.05;③与双路通脑方组比较,P<0.05。
2.7双路通脑方对各组大鼠脑组织中SIRT1、Nrf2、GPx4、SLC7A11蛋白表达的影响 4组大鼠脑组织中SIRT1、Nrf2、GPx4、SLC7A11蛋白表达比较,差异均具有统计学意义(F=250.118、228.214、439.856、405.889,均P<0.05);与假手术组比较,模型对照组大鼠脑组织中SIRT1、Nrf2、GPx4和SLC7A11蛋白表达降低(P<0.05);与模型对照组比较,双路通脑方组大鼠脑组织中SIRT1、Nrf2、GPx4和SLC7A11蛋白表达升高(P<0.05);与双路通脑方组比较,双路通脑方+EX527组大鼠脑组织中SIRT1、Nrf2、GPx4和SLC7A11蛋白表达降低(P<0.05),见图7。
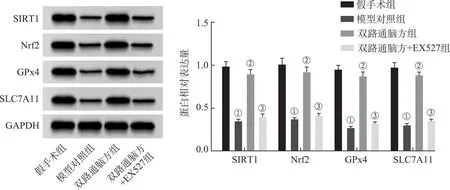
①与假手术组比较,P<0.05;②与模型对照组比较,P<0.05;③与双路通脑方组比较,P<0.05。
3 讨论
缺血性脑卒中是最常见的脑卒中,其特征是脑血管闭塞导致的脑部血液和氧气供应不足,进而在缺血性脑组织中发生一系列有害的级联反应,包括活性氧积累、免疫细胞浸润、血脑屏障破坏以及神经元的不可逆坏死,增加患者发生神经功能障碍的风险[14-15]。因此,需要制定新的治疗策略,以有效促进神经功能恢复并减轻继发性再灌注损伤。本研究结果显示,模型对照组大鼠神经功能缺损评分和脑梗死面积均高于假手术组,提示大鼠模型复制成功。而双路通脑方组大鼠的神经功能缺损评分和脑梗死面积较模型对照组降低,揭示了双路通脑方可以降低缺血性脑卒中大鼠的神经功能障碍并抑制脑组织梗死。随后,进一步通过HE和尼氏染色观察神经元的病理损伤情况,结果显示,模型对照组大鼠脑组织神经元数量减少,神经元损伤严重,双路通脑方组大鼠脑组织神经元数量增加,神经元损伤减轻,揭示了双路通脑方能够减轻缺血性脑卒中大鼠的神经元损伤。
缺血性脑卒中的发病机制比较复杂,其特征主要是活性氧的过度产生、细胞外兴奋性氨基酸和谷氨酸水平的显著增加,以及氧化应激和神经炎症的激活[16]。最近,铁死亡被证明是一种氧化程序性细胞死亡,可能是由于铁离子积累诱导的过度脂质过氧化和GSH的减少引起的抗氧化防御系统失衡,最终导致细胞氧化死亡[17],目前已有大量研究证明了铁死亡在缺血性脑卒中引起的神经元死亡中发挥重要作用[18]。因此,本研究探讨了双路通脑方对神经元铁死亡的调节作用。已知有多种蛋白质参与调节铁死亡,包括ACSL4、TFR和FTH1,ACSL4催化长链多不饱和脂肪酸的乙酰化,产生脂质过氧化物,最后促进铁死亡[19]。TFR通过转铁蛋白内吞途径来吸收铁,增加铁在细胞内的积累,而FTH1则与细胞内过量的游离铁形成铁蛋白复合物并以无毒形式储存[20]。结果发现,与模型对照组比较,双路通脑方组大鼠脑组织中的Fe2+和脂质过氧化产物MDA的含量降低,抗氧化酶SOD和GSH含量升高,铁死亡标志蛋白ACSL4、TFR表达降低,FTH1表达升高,提示双路通脑方能够抑制缺血脑卒中大鼠Fe2+的积累和过度的脂质过氧化,促进铁离子形成铁蛋白复合物,进而抑制神经元铁死亡。但其作用机制还需进一步了解。
SIRT1作为一种高度保守的NAD+依赖性脱乙酰酶,在细胞代谢、衰老、凋亡、炎症反应和氧化应激等过程中起着关键的调节作用,Nrf2是细胞内抗氧化蛋白的主要转录调节因子,其通过调节下游抗氧化基因血红素氧合酶1(heme oxygenase-1,HO-1)表达来降低ROS水平,以防止氧化应激诱导的组织损伤[21]。有研究已经表明SIRT1/Nrf2信号通路可以通过抑制氧化应激来减轻脑缺血再灌注损伤[22]。而最近在另一项研究中发现,Nrf2和HO-1都可以诱导并参与铁死亡中枢抑制剂GPx4的合成,同时也会增加FTH1、SLC7A11等其他下游因子的表达,从而影响铁死亡途径[6,23]。其中SLC7A11也是GPx4的还原底物GSH合成半胱氨酸的主要来源。本研究结果显示,双路通脑方组大鼠脑组织中SIRT1、Nrf2、GPx4、SLC7A11蛋白表达均高于模型对照组,提示双路通脑方能够激活缺血性脑卒中大鼠中的SIRT1/Nrf2/GPx4信号通路。EX527是一种新型、选择性SIRT1小分子抑制剂,有研究显示,在小鼠抑郁模型中,EX527的加入消除了依拉达奉的抗抑郁作用,并抑制Sirt1/Nrf2/HO-1/Gpx4 通路中的蛋白水平[24]。因此,本研究为了进一步探索该通路在双路通脑方抑制神经元铁死亡过程中的作用,使用SIRT1抑制剂进行回补实验,结果显示SIRT1抑制剂逆转了双路通脑方对神经元铁死亡的抑制作用,同时也抑制了Nrf2和GPx4的表达,进一步揭示了双路通脑方对缺血性脑卒中大鼠神经元铁死亡的抑制作用可能与SIRT1/Nrf2/GPx4信号通路被激活有关。
综上所述,双路通脑方可能通过激活SIRT1/Nrf2/GPx4信号通路来抑制缺血性脑卒中大鼠神经元铁死亡。本研究通过动物实验进一步证实了双路通脑方对缺血性脑卒中存在潜在的治疗作用,并为临床应用提供理论依据。与其他研究药物比较,本研究中药方成本较低,且无毒副作用,可以作为脑卒中的治疗药物推广。但目前对双路通脑方的功效主治、适应证尚未能完全明确,工艺及质量标准优化也不完全,对每味药材的质量标准及药理药性研究不充分,因此该药方的具体应用及推广还需更多的研究支持和验证。本研究通过HE染色、尼氏小体染色从病理学角度验证双通路脑方对脑卒中神经元死亡的恢复作用,同时采用行为学评估、脑梗死面积等指标对双通路脑方药效学进行评价,评价指标还不够全面,后续将补充更多的评价指标进一步对双路通脑方药效学进行深入研究。
