miR-30b通过抑制NLRP3炎症小体激活降低心肌缺血再灌注损伤研究
2024-04-07杜佩珊姜爱雯田艳珍赵东坡毛建云宋永建
杜佩珊, 姜爱雯, 田艳珍, 赵东坡, 毛建云, 宋永建
(1.河北省张家口市第一医院, 河北 张家口 075000 2.河北北方学院附属第一医院药学部, 河北 张家口 075000)
心肌缺血再灌注损伤(Myocardial Ischemia reperfusion injury,MIRI)是临床中常见缺血性心血管疾病的病理生理表现,大约有40%的心肌组织坏死由心肌再灌注损伤引起,改善MIRI损伤可为心血管疾病的治疗带来益处[1]。miRNAS被证实在MIRI的发展进程中发挥重要作用,miR-30b属于miR-30家族中的重要成员,其在心脏表达中高度保守,研究指出[2],miR-30b在心力衰竭患者中表达下降,且与主动脉炎、心肌肥厚小鼠病理密切相关,但是其在MIRI中的调控机制尚未阐明。炎症小体被证实是心肌缺血再灌注损伤的重要成分。炎性小体由NLRP、Caspase-1、细胞凋亡相关斑点促蛋白(ASC)等组成,上述物质相互作用,共同激活炎症反应,促进炎症级联反应,参与心肌细胞损伤,介导MIRI进程[3]。据报道,miR-30b通过靶向NLPR3炎症小体信号通路来介导肺纤维进程,二者在MIRI进程中是否具有调控机制有待研究[4]。基于上述讨论,本研究进一步探究了miR-30b、NLRP3炎症小体之间的关系以及二者在MIRI进程中的作用机制。
1 材料与方法
1.1.1实验对象:选取12周SPF级SD大鼠50只作为研究对象,体重范围250~300g,均购自河北省实验动物中心,实验动物许可证号:SCXK(冀)2022-7-001。大鼠进行分笼饲养,昼夜交替,室内温度控制在23~25℃,相对湿度50~70%,可自由进食水;本研究涉及动物实验均由伦理委员会批准;实验过程中对大鼠的处理方式均参照《关于善待动物的指导性意见》中相关要求及标准进行。
1.1.2主要实验试剂:胰蛋白酶购自上海玉博生物科技有限公司;胎牛血清(FBS)、甘油明胶封片剂、BCA蛋白浓度测定盒、SDS-PAGE凝胶设备、电泳缓冲液、PVDF膜、ECL化学发光检测试剂盒等均购自美国Gibco公司;鼠抗人NLRP3、ASC、Caspase-1抗体、GAPDH抗体购自美国ABC公司;辣根过氧化化物酶(HRP)标记二抗购自上海碧云天有限公司;NLRP3炎症小体信号通路抑制剂CY-09购自上海工程有限公司;CK-MB、LDH、cTnI ELISA检测试剂盒购自阿拉丁化学试剂有限公司;苏木精-伊红染色液、TUNEL检测试剂盒均购自美国ABC公司。
1.1.3主要实验仪器:RT-PCR检测仪、Mini PRO型电泳仪及转膜仪、电泳槽、凝胶成像系统、超净工作台、倒置显微镜均购自美国Beckman公司;超声心动图检测仪、流式细胞仪、台式高速离心机、微量可调节仪器、生物组织石蜡包埋机等均购自美国Beckman公司。
1.2方 法
1.2.1动物分组及药剂干预:各组大鼠在适应性喂养1周后,随机将其分为五组,分别为Sham组、MIRI组、miR-30b mimics组、CY-09组、miR-30b mimics+CY-09组;其中Sham组大鼠仅仅做开胸进行动脉穿线处理;MIRI组大鼠进行开胸处理,并且行做灌装动脉前降支的结扎以及再灌注造模处理;miR-30b mimics组大鼠首先进行miR-30b过表达腺病毒转染,在其大鼠左心室的前壁采用六点法注射腺病毒载体(miR-30b mimics,1×109PFU);CY-09组大鼠亦首先进行NLRP3信号通路抑制剂CY-09注射,在其大鼠左心室的前壁采用六点法注射CY-09(miR-30b mimics,50μg/100g);miR-30b mimics+CY-09组大鼠分别在对应位置注射miR-30b mimics、CY-09;在其转染后的3d后构建MIRI模型。
1.2.2MIRI模型制备及造模成功标准[9]: 大鼠腹腔注射1%戊巴比妥(40mg/kg),麻醉后采取仰卧位,颈部切口分离气管,连接微型人工呼吸机,四肢下固定电极检测心电图。沿着大鼠胸骨正中位置将皮肤、胸骨切开,暴露心脏,定位左冠状动脉的前降支,采用医用缝合线进行结扎,45min后进行再灌注30min处理。后续在心电图上观察到出现室性期前收缩、室性心动过速、心室颤动等再灌注心率失常等表现,超声心动图以抬高的ST段下降以及T波恢复为再灌注成功的标准。
1.3检测指标
序列结果用NCBI在线工具Blast在Gene Bank内与标准菌株比对,并用MEGA5.0软件构建系统发育树。
1.3.1超声心动图检测心功能因子:各组大鼠在MIRI模型建立后进行超声心动图检测,麻醉后固定仰卧在37℃的恒温加热板内,胸部处理后加少量耦合剂,设定检测频率为12.00MHz,探头10s,检测各组大鼠左心室舒张末压(Left ventricular end diastoilc pressur,LVEDP)、左心室内压峰值(Left ventricular sustolic pressure,LVSP)、压力上升最大变化速率(+dp/dtmax)及压力下降最大变化速率(-dp/dtmax),每个数值连续测量3个完整的心动周期后取平均值。
1.3.2ELISA检测心肌损伤因子水平:处死大鼠,取腹部主动脉血,精确配置相关实验用工作液、洗涤液,采用标准浓度样本配制出具有浓度梯度的标准品,将其添加到对应的反应孔内,设置空白对照孔。采用PBS溶液洗涤3次后添加相应生物素CK-MB、LDH、cTnI抗体,在37℃下反应1.5h;加入酶结合物工作液进行二抗反应;将显色底物加入,反应30mins后加入终止液;在450nm的波长下测定各个孔的吸光度,绘制标准曲线,最终计算CK-MB、LDH、cTnI的水平。
1.3.3HE染色评估大鼠心肌组织病理形态:心肌组织石蜡块切片均在4μm厚,经二甲苯脱蜡、乙醇梯度浓度脱水后进行苏木精染色5min后,经纯水洗涤、1%盐酸乙醇分化2s后进行返蓝、伊红染色2min;经过纯水洗涤、梯度乙醇脱水、二甲苯透明、切片风干以及中性胶封片后,在光学显微镜下观察心肌组织的病理形态。
1.3.4TUNEL检测大鼠心肌组织凋亡情况:心肌组织石蜡块切片均在4μm厚,经二甲苯脱蜡、乙醇梯度浓度脱水后放入包埋剂进行低温成型处理,冷冻切片机连续切片。采用TUNEL凋亡检测试剂盒检测各组大鼠心肌组织细胞凋亡情况。
1.3.5QRT-PCR检测大鼠心肌组织内miR-30b的mRNA表达:取心肌组织制备悬浮液,Trizol法提取总RNA,采用紫外分光光度计测定RNA浓度,参照反转录试剂盒将RNA合成cDNA,miR-30b正向引物:5-TGCTGGACCTTTCGGACTCT -3,反向引物:5-ATGGCTGGACCTGGATGCC -3,上述引物均由上海生物工程有限公司提供。严格按照qRT-PCR检测试剂盒说明书的配置反应体系,将其置于ABI实时荧光定量PCR检测仪检测;qRT-PCR反应条件为95℃预变性5min,循环1次,95℃预变性15s,在60℃下退火60s,72℃延伸30s,循环40次,以U6为内参,采用2-ΔΔCt法计算miR-30b的相对表达量。
1.3.6Western-blot检测NLRP3、ASC、Caspase-1蛋白表达取材后加入RIPA裂解液进行心肌组织悬浮液裂解处理,提取蛋白质,上样蛋白缓冲溶液,进行SDS-PAGE电泳分离蛋白,将检测蛋白转移到PVDF膜上,采用5%的脱脂牛奶封闭2.5h,TBST清洗3次;将PVDF膜与一抗在5℃下孵育过夜,采用TBST清洗;PVDF膜与荧光二抗孵育1.5h,经TBST清洗后采用红外成像系统进行扫描,采用Image软件进行灰度分析;其中一抗稀释比例NLRP3(1∶1500)、ASC(1∶1000)、Caspase-1(1∶1500)、GAPDH(1∶1500)。

2 结 果
2.1各组大鼠心肌组织内miR-30b的mRNA表达分析:结果显示,与Sham组相比,MIRI模型建立可以下调大鼠心肌组织内miR-30b的mRNA表达(P<0.05);miR-30b的过表达质粒转染可以明显上调大鼠心肌组织内miR-30b的mRNA表达(P<0.05);为下文的研究提供基础,结果详见图1。
2.2各组大鼠心功能参数比较:与Sham组相比,MIRI模型的建立可以上调心功能参数LVEDP数值,下调LVSP、+dp/dtmax、-dp/dtmax数值(P<0.05);miR-30b过表达质粒转染及NLRP3信号通路被阻断均可以下调LVEDP数值,上调LVSP、+dp/dtmax、-dp/dtmax数值(P<0.05);二者联合体现出最低LVEDP数值,最高LVSP、+dp/dtmax、-dp/dtmax数值(P<0.05);miR-30b过表达及NLRP3信号通路被阻断均可以提升MIRI大鼠心脏功能,结果详见表1。

表1 超声心动图检测各组大鼠心功能参数比较分析
2.3各组大鼠心肌损伤因子水平比较:与Sham组相比,MIRI模型的建立可以上调心肌损伤因子(CK-MB、LDH、cTnI)水平(P<0.05);miR-30b过表达质粒转染及NLRP3信号通路被阻断均可以下调血清CK-MB、LDH、cTnI因子水平(P<0.05);二者联合组大鼠血清内体现出最低CK-MB、LDH、cTnI因子水平(P<0.05);miR-30b过表达及NLRP3信号通路被阻断均可以抑制MIRI大鼠心肌损伤,结果详见表2。

表2 ELISA法检测各组大鼠心肌损伤因子水平比较
2.4各组大鼠心肌组织病理形态分析:Sham组大鼠心肌形态较为正常;MIRI模型的建立可以导致心肌组织排列紊乱,出现心肌纤维断裂、心肌细胞空泡化及炎性细胞浸润的现象;miR-30b过表达质粒转染及NLRP3信号通路被阻断均可以改善MIRI大鼠心肌组织病理形态,二者联合组大鼠心肌形态改善力度最大,心肌细胞空泡化及炎性细胞浸润现象得到大幅度降低;miR-30b过表达及NLRP3信号通路被阻断均可以改善MIRI大鼠心肌组织损伤状态,结果详见图2。
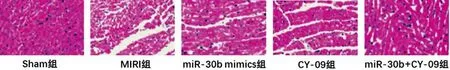
图2 HE染色分析各组大鼠心肌组织病理形态分析(×100)
2.5各组大鼠心肌细胞凋亡程度比较:与Sham组相比,MIRI模型的建立可以上调大鼠心肌组织凋亡程度(P<0.05);miR-30b过表达质粒转染及NLRP3信号通路被阻断均可以下调大鼠心肌组织凋亡能力(P<0.05);二者联合可以进一步降低大鼠心肌组织凋亡程度(P<0.05);miR-30b过表达及NLRP3信号通路被阻断均可以抑制MIRI大鼠心肌组织凋亡程度,结果详见图3。
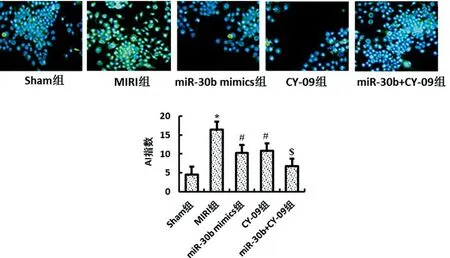
图3 TUNEL法检测各组大鼠心肌组织细胞凋亡能力分析(×50)
2.6miR-30b对NLRP3炎症小体信号通路活性的影响:与Sham组相比,MIRI模型的建立可以上调大鼠心肌组织内NLPR3炎症小体信号通路关键蛋白NLRP3、ASC、Caspase-1的表达(P<0.05);miR-30b过表达质粒转染及NLRP3信号通路被阻断均可以下调大鼠心肌组织内NLRP3、ASC、Caspase-1的表达(P<0.05);二者联合可以进一步降低大鼠心肌组织内NLRP3、ASC、Caspase-1的表达(P<0.05);miR-30b可以靶向抑制MIRI大鼠心肌组织内NLRP3炎症小体信号通路活性,结果详见图4、表3。

表3 Western-blot检测各组大鼠心肌组织内NLRP3炎症小体信号通路活性

图4 Western-blot检测各组大鼠心肌组织内NLRP3信号通路关键蛋白活性表达
3 讨 论
心血管疾病目前已经成为严重危害人类健康的关键因素。MIRI病理现象可以导致机体心肌代谢紊乱及结构的重塑,加重心脏功能的障碍及结构的紊乱性,使得心血管疾病的临床治疗遇到重重阻碍[5];目前大量的科研人员致力于探索MIRI发生发展的分子机制,已经取得了实质性进展,炎症级联反应、细胞凋亡、钙离子紊乱等均在MIRI发生发展进程中发挥了重要的作用。研究指出,miRNAs在心血管疾病中发挥了重要价值,miR-30家族被证实在机体炎症级联反应及细胞凋亡中扮演了重要角色,同时与多种缺血性疾病的进程密切相关,研究发现miR-30a在心肌梗死大鼠中的表达明显降低,同时随着其表达水平的降低,机体心肌纤维化、心功能衰退现象逐渐明显[6-7]。miR-30b作为miR-30家族中另外一个重要成员,被证实了炎症类疾病、缺血缺氧性脑部疾病中均发挥重要作用,但是其在MIRI进程中的作用机制值得进一步研究[8]。
本研究采用结扎左冠状动脉前降支再恢复血流的经典方式构建了MIRI大鼠心肌损伤模型,进一步确定了miR-30b表达对MIRI大鼠心肌损伤的影响。在腺病毒过表达转染中我们发现MIRI模型的建立可以明显降低miR-30b的表达,证实了miR-30b在心肌缺血再灌注损伤后表达下调,通过转染miR-30b过表达腺病毒发现miR-30b在心肌组织内的表达再次提升,为后续研究其对缺血再灌注损伤的心肌组织的保护作用提供基础。
研究表明,心脏功能参数LVDEP、LVSP、±dp/dtmax等指标可以较好的反应机体的心脏功能,其中LVDEP可以充分反应机体左心室的负荷情况,间接反映左心室的舒张功能;LCSP则主要反映心肌组织的收缩能力,±dp/dtmax可以对心脏室壁张力的变化速度进行反应,可以用来评估心肌组织收缩期、舒张期的收缩能力大小[9]。在本研究中,结果显示,MIRI模型的建立可以明显上调LVDEP指标,下调LVSP、±dp/dtmax等指标,miR-30b的过表达可以逆转上述现象,再次降低LVDEP指标,上调LVSP、±dp/dtmax等指标。进一步对各组大鼠的心肌损伤标志物进行了分析,研究显示cTnI、CK-MB、LDH等均属于心肌细胞特异性损伤的分子标志物,外周血中cTnI、CK-MB、LDH升高主要来源之一为心肌细胞的损伤。在本次的研究中我们得出,miR-30b的过表达可以明显逆转MIRI组大鼠外周血中cTnI、CK-MB、LDH水平提升的趋势,再次下调MIRI组大鼠外周血中cTnI、CK-MB、LDH的水平[10]。病理学结果分析显示,MIRI模型的建立可以导致心肌组织排列紊乱,出现心肌纤维断裂、心肌细胞空泡化及炎性细胞浸润现象,心肌组织凋亡程度明显提升,而miR-30b过表达质粒转染可以改善MIRI大鼠心肌组织病理形态,降低心肌组织的凋亡程度。综上可以看出,miR-30b可以改善缺血再灌注损伤所引起的心脏功能低下的表现,对缺血再灌注损伤的心肌组织具有保护作用。
NLRP3炎症小体在机体诸多炎症反应中发挥重要作用,属于炎症类型疾病中最为广泛涉及的炎症小体类型,其关键的蛋白体系主要有感受器蛋白NLRP3、凋亡相关斑点样蛋白(Apoptosis-related speck protein,ASC)、半胱氨酸天冬氨酸蛋白酶-1(Cysteinyl aspartate specific proteinase,Caspase-1)等[11]。数据显示,NLRP3炎症小体复合物的激活与缺血再灌注损伤密切相关,心肌缺血再灌注过程中大量的白细胞会向心肌组织募集,进而参与到炎症反应并且释放出炎症因子,加剧心脏功能的紊乱性[12]。在心脑血管疾病中,NLRP3炎症体被激活且表达水平提升,进而介导血管内皮细胞功能障碍,加速病理进展。本研究显示,当NLRP3信号通路被抑制后,MIRI大鼠的心肌损伤得到一定改善,大鼠心脏功能LVSP、±dp/dtmax指标得到明显上调,心肌损伤因子cTnI、CK-MB、LDH水平降低,同时心肌组织排列紊乱,出现心肌纤维断裂、心肌细胞空泡化及炎性细胞浸润现象亦得到较大程度的缓解,可见,NLRP3炎症小体信号通路活性在MIRI建立后被激活,且参与到MIRI病理进展中。
研究指出,miRNAs对心血管疾病的调控机制与下游的靶向基因密切相关,NLRP3炎症小体在诸多炎症性疾病中受到miRNAs分子的靶向调控[13]。为了证实在miR-30b与NLRP3在改善MIRI大鼠缺血再灌注心肌损伤中的作用机制,我们将二者联合应用到MIRI大鼠中,结果显示,miR-30b的过表达可以明显抑制NLRP3炎症小体信号通路关键蛋白NLRP3、ASC、Caspase-1的表达,其与信号通路抑制剂联合应用可以进一步降低NLRP3、ASC、Caspase-1的表达;且miR-30b、NLRP3信号通路抑制剂联合应用可以进一步提升MIRI大鼠的心脏功能,改善心肌组织细胞的病理损伤。综上可以看出,miR-30b通过靶向抑制MLPR3炎症小体的激活改善缺血再灌注损伤所引起的心脏功能低下、心肌细胞损伤加剧的表现,对缺血再灌注损伤的心肌组织起到保护作用,值得临床进一步研究。
