乔松素调节JAK2/STAT3信号通路对食管鳞癌细胞恶性进展的影响
2024-04-07刘红英解发桃魏艳君
刘红英, 解发桃, 魏艳君
(攀钢集团总医院消化内科, 四川 攀枝花 617000)
食管癌发于食管上皮,是临床常见的消化道恶性肿瘤疾病,由于食管鳞癌患者的早期症状并不具备特异性患者就诊时大多已发展至食管癌中晚期,其治疗效果及预后均较差,死亡率较高[1]。因此寻找能够调控食管鳞癌细胞恶性进展的药物及信号通路具有重要意义。乔松素(Pinocembrin,Pin)是从植物和蜂胶中提取的一种黄酮类天然化合物,大量研究表明,Pin具有较强的抗炎、抗菌以及抗氧化损伤作用[2],与此同时,Pin还能够抑制卵巢癌、结直肠癌等癌细胞的增殖及迁移进而发挥抑癌作用[3],因此推测Pin可能也与食管鳞癌细胞的恶性进展有关。有学者深入研究发现,Pin主要是通过磷脂酰肌醇3激酶/Akt、NF-κB等信号传导通路来发挥抗癌、抗炎作用[4]。Janus酪氨酸激酶2(Janus activated kinase 2,JAK2)/信号传导与转录激活子3(signal transducer and activator of transcription 3,STAT3)是常见的细胞间信号传导通路,广泛参与了细胞的增殖、分化及凋亡等生理活动,与炎性疾病、治疗耐药性及肿瘤疾病的发生及进展过程具有一定的相关性[5]。蒋可心等[6]的研究则显示,JAK2/STAT3信号通路也与食管癌细胞的增殖有关。但目前关于JAK2/STAT3信号通路对食管鳞癌细胞恶性进展的具体影响规律研究较少,因此,本研究将基于JAK2/STAT3信号通路探究Pin对食管鳞癌细胞恶性进展的调控机制。
1 材料与方法
1.1主要试剂及仪器:人KYSE-410细胞(货号:CL-0586,武汉益普生物科技有限公司);Broussonin E(货号:B30325,上海源叶生物科技有限公司);RPMI-1640培养基(货号:PM150110,武汉益普生物科技有限公司);CCK-8细胞增殖与毒性检测试剂盒(货号:BES-4202,上海博尔森生物科技有限公司);GAPDH(货号:ab181602)、p-JAK2(货号:278663)、JAK2(货号:32101)、p-STAT3(货号:278670)、STAT3(货号:267373)一抗均购自美国abcam公司;光学显微镜(型号:WMJ-9950,上海无陌光学仪器有限公司);酶标仪(型号:Spectra Max,上海逍鹏生物科技有限公司);BD FACSCalibur流式细胞仪(美国BD公司)。
1.2方 法
1.2.1细胞培养:KYSE-410细胞采用含有10%胎牛血清和1% P/S的RPMI-1640培养基进行培养,培养箱条件设置为37℃,5% CO2,待细胞融合率达到70%~80%后进行传代,选取传至第三代且生长状态良好的细胞进行后续实验。
1.2.2CCK-8检测Pin对细胞的毒性:将KYSE-410细胞接种在96孔板中(2×103个细胞/孔)培养24h后,分别加入浓度为0、20、40、60、80μmoL/L的Pin培养72h,然后每孔中加入10μL的CCK-8溶液,并在37℃培养箱中培养2h,最后使用酶标仪测量在460nm处的吸光度,并计算细胞存活率及半数抑制浓度(IC50)。
1.2.3细胞分组:将1.2.1中细胞随机分为KYSE-410组、Pin低浓度(Pin-L)组、Pin中浓度(Pin-M)组、Pin高浓度(Pin-H)组、Pin-H+JAK2激活剂(Pin-H+Broussonin E)组。KYSE-410组为正常培养基培养的KYSE-410细胞;Pin-L组、Pin-M组和Pin-H组分别用20μmoL/L、40μmoL/L和60μmoL/L的Pin培养[4];Pin-H+Broussonin E组采用60μmoL/L的Pin和20μmoL/L的JAK2激活剂Broussonin E培养[7]。
1.2.4CCK-8法检测各组细胞的增殖情况:将1.2.2中各组KYSE-410细胞以1×104/孔的密度分别接种至96孔板中,并加入100μL培养液培养48h,随后加入10μL CCK-8溶液继续培养2h。采用酶标仪测定培养液在450nm处的吸光度,记录数值并计算细胞存活率。
1.2.5克隆平板实验检测各组细胞克隆形成数量:将1.2.2中各组细胞以每孔5×102/孔的密度接种至6孔板中,培养14 d后弃去培养液并采用4%甲醛溶液固定细胞,结晶紫染色液染色后拍照,并采用Image J软件分析图像以计算菌落形成数量。
1.2.6Transwell实验检测各组细胞的迁移及侵袭能力:迁移实验:将1.2.2中各组细胞接种至Transwell上室中(1×104个细胞/孔),并于上室中加入无血清的培养基,下室加入含有10% FBS的培养基,在37℃,5% CO2的培养箱中培养24h,培养结束后用棉签除去上室膜内的细胞,并用4%甲醇固定穿过膜且粘附在膜外的细胞,再用0.1%结晶紫溶液染色、PBS洗涤。侵袭实验:将细胞接种至含有基质胶的Transwell上室中培养,其余步骤同迁移实验一样。最后在倒置显微镜下观察迁移和侵袭的细胞,随机选择10个高倍视野(×200)观察细胞并计数,计算各组细胞的迁移及侵袭数。
1.2.7流式细胞术检测各组细胞凋亡情况:将各组细胞接种至6孔板中进行培养,待细胞融合率达到80%以上时进行重悬、收集,用PBS洗涤,随后再次重悬于300μL含有5μL Annexin V和5μL碘化丙锭(PI)的缓冲液孵育30min。采用流式细胞仪分析细胞凋亡情况,计算细胞凋亡率。
1.2.8Western blot检测JAK2/STAT3信号通路相关蛋白的表达:取1.2.2中各组细胞,弃去培养液,经蛋白水解液提取总蛋白并检测含量,随后将细胞置于98℃下煮沸10min使其变性后通过10% SDS-PAGE凝胶电泳进行分离,转膜。结束后加入脱脂牛奶封闭1h。加入p-JAK2、JAK2、p-STAT3、STAT3一抗(稀释浓度均为1∶1000),4℃孵育过夜,再于室温下加入二抗(稀释浓度为1∶2000)孵育1h,ECL试剂盒显色后,以GAPDH为内参蛋白,采用凝胶成像分析系统和Image J软件分析目的蛋白条带的灰度值,得到蛋白相对表达量。

2 结 果
2.1Pin对细胞毒性的影响:与0μmoL/L相比,20、40、60、80μmoL/L的Pin处理组的细胞存活率明显降低(P<0.05)。Pin处理KYSE-410细胞24h后的IC50为64.77μmoL/L。因此,本实验选择浓度为20、40、60μmoL/L作为后续实验中Pin低、中、高浓度组。见表1。
表1 Pin对细胞毒性的影响
2.2Pin对KYSE-410细胞存活率的影响:相较于KYSE-410组,Pin-L组、Pin-M组和Pin-H组细胞存活率均有不同程度的降低(P<0.05),而Pin-H+Broussonin E组细胞存活率高于Pin-H组(P<0.05),见表2。
表2 各组KYSE-410细胞存活率
2.3Pin对KYSE-410细胞克隆形成数量的影响:与KYSE-410组相比,Pin-L组、Pin-M组和Pin-H组细胞克隆数量减少(P<0.05),而Pin-H+Broussonin E组细胞克隆数量多于Pin-H组(P<0.05)。见图1和表3。
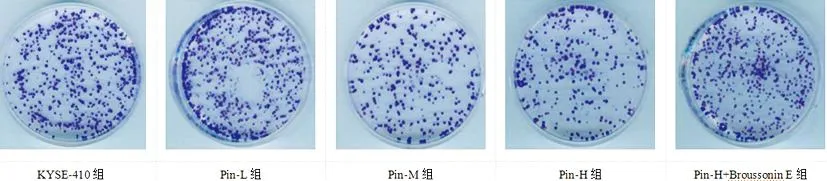
图1 各组KYSE-410细胞克隆形成能力

表3 各组KYSE-410细胞克隆形成数量
2.4Pin对KYSE-410细胞迁移及侵袭能力的影响:Pin-L组、Pin-M组和Pin-H组细胞的迁移及侵袭数量少于KYSE-410组(P<0.05),但Pin-H+Broussonin E组细胞的迁移及侵袭数量相较于Pin-H组增多(P<0.05)。见图2和表4。

图2 Transwell实验检测各组KYSE-410细胞的迁移和侵袭能力(×200)

表4 各组KYSE-410细胞迁移及侵袭数量
2.5Pin对KYSE-410细胞凋亡率的影响:Pin-L组、Pin-M组和Pin-H组细胞凋亡率高于KYSE-410组(P<0.05),而Pin-H+Broussonin E组细胞凋亡率低于Pin-H组(P<0.05)。见图3和表5。

图3 流式细胞术检测各组KYSE-410细胞凋亡情况

表5 各组KYSE-410细胞凋亡率
2.6各组细胞中JAK2/STAT3信号通路相关蛋白的表达水平:相较于KYSE-410组,Pin-L组、Pin-M组和Pin-H组细胞中p-JAK2/JAK2、p-STAT3/STAT3值降低(P<0.05),而Pin-H+Broussonin E组高于Pin-H组(P<0.05)。见图4和表6。

图4 各组KYSE-410细胞中JAK2/STAT3信号通路相关蛋白的表达条带

表6 各组KYSE-410细胞中JAK2/STAT3信号通路相关蛋白的表达水平
3 讨 论
食管鳞癌约占食管癌总数的95%,患者早期症状通常不具备特异性,容易出现误诊、漏诊等情况,而随着病情发展,患者出现吞咽困难、胸痛等症状就诊时,往往已处于食管癌中晚期,针对此类患者临床常采用手术以及放、化疗等治疗方式,但治疗效果较差,且后期容易发生复发及转移,威胁患者的生命健康。而目前食管鳞癌的发生机制尚不明确,并无明确治疗靶点,因此寻找能够调控食管鳞癌细胞恶性进展的信号通路及药物将有助于改善临床治疗效果及患者的预后状态[8]。
Pin是一种天然黄酮类化合物,主要从植物中分离提取,其作用于人体时无不良副作用,机体对Pin的耐受性较好,能够发挥抗炎、抗氧化和抗细胞凋亡等广泛的生物学功能[9]。而近来有学者发现,Pin还能够通过相关受体及信号通路来抑制卵巢癌、黑色素瘤等恶性肿瘤细胞的增殖和迁移,对细胞癌变也能起到抑制作用[10]。本研究结果显示,随着Pin浓度的增加,KYSE-410细胞的存活率、克隆细胞形成数量、迁移和侵袭细胞数量相较于KYSE-410组均有不同程度的降低,而细胞凋亡率逐渐升高。此结果初步提示,Pin能够对食管鳞癌细胞恶性进展起到抑制作用。为进一步了解Pin对食管鳞癌细胞的具体调控机制,继续对相关信号通路进行了探究。
JAK2/STAT3信号通路与细胞的生长、增殖等生理学活动密切相关,能够参与并调控炎性疾病、神经损伤等疾病的发生,不仅如此,JAK2/STAT3信号通路还能够调控癌细胞的增殖、迁移及侵袭,从而影响胃癌、胆囊癌等多种恶性肿瘤疾病的进展[11-12]。本研究结果显示,Pin-L组、Pin-M组和Pin-H组细胞中p-JAK2/JAK2、p-STAT3/STAT3值相较于KYSE-410组降低,提示Pin能够对JAK2/STAT3信号通路起到抑制作用。随后在高浓度Pin的基础上于培养基中添加了Broussonin E,结果显示,Broussonin E的加入逆转了Pin对食管鳞癌细胞恶性进展的抑制作用,且Pin-H+Broussonin E组细胞中p-JAK2/JAK2、p-STAT3/STAT3比值高于Pin-H组,表明Pin可能是通过抑制JA2K/STAT3信号通路来抑制食管鳞癌细胞的恶性进展。殷星等[13]的研究结果也显示,银杏内酯B能够通过阻遏JAK2/STAT3信号通路来实现对食管癌细胞增殖的抑制作用,这与本研究结果一致。
综上所述,Pin可能通过抑制JA2K/STAT3信号通路来抑制食管鳞癌细胞的恶性进展,此结果为临床提供了食管鳞癌治疗新靶点。但Pin对食管鳞癌细胞的调控作用可能还存在其他信号通路,后续将继续研究Pin对食管鳞癌细胞恶性进展的具体作用机制。
