溶血磷脂酰胆碱酰基转移酶3调控内皮细胞激活
2024-04-07张汉宁张成虎武宗寅
张汉宁,张成虎,武宗寅
1.山东第一医科大学(山东省医学科学院),山东济南 250117;2.山东第一医科大学(山东省医学科学院)附属济宁市第一人民医院心内科,山东济宁 272000
动脉粥样硬化是心血管疾病发生发展的主要致病因素,由于脂质在血管内膜下的沉积、炎症细胞的浸润,病因复杂,其发病机制和病理过程目前还没有完全被阐明[1];内皮细胞可以感受来自血液的各种机械信号和化学信号刺激,介导炎性反应,是心血管疾病发生的主要病理机制[2]。研究发现局部血流动力学改变在内皮细胞激活及动脉粥样硬化形成中起着重要作用[3]。
溶血磷脂酰胆碱酰基转移酶3(Lyso-PL Acyltransferases 3, LPCAT3)可以调控甘油磷脂sn-2位置的脂肪酸合成,催化多不饱和脂肪酸与磷脂的结合,参与磷脂重塑、内质网应激、炎症反应,进而可以调控细胞的功能[4]。前期天津医科大学的研究发现湍流通过调控Integrin α5-ANXA2信号轴引起内皮细胞激活,还可以通过抑制哺乳动物MST1的激酶活性介导动脉粥样硬化的形成[5-6]。基于LPCAT3调控磷脂重塑的重要作用,其是否可以参与内皮细胞激活还没有被研究,探究LPCAT3在内皮细胞激活以及动脉粥样硬化的作用具有重要意义。因此本研究于2020年11月—2023年6月在济宁市第一人民医院对5只C57BL/6雄性小鼠及原代人脐静脉内皮细胞进行实验研究,旨在探索LPCAT3在内皮细胞激活中作用。现报道如下。
1 材料与方法
1.1 材料
1.1.1 试剂 M199培养基(武汉普诺赛科技公司;PM150612)、胎牛血清(广州汉强生物科技公司;UB96728)、胰酶(美国Gibco公司;25200-056)、RNAiMAX转染试剂(美国ThermoFisher公司;13778075)、LPCAT3小分子干扰RNA(北京唯尚立德生物科技公司;序列CAAGUUCCUUGGAAAUAAATT)、mRNA提取试剂盒(广州Omega Bio-Tek公司;R6834)。
1.1.2 仪器 CO2细胞培养箱(美国Thermo公司)、PCR仪(美国Bio-rad公司)、实时荧光定量PCR仪(美国Bio-rad公司)、4℃离心机(美国Bio-rad公司)。
1.2 方法
1.2.1 动物模型的构建 5只8周龄雄性背景为C57BL/6的Wide-Type(WT)小鼠购自济南朋悦公司。小鼠在温湿度控制的环境中适应1周,按12 h的光-暗周期饲养,给予正常饮食,自由获取食物和水。1周后分离小鼠主动脉弓(Aortic Arch, AA)以及胸主动脉(Thoracic Aorta, TA)并提取组织的mRNA。动物实验均通过本院医学实验动物伦理委员会审查(JNMC-2021-PW-047)。
1.2.2 原代人脐静脉内皮细胞的培养与湍流模型构建 进行原代人脐静脉内皮细胞培养(以下简称内皮细胞)及湍流模型构建[7]。将培养的原代人脐静脉内皮细胞,随机分为对照组(Static)(n=3)和研究组(OSS)(n=3),研究组用阶梯式平板流体系统给予内皮细胞湍流(0.5±4)dyn/cm2处理12 h,最后将流体系统置于5%CO2、37℃细胞培养箱中运行,对照组静止处理12 h,与研究组一起置于5%CO2、37℃细胞培养箱。
1.2.3 SiRNA基因沉默 将内皮细胞分为沉默LPCAT3组(siLPCAT3)(n=3)与对照组(siNC)(n=3)。将内皮细胞铺于六孔板进行培养,细胞密度在75%左右进行转染;LPCAT3组每孔分别将转染试剂RNAimax、SiRNA-LPCAT3(10 μM)与Opti-MEM充分混匀并静置,对照组每孔分别将转染试剂RNAimax、阴性对照SiRNA(10 μM)与Opti-MEM充分混匀并静置;将复合物转染到相应处理孔,孵育6 h换液,24 h后收集细胞裂解液提取mRNA验证敲减效率。为了进一步研究LPCAT3在湍流介导的内皮细胞激活中作用,将内皮细胞分为siNC(n=3)、siLPCAT3(n=3)、OSS(n=3)、OSS+siLPCAT3(n=3)4组,分别给予SiRNA-LPCAT3转染12 h及湍流(0.5±4)dyn/cm2处理12 h,收集细胞裂解液。
1.2.4 mRNA的提取 按mRNA提取试剂盒(广州Omega Bio-Tek公司;R6834)步骤提取。
1.3 统计方法
本研究中收集的实验数据采用GraphPad Software分析、制图,mRNA表达水平以(±s)表示,两组间比较采用非配对t检验;4组间比较采用双因素方差分析,进一步两组组间比较采用邦弗朗尼(Bonferroni)后续检验。P<0.05为差异有统计学意义。
2 结果
2.1 湍流上调LPCAT3的mRNA表达水平
与对照组(Static)VCAM-1、ICAM-1、LPCAT3的相对mRNA表达水平(1.0±0.14)、(1.0±0.22)、(1.0±0.08)相比,研究组(OSS)(2.01±0.61)、(1.6±0.18)、(1.89±0.32)显著增加(见图1A),差异有统计学意义(P均<0.05);为了进一步验证湍流对于LPCAT3的影响,提取Wide Type小鼠AA(血流形式主要是湍流)以及TA组织的mRNA,结果表明AA其LPCAT3的相对mRNA水平(2.03±0.5)较TA(1.0±0.42)明显上调(见图1B),差异有统计学意义(P<0.05)。研究组内皮细胞LPCAT3的mRNA表达水平相比于对照组升高1.88倍,差异有统计学意义(P<0.05)。

图1 湍流上调LPCAT3的mRNA表达水平
2.2 LPCAT3沉默抑制湍流介导的内皮细胞激活
与对照组(siNC)内皮细胞(1±0.06)相比,沉默LPCAT3组(siLPCAT3)其mRNA表达水平(0.07±0.04)明显被抑制(见图2A),差异有统计学意义(P<0.001);siNC组(1.0±0.38)(1.0±0.29)与siLPCAT3组内皮细胞VCAM-1、ICAM-1的mRNA相对表达水平(0.96±0.41)(0.68±0.2)比较,,差异无统计学意义(P均>0.05)(见图2B、2C);对比研究组(OSS)(2.72±0.72)(3.04±0.56),OSS+siLPCAT3组内皮细胞VCAM-1、ICAM-1的mRNA相对表达水平(1.31±0.4)(1.81±0.51)显著降低(见图2B、2C),差异有统计学意义(P<0.001)。
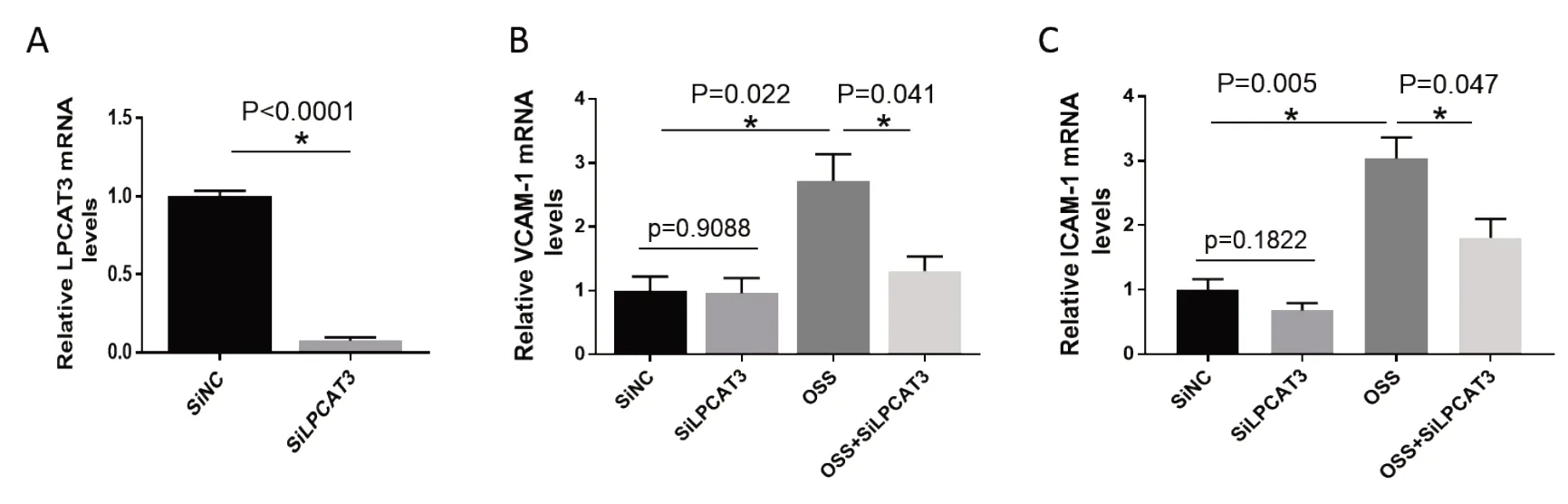
图2 LPCAT3沉默抑制湍流介导的内皮细胞激活
3 讨论
血管内皮细胞在动脉粥样硬化的发病过程中发挥着首要的作用,其在血管分叉处或弯曲处被激活,触发炎症反应,进而介导动脉粥样硬化的形成[8]。研究表明细胞外基质蛋白COMP与整合素锚定,通过湍流改变integrin的构象介导NF-κB激活[9];在湍流的作用下,ANXA2通过在内皮细胞中发生构象变化直接与整合素α5相互作用,促进整合素α5向质膜脂筏转运引起内皮细胞激活[5];最新研究表明湍流通过抑制MST1的激酶活性,使其对底物Cx43的磷酸化水平降低,引起Cx43介导的半通道开放,进而介导内皮细胞激活和动脉粥样硬化[6]。目前内皮细胞激活以及动脉粥样硬化的发病机制被广泛研究,但其病因复杂,具体发病机制还没有完全被阐明。本研究发现湍流可以促进LPCAT3的mRNA表达,说明LPCAT3在湍流引起的内皮细胞激活中可能发挥重要作用。
LPCAT3在细胞和组织中都广泛参与溶血磷脂酰转移酶的诸多生理过程,其可以调节不同磷脂酰胆碱种类的丰度,进而在脂代谢和生态稳定中发挥重要作用[10]。O.Demeure等[11]研究发现LPCAT3受肝脏X受体调控,参与肝脏和小肠脂蛋白生成,许多疾病的发展都与LPCAT3的促炎作用有关[12]。Jiang X等[13]研究显示,与对照组相比,SiNPs显著增加内皮细胞LPCAT3的mRNA表达,诱导内皮细胞发生铁死亡。吴思毅等[14]研究显示秦皮素通过减轻内皮细胞铁死亡,延缓高脂饮食小鼠动脉粥样硬化的发展。这些研究结果说明了内皮细胞中LPCAT3高表达可能与动脉粥样硬化形成密切相关。本研究显示,通过对比对照组LPCAT3的相对mRNA表达水平(1.0±0.08)与研究组(1.89±0.32)(P<0.05),发现湍流可以促进内皮细胞LPCAT3的mRNA表达。与小鼠胸主动脉LPCAT3的相对mRNA(1.0±0.42)比较,主动脉弓表达(2.03±0.5)明显升高(P<0.05),提示湍流在生理状态下同样会促进血管内皮LPCAT3的mRNA表达。对比研究组(OSS)VCAM-1、ICAM-1的相对mRNA表达水平(2.72±0.72)(3.04±0.56),OSS+siLPCAT3组为(1.31±0.4)(1.81±0.51)(P均<0.05),发现沉默LPCAT3能够明显抑制湍流介导的内皮细胞VCAM-1、ICAM-1的mRNA水平,这说明了湍流通过促进LPCAT3生成介导的内皮细胞激活。
越来越多的研究表明LPCAT3主要调节花生四烯酸-PC的水平,是游离花生四烯酸的主要调节因子,而游离花生四烯酸是动脉粥样硬化发生的重要因素[15-16]。湍流是否可以调节花生四烯酸-PC的丰度以及是否可以通过LPCAT3介导溶血磷脂酰胆碱以及花生四烯酸的表达目前还没有完全被揭示,因此还需要进一步研究湍流对于LPCAT3的调节是否会影响花生四烯酸-PC以及游离花生四烯酸的表达进而引起内皮细胞的激活以及动脉粥样硬化的形成。
综上所述,本研究证实湍流通过上调LPCAT3的表达介导内皮细胞的激活,可能为动脉粥样硬化的治疗和预防提供了新的干预靶点。
