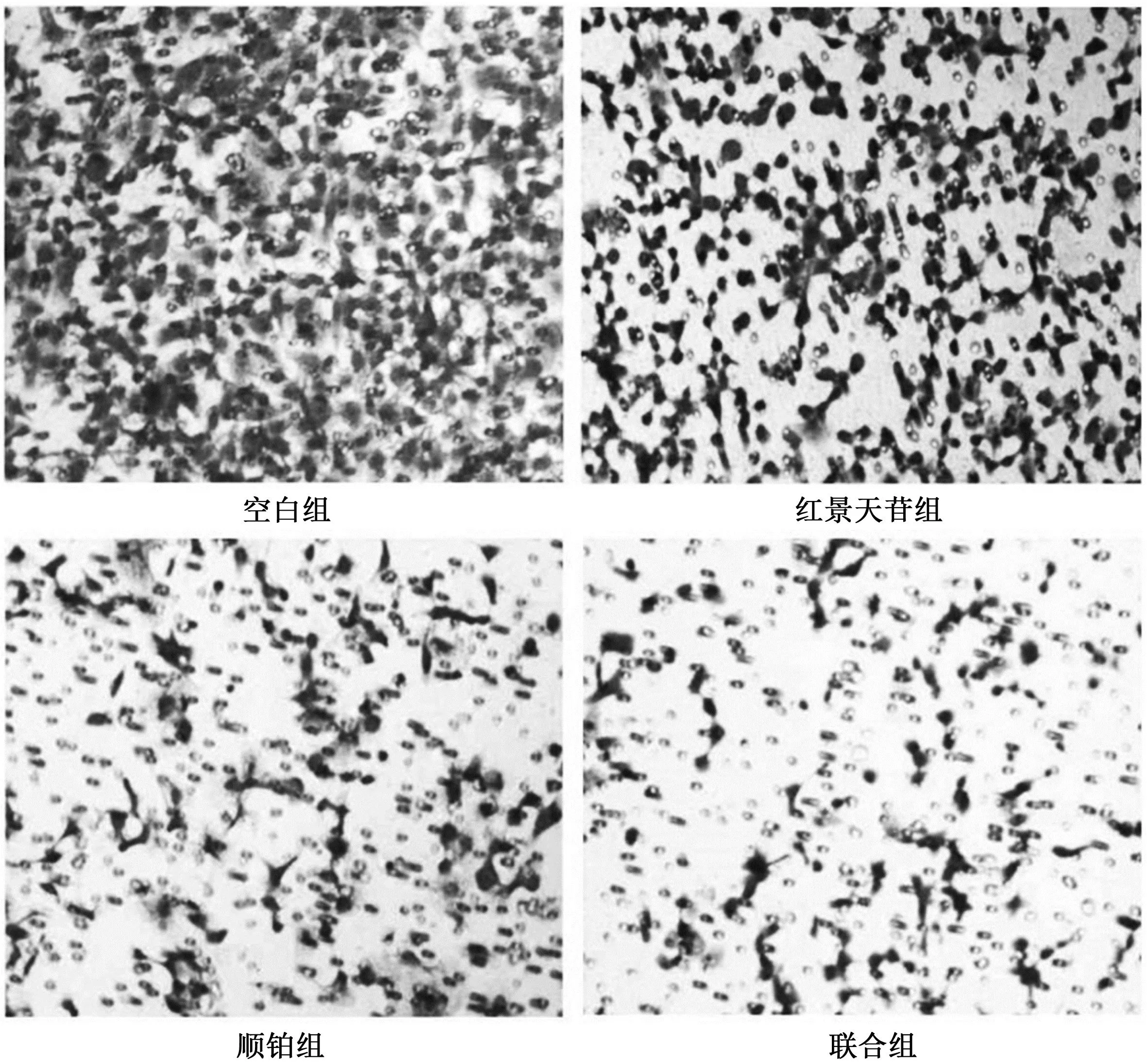
红景天苷联合顺铂对人胃癌HGC-27细胞生物学功能的抑制研究*
2024-04-03吴红艳尚学彬刘婷利蔚丹丹
吴红艳,尚学彬,刘婷利,蔚丹丹
(1.河南省职工医院消化内科,河南 郑州 450000; 2.郑州大学第一附属医院肿瘤科,河南 郑州 450000)
胃癌是发生于胃壁黏膜层上皮细胞的恶性肿瘤,发病率居恶性肿瘤第2位,病死率居第4位,是常见的消化系统癌症[1]。胃癌发病隐匿,早期诊断困难,大部分患者确诊时已属于中晚期。化疗是晚期胃癌最重要的治疗方式,但肿瘤细胞极易对化疗药物产生耐药性使治疗效果不佳[2]。因此,亟需开发具有抗癌效用且毒副作用低的药物。顺铂具有广谱抗肿瘤效用,临床疗效明显,单独用药或与其他药物联合使用已成为治疗恶性肿瘤的常用药物[3]。红景天苷是中药材红景天的主要活性成分,具有消炎、抗肿瘤、抗病毒和提高免疫力等药理作用[4]。近年来,多项研究报道,红景天苷可促进肿瘤细胞凋亡,抑制细胞活性,对肺癌、宫颈癌[4]和卵巢癌[5]等均有良好效用,但其作用机制尚不明确。本研究采用红景天苷与顺铂联合处理体外培养的胃癌细胞HGC-27,研究其通过磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路对胃癌细胞HGC-27增殖、迁移和侵袭的影响,从分子机制角度探讨其对胃癌细胞HGC-27生物学行为的抑制作用,以期为临床治疗胃癌提供参考依据。
1 材料与方法
1.1 细胞株
人胃癌细胞株HGC-27购于中国科学院上海细胞生物学研究所。
1.2 试剂与仪器
红景天苷,纯度98%,上海源叶生物科技有限公司产品,批号B20504;顺铂标准品,北京索莱宝科技有限公司产品,批号D8810;兔抗β-actin多克隆抗体、兔抗鼠PI3K、Akt、磷酸化Akt(phospho-Akt,p-Akt)、mTOR、磷酸化mTOR(phospho-mTOR,p-mTOR)、凋亡蛋白B细胞淋巴瘤因子-2(B-cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-associated X protein,Bax)多克隆抗体、山羊抗兔二抗免疫球蛋白G(immunoglobulin G,IgG),为北京雅安达生物科技有限公司产品,批号依次为BL005B、063578、80023、EIA06086H、l063572、20088、12228、2358412、H326551;RPMI细胞培养基、胎牛血清、胰蛋白酶,为杭州百莱博科技有限公司产品,批号4478359、A3161001C、25200114。BD FACSAria Ⅱ型流式细胞仪,上海实维实验仪器技术有限公司产品;CFX384 Touch型实时定量聚合酶链反应(polymerase chain reaction, PCR)仪,美国伯乐公司产品。
1.3 细胞培养
将人胃癌HGC-27细胞常规培养于RPMI-1640细胞培养基(含有100 mL /L胎牛血清、100 U/mL青霉素、100 mg/L链霉素),置于37 ℃、含有50 mL /L CO2饱和湿度的培养箱,隔天传代,选取对数生长期细胞进行实验。
1.4 细胞分组与给药
将人胃癌细胞分为空白组、红景天苷组、顺铂组和联合组,显微镜下确认细胞生长良好且密度适宜后加药。红景天苷组加入含有40 μmol/L红景天苷的培养液,顺铂组加入含有10 μmol/L顺铂的培养液,联合组加入含有40 μmol/L红景天苷和10 μmol/L顺铂的培养液,空白组为等量完全培养基,继续培养24 h。
1.5 检测指标
1.5.1 细胞活力
采用四甲基噻唑蓝(MTT)法检测。取对数生长期人胃癌HGC-27细胞进行实验,以2.5 g/L胰蛋白酶消化细胞,调整细胞浓度为1×105个/mL,将细胞悬液接种于96孔板,每孔100 μL,按照1.4项下方法给药并培养24 h。设置5个复孔,每孔加入20 μL MTT溶液,置入CO2培养箱中培养4 h。于酶联免疫检测仪540 nm处检测各孔吸光(OD)值。每组实验重复3次,计算细胞存活率。细胞存活率(%)=(实验组OD值/空白组OD值)×100%
1.5.2 细胞周期
采用流式细胞仪检测。用胰蛋白酶消化HGC-27细胞,制备细胞悬液(浓度为1×105个/mL),按照1.4项下方法给药并培养24 h。用预冷的磷酸盐缓冲溶液洗涤细胞3次,将细胞接种于6孔板内,体积分数为750 mL /L乙醇固定,加入10 μL碘化丙啶溶液避光孵育60 min。在波长488 nm处检测荧光强度,观察并分析细胞各周期分布情况。每组实验重复3次。
1.5.3 细胞迁移能力
采用划痕实验检测。使用标记笔于6孔板背后均匀画横线(间隔约5 mm),将人胃癌细胞(浓度调整为5×105个/mL)接种于6孔板中,按照1.4项下方法给药并培养24 h,待细胞铺满后使用200 μL无菌移液枪头对细胞垂直划线(1 mm × 20 mm),冲洗散落细胞继续培养,于0、24 h拍照并计算迁移率。每组实验重复3次。细胞迁移率(%)=(0 h边缘距离-24 h边缘距离)/0 h边缘距离
1.5.4 细胞侵袭能力
采用Transwell小室实验检测。将人胃癌HGC-27细胞按照1.4项下方法给药并培养24 h,接种于预铺基质胶稀释液的Transwell小室上室中(无血清培养液100 μL),细胞浓度为1×105个/mL;再将500 μL含血清培养液加入下室,恒温培育24 h。取出Transwell小室,磷酸盐缓冲溶液清洗3次,用40 g/L多聚甲醛固定20 min,滴加1 g/L结晶紫染液染色30 min,光学显微镜下拍照观察并计数细胞数目。每组实验重复3次。
1.5.5 PI3K、Akt和mTOR mRNA表达
采用实时PCR法检测。取对数生长期人胃癌HGC-27细胞,按照1.4项下方法给药并培养24 h,按照TRIzol试剂盒说明书操作提取总RNA,再进行反转录试剂盒合成互补DNA。配制PCR反应体系20 μL,设置反应条件:95 ℃预变性5 min,95 ℃变性25 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40次。根据2-△△CT法计算目的基因与内参基因的相对表达量。每组实验重复3次,引物序列见表1。

表1 引物序列
1.5.6 PI3K、Akt和mTOR蛋白表达
采用免疫蛋白印迹法检测。收集对数生长期人胃癌HGC-27细胞,按照1.4项下方法给药并培养24 h,接种于培养皿中,贴壁培养,加入500 μL 细胞裂解液提取总蛋白。蛋白定量法检测蛋白浓度,蛋白上样量40 μg,加入配制好的分离胶与浓缩胶,恒压80 V电泳至Marker条带分离清晰,恒压120 V电泳至溴酚蓝到达底部。转至聚偏氟乙烯膜上,加入5%脱脂奶粉摇床封闭2 h,TBST冲洗后加入1∶1 000稀释一抗,4 ℃孵育过夜,再次使用TBST冲洗后加入1∶3 000稀释二抗摇床封闭2 h,清洗,滴加化学发光剂显影。每组实验重复3次,采集图像,以β-actin为内参,观察并分析条带上相应的蛋白表达量。
1.6 统计学分析
2 结 果
2.1 各组细胞活力对比
与空白组对比,红景天苷组、顺铂组和联合组的人胃癌HGC-27细胞存活率均降低,差异有统计学意义(P<0.05)。与红景天苷组和顺铂组对比,联合组的细胞存活率降低(P<0.05)。红景天苷组的人胃癌HGC-27细胞存活率与顺铂组对比,差异无统计学意义(P>0.05)。见表2。
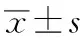
表2 各组人胃癌HGC-27细胞活力对比
2.2 各组细胞凋亡率对比
与空白组对比,红景天苷组、顺铂组和联合组人胃癌HGC-27细胞凋亡率均升高(P<0.05)。与红景天苷组和顺铂组对比,联合组人胃癌HGC-27细胞凋亡率升高(P<0.05)。红景天苷组人胃癌HGC-27细胞凋亡率与顺铂组对比,差异无统计学意义(P>0.05)。见表3、图1。

图1 各组胃癌HGC-27细胞凋亡对比
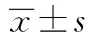
表3 各组人胃癌HGC-27细胞凋亡率对比
2.3 各组细胞迁移率对比
与空白组对比,红景天苷组、顺铂组和联合组人胃癌HGC-27细胞迁移率明显降低(P<0.05)。与红景天苷组和顺铂组对比,联合组人胃癌HGC-27细胞迁移率降低(P<0.05)。红景天苷组人胃癌HGC-27细胞活力与顺铂组对比,差异无统计学意义(P>0.05)。见表4、图2。
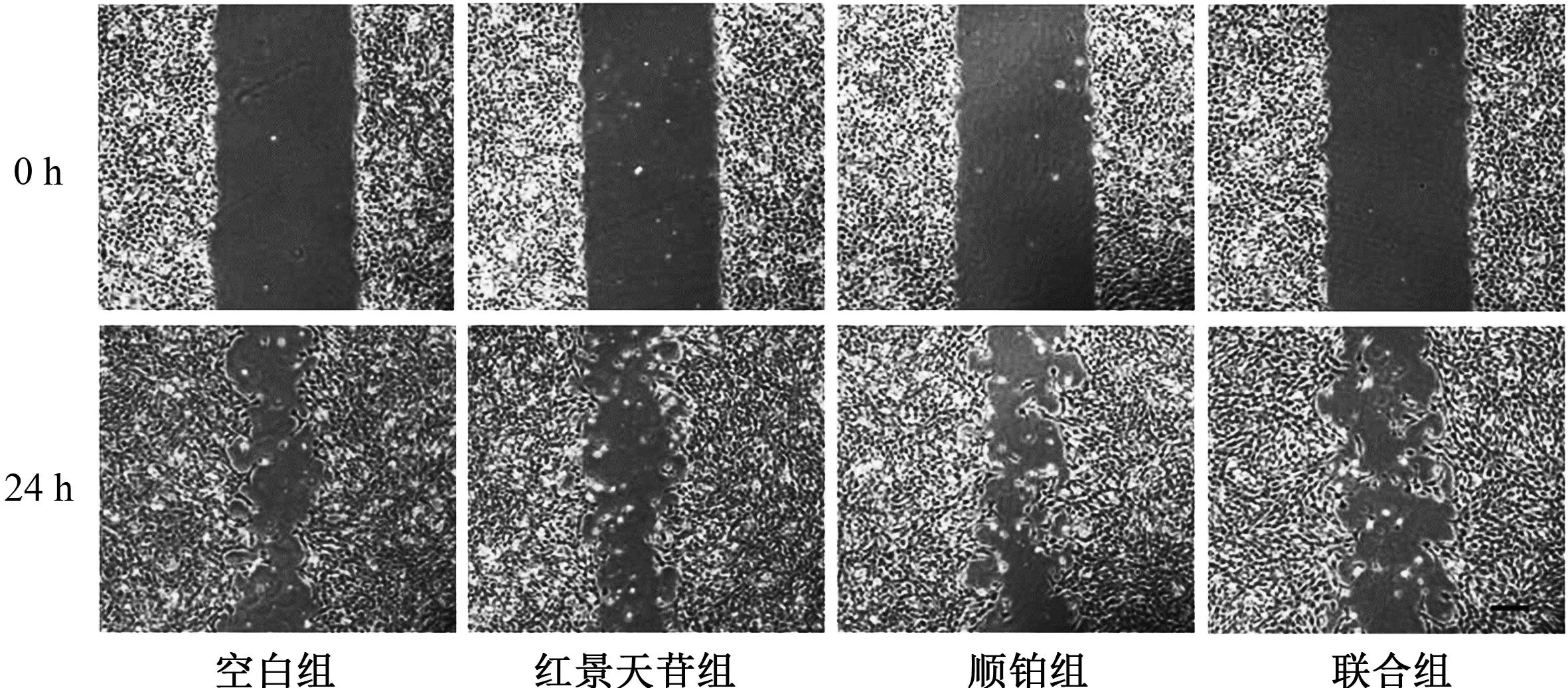
图2 各组人胃癌HGC-27细胞迁移情况(×200)
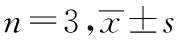
表4 各组人胃癌HGC-27细胞迁移率对比
2.4 各组侵袭细胞数目对比
与空白组对比,红景天苷组、顺铂组和联合组人胃癌HGC-27细胞侵袭数目明显减少(P<0.05)。与红景天苷组和顺铂组对比,联合组人胃癌HGC-27细胞侵袭数目减少(P<0.05)。红景天苷组人胃癌HGC-27细胞侵袭数目与顺铂组对比,差异无统计学意义(P>0.05)。见表5、图3。
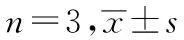
表5 各组人胃癌HGC-27细胞侵袭数目对比
空白组:受到侵袭的细胞数目最多。红景天苷和顺铂组:细胞侵袭数目明显减少。联合组:细胞侵袭数目最少。图3 各组人胃癌HGC-27细胞侵袭情况(结晶紫染色,×100)
2.5 各组PI3K、Akt、mTOR mRNA水平对比
与空白组对比,红景天苷组、顺铂组和联合组人胃癌HGC-27细胞中PI3K、Akt、mTOR mRNA水平明显降低(P<0.05)。与红景天苷组和顺铂组对比,联合组人胃癌HGC-27细胞中PI3K、Akt、mTOR mRNA水平降低(P<0.05)。红景天苷组人胃癌HGC-27细胞中PI3K、Akt、mTOR mRNA水平与顺铂组对比,差异无统计学意义(P>0.05)。见表6。
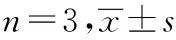
表6 各组人胃癌HGC-27细胞中PI3K mRNA、Akt mRNA和mTOR mRNA水平对比
2.6 各组PI3K、p-Akt/Akt、p-mTOR/mTOR水平对比
与空白组对比,红景天苷组、顺铂组和联合组人胃癌HGC-27细胞中PI3K、p-Akt/Akt、p-mTOR/mTOR水平明显降低(P<0.05)。与红景天苷组和顺铂组对比,联合组人胃癌HGC-27细胞中PI3K、p-Akt/Akt、p-mTOR/mTOR水平降低(P<0.05)。红景天苷组人胃癌HGC-27细胞中PI3K、p-Akt/Akt、p-mTOR/mTOR水平与顺铂组对比,差异无统计学意义(P>0.05)。见表7、图4。
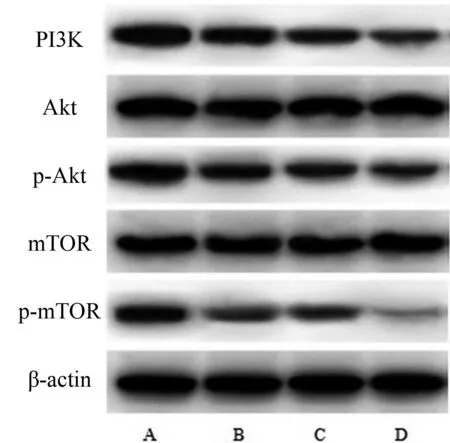
A.空白组;B.红景天苷组;C.顺铂组;D.联合组图4 各组人胃癌HGC-27细胞PI3K/Akt/mTOR通路蛋白Western blot条带图
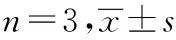
表7 各组人胃癌HGC-27细胞中PI3K、p-Akt/Akt、p-mTOR/mTOR水平对比
2.7 各组凋亡蛋白水平对比
与空白组对比,红景天苷组、顺铂组和联合组人胃癌HGC-27细胞中Bcl-2蛋白表达水平降低,Bax蛋白表达水平升高(P<0.05)。与红景天苷组和顺铂组对比,联合组人胃癌HGC-27细胞中Bcl-2蛋白表达水平降低,Bax蛋白表达水平升高(P<0.05)。红景天苷组人胃癌HGC-27细胞中Bcl-2、Bax蛋白表达水平与顺铂组对比,差异无统计学意义(P>0.05)。见表8、图5。
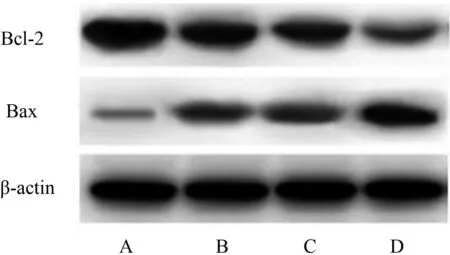
A.空白组;B.红景天苷组;C.顺铂组;D.联合组图5 各组HGC-27细胞凋亡蛋白Western blot条带图
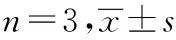
表8 各组人胃癌HGC-27细胞中Bcl-2、Bax蛋白表达水平对比
3 讨 论
目前胃癌的发病机制尚未明确,因早期症状多表现为烧心、进食后腹胀不适、剑突下隐痛、大便发黑等易被忽略的症状,常被患者忽略导致错过最佳治疗时期[6]。目前有手术、放疗、化疗和中药治疗等多种治疗方式,其中手术和放化疗虽效果明显,但有风险高和并发症多等弊端,抗肿瘤药物更是因毒副作用给患者带来很大压力。因此探究该病的发病机制,寻找更为有效且毒副作用小的药物对胃癌治疗有着重大意义。
顺铂可以抑制细胞增殖并促进凋亡,在多种恶性肿瘤的治疗中起着关键作用,与天然药物联用疗效显著[7]。红景天是景天科红景天属草本植物,属补虚药物,具有益气活血、通脉平喘、清肺止咳等功效[8-9]。红景天的有效成分包括红景天苷、苷元酪醇、红景天素等,其中红景天苷已被广泛用于抗肿瘤的研究中[10]。红景天苷可以通过激活肿瘤细胞自噬相关通路而提高自噬水平[11],调节ERK1/2信号通路抑制细胞增殖活性[12],从而发挥抗癌作用。本研究结果显示,在MTT实验、流式细胞术、划痕实验、Transwell小室实验中,红景天苷组、顺铂组和联合组细胞的细胞活力、细胞迁移率和侵袭细胞数与空白组对比均处于下降趋势,细胞凋亡率升高,提示红景天苷和顺铂抑制胃癌细胞HGC-27生长活性并促进其凋亡,两者联用时抑制作用更为明显。这与孙新利等[13]发现红景天苷可以抑制胃癌细胞增殖结论一致。
细胞凋亡过程是细胞内一系列基因的激活、表达及调控共同作用的结果,其中凋亡诱导因子与抗凋亡因子发挥重要作用。PI3K/Akt/mTOR信号通路是细胞内重要转导途径,参与细胞增殖、分化和凋亡等多种生物学功能,当其相关分子水平异常时对肿瘤细胞的发展与凋亡影响显著[14]。正常生理条件下,Akt并无活性,在受到信号刺激后其磷酸化蛋白高度表达,促进上游因子PI3K磷酸化高度表达并募集到细胞膜,激活下游mTOR蛋白,通过PI3K/Akt/mTOR信号通路提高凋亡因子Bal-2表达水平,并通过Bal-2/Bax比例影响抗凋亡因子Bax水平,从而提高肿瘤细胞生存活力,减少凋亡的发生[15]。研究发现,PI3K/Akt与胃癌细胞迁移和侵袭息息相关,抑制该信号通路可有效降低肿瘤转移[16];PI3K/Akt信号通路的异常激活与肿瘤的多种生物学行为有关[17]。在本研究中,与空白组对比,红景天苷组、顺铂组和联合组细胞中PI3K、Akt、mTOR mRNA表达水平及PI3K、p-Akt/Akt、p-mTOR/mTOR蛋白表达水平均降低,而凋亡蛋白Bal-2水平降低,抗凋亡蛋白Bax水平升高。表明红景天苷和顺铂可能通过抑制HGC-27细胞内Akt、mTOR蛋白磷酸化水平,阻断PI3K/Akt/mTOR信号通路,结合细胞中Bal-2、Bax蛋白表达水平,说明红景天苷和顺铂可以诱导胃癌细胞凋亡,与以上报道结果一致。
综上所述,红景天苷对胃癌细胞HGC-27增殖、迁移和侵袭有一定的抑制作用,并能有效促进细胞凋亡,联合顺铂可以提高疗效,可能是通过抑制Akt、mTOR蛋白磷酸化水平阻断PI3K/Akt/mTOR信号通路发挥作用。
