化学氧化法制备表层含CuO的超细铜线及其电化学腐蚀行为研究*
2024-04-01白嘉瑜
白嘉瑜,焦 华,2
(1.西安理工大学 材料科学与工程学院,西安 710048;2.西安理工大学 陕西省腐蚀与防护重点实验室,西安 710048)
0 前 言
近年来,随着煤炭、石油等传统能源价格的不断上涨,太阳能、风能、生物质能、地热能和海洋能等新能源领域的发展逐渐受到关注。其中,风力发电是目前可再生能源中技术发展最快、最成熟、最具大规模开发和商业化前景的发电方式[1-3]。
我国有丰富的海上风能资源和广阔平坦的区域,可利用的风能资源超过7.5亿kW,且距离电力负荷中心接近,使得近海风力发电技术成为研究和应用的热点[4]。线缆是将海上风电场与电网和储能设施连接起来重要中介装置,随着海上风电场的不断建设和发展,对于海用线缆的性能也提出了更高的要求[4-9]。
导体线芯是线缆用于输送电流或电磁波信息的主要载体构件,风电线缆用导体线芯采用GB/T 3956 规定的第5 类或第6 类软铜导线。通常,在高频电路情况下,为了提高电缆导线的柔软性,使用多股相互绝缘的细导线来代替同样截面积的粗导线。与单股线芯相比,多股线芯组成的电缆具有柔性好、趋肤效应小的特点,但是多股线使表面积大幅增加,存在抗腐蚀性能差的问题。此外,镀锡铜丝的锡层对减少趋肤效应有益,但其制备工艺复杂繁琐、成本高且污染环境。因此,开发一种耐腐蚀性良好、趋肤效应低、导电性能优良的新型超细铜线,成为国内外电缆行业的研究热点和难点之一。
在海洋气候的恶劣环境下,海用风电电缆长期运作于户外恶劣环境,由温度、湿度、盐度、空气、微生物干湿交替、冲击等主要因素引起的腐蚀问题非常严重[10]。因此,除了满足普通线缆的基本性能外,还要考虑海水腐蚀等因素的影响。针对海上风电等特殊场合,线缆产品依然依赖于进口,导致电力设备的制造加工成本大幅增加[11-12]。瑞士某企业开发了一款表面采用氧化铜制造、表面0 级漆膜绝缘的铜线,被广泛应用于海上风场且在国内市场长期处于垄断状态。为了突破国外技术的封锁和原材料的采购限制,加快研究和开发高质量的风电设备用线缆迫在眉睫。
相对于传统风电线缆用铜线,表层含CuO/Cu2O 的超细铜线的制备工艺简单,绿色环保,无二次污染,有助于节能减排。铜的氧化物CuO和Cu2O是带隙分别为2.0 eV和1.2 eV的典型P型半导体,可实现良好的可见光采集,以及它们的高丰度、低成本和无毒性质等优势,在光催化、超级电容器、太阳能电池、传感器、防污领域得到广泛应用[14-17]。因此,本研究采用化学氧化法制备了一种表面原位转化CuO/Cu2O的超细铜线,并讨论了溶液配比和反应时间对其物相、形貌和耐腐蚀性能的影响。
1 试验材料和方法
1.1 试验材料
本试验所采用的铜丝材是Φ0.5 mm 的T2 紫铜,其化学成分见表1,微观形貌如图1 所示。从表1 可以看出,其化学成分符合GB/T 5231—2012 规定。试验所使用的主要化学试剂包括NaOH和(NH4)2S2O8。

图1 试验用T2铜丝微观形貌
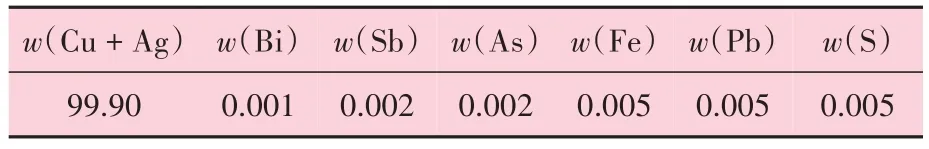
表1 试验用T2紫铜化学成分 %
1.2 试验方法
依次用12%稀盐酸、去离子水、无水乙醇对铜丝进行超声清洗15 min,后将其置于干燥箱中烘干备用。之后,依次采用800 目、1200 目、2000目的砂纸对等效面积的铜片(25 mm×15 mm×1 mm)进行打磨处理,打磨好的铜块进行无水乙醇超声清洗、干燥。然后,用化学氧化法将不同体积比的2.5 mol/L 的NaOH 溶液和0.2 mol/L 的(NH4)2S2O8溶 液 混 合 搅 拌0.5 h 至 溶液澄清。随后,将预清洁处理的铜丝或铜块置于上述溶液中,反应不同时间。最后,将反应后的铜丝材或铜片取出并依次用去离子水、无水乙醇反复冲洗后置于空气炉内,以300 ℃热处理一定时间。不同体系溶液制备工艺参数见表2。

表2 不同体系溶液制备工艺参数
1.3 性能表征
采用理学X射线衍射仪(XRD)对表层制备CuO/Cu2O 的超细铜丝材的物相组成进行分析。测试采用Cu Kα 射线,管电压为40 kV,管电流为20 mA,扫描速度为5 °/min,测试角度为 20°~80 °。采用扫描电子显微镜(SEM)表征样品表面的微观形貌。采用PARSTAT4000 电化学工作站在3.5%NaCl水溶液(pH 值为6.5~7.2)中对涂层进行电化学阻抗谱(EIS)和动电位极化曲线(PD)测试。其中,工作电极(WE)为1 cm2的涂层试样,辅助电极为1 cm2的铂网,参比电极(RE) 采用Ag/AgCl 电极(饱和氯化钾电极溶液)。
2 试验结果与讨论
2.1 溶液配比的影响
2.1.1 物相分析
图2 为铜丝在不同溶液配比(1∶0.5、1∶1、1∶1.5、1∶2)的2.5 mol/L 的NaOH 和0.2 mol/L 的(NH4)2S2O8混合溶液中反应、烧结后样品表面的XRD 谱图,由图2 可见,除了面心立方晶体Cu在43.3°、50.4°和74.1°处分别对应晶面(111)、(200)和(220)的三个典型衍射峰,铜丝材表面产生了单斜CuO 的衍射峰在36.7°、42.6°和61.8°处对应的晶面分别为(111)、(200)、(220)。随着(NH4)2S2O8体积比不断增加,CuO 在(111)晶面的衍射峰强度先增大后减弱,且在溶液体积比为1∶1 时,衍射峰强度最大;CuO 在(200)和(220)晶面的衍射峰强度出现同样的变化,在溶液体积比为1∶1 时,对应的衍射峰强度最大。Cu2O 的衍射峰在49.5°和73.7°处对应的晶面为(211)、(310),随着溶液体积比的不断变化,其衍射峰强度不断增大。图2表明不同体积比的碱性(NH4)2S2O8反应溶液对铜丝表面产生铜氧化物有显著影响。同时,在溶液配比为1∶1 时获得样品表面的铜氧化物的物相衍射强度相对最大。
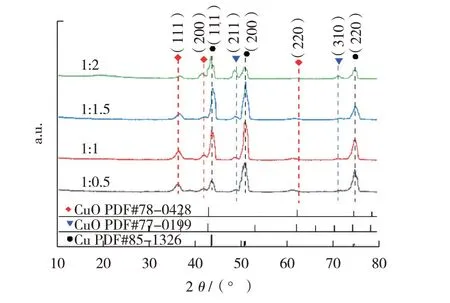
图2 不同溶液配比的表面含氧化铜的铜线XRD谱图
为进一步表征样品的表面铜氧化物的成分,2.5 mol/L 的NaOH 溶 液 和0.2 mol/L 的(NH4)2S2O8溶液配比为1∶1 混合溶液、1.0 h 烧结后铜丝表面的XPS 谱图如图3 所示。由图3 可见,样品中含有Cu、O、C 元素。图3(b)是样品的Cu2p图谱,可以看出,Cu2p 能级从位于953.58 eV 和934.75 eV 处的峰对应Cu2+氧化态特征的Cu2p1/2和Cu2p3/2,以及附近的震荡卫星峰Cu2p1/2和Cu2p3/2之间的双重结合能分离为19.8 eV,也证明了CuO 存在的迹象[18],以及位于957.5 eV 和934.75 eV 的峰属于Cu+。图2(c)为O1s 的精细谱,可以看出位于531.9 eV的峰属于Cu-O键的O。同时,观察到529.8 eV位置强烈的峰值,可能是表面吸附氧的存在。进一步表明了样品表面有两种价态Cu的存在,主要是CuO和少量的Cu2O。

图3 化学氧化法等体积溶液烧结铜丝XPS谱图
2.1.2 微观形貌
使用扫描电子显微镜研究了铜线表面CuO的微观结构和形貌特性。图4 是2.5 mol/L 的NaOH 和0.2 mol/L 的(NH4)2S2O8不 同 溶 液 配 比(1∶0.5、1∶1、1∶1.5、1∶2) 混合后和铜丝反应、烧结后表面的SEM 图。由图4 可以看出,在不同溶液配比下反应获得样品表面微观形貌呈现出相似形貌结构,以紧密堆积的片状结构组成,在尺寸大小和致密性上存在一些差异。图4(a)的微观形貌呈现为尺寸为400 nm左右的大片状结构堆积,分布均匀,局部区域的致密性较差。由图4(b)可以看出,其形貌为片状形貌结构,尺寸变小,约为200 nm,相对均匀密集分布,且致密程度良好。当溶液配比不断变化时,V3 样品表面片状结构尺寸大小为300 nm 左右,存在部分大尺寸结构,致密性降低。V4 表面形貌同样呈现以片状结构形貌且尺寸最小,其形成的表面粗糙度较大,局部均匀性和致密性下降。

图4 不同体积比影响的表面含氧化铜的铜线的微观形貌
2.1.3 电化学腐蚀行为
图5所示是不同体积比溶液制备的表面含有氧化铜的铜基体在3.5% NaCl 水溶液中的动电位极化曲线图。为了研究溶液配比对氧化层耐腐蚀性的影响,其相应的电化学参数通过外推法对曲线的Tafel区进行拟合,结果见表3,其中极化电阻(Rp)采用Stern-Geary方程确定,即
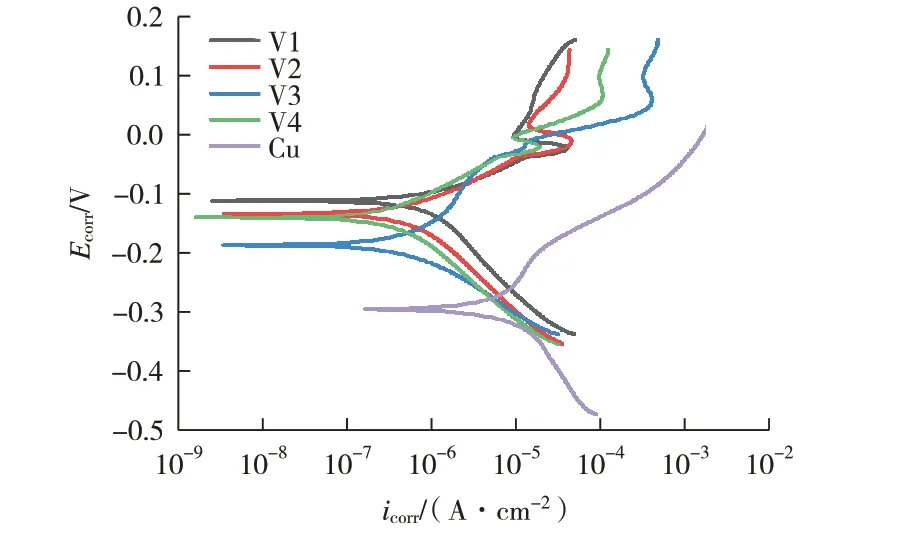
图5 溶液配比对铜表面氧化层影响的动电位极化曲线
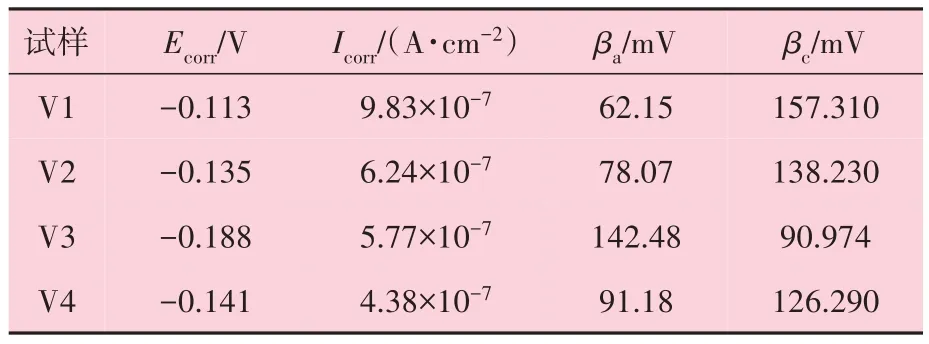
表3 动电位极化曲线拟合的电化学参数
式中:Rp——涂层的极化电阻,Ω·cm2;
Icorr——自腐蚀电流密度,A/cm;
βa——Tafel区阳极曲线的斜率,mV;
βc——Tafel区阴极曲线的斜率,mV。
对于腐蚀电位,自腐蚀电位Ecorr是一个热力学参数,Ecorr值越低并不一定意味着耐腐蚀性越差。自腐蚀电流密度Icorr是评价样品耐腐蚀性能更具决定性的参数[19]。通过图5 可以看出,所有涂层的Icorr都比基体的值小,自腐蚀电位Ecorr比基体的值大,说明制备的样品在3.5% NaCl 溶液中表现出了一定的耐腐蚀性。这是由于铜氧化物的化学稳定性相较于金属铜更低,不易与腐蚀介质发生反应。此外,表面氧化层的存在导致铜基体与腐蚀介质之间的接触面积更小,从而获得更小的腐蚀电流密度。
由表3电化学参数拟合结果可知,溶液体积比1∶1的V2样品,其Icorr值最小(4.87×10-7A/cm2),说明该样品的腐蚀速率最低。随着溶液配比的变化,相应样品的Icorr值出现先减小后增大的变化,表明样品的耐腐蚀性先变好后变差。可能是由于铜线和氢氧化钠、过硫酸铵混合溶液发生以下化学反应并通过后续热处理工艺后到得到铜氧化物。
在碱性溶液中,过硫酸盐作为一种强氧化剂,将铜基体氧化为Cu2+,释放的Cu2+随后与碱性溶液中OH-反应生成Cu(OH)2,中间产物Cu(OH)2在溶液中不稳定,与碱性溶液中OH-进一步反应得到Cu(OH)42-,并一部分转化为CuO。最后,通过热处理脱水将Cu(OH)2转化为氧化铜。然而,在不同溶液配比下可能形成铜氧化物不充分、不均匀,可导致其耐腐性下降。
为了进一步分析表面氧化层的耐腐蚀性能,进行了电化学阻抗试验,结果如图6 所示。图7为裸铜基体和表面含有氧化铜的铜基体采用的等效电路模型,在拟合电路中,Rs代表溶液电阻,Rct是代表电荷转移电阻。由于基体与电解质溶液界面的非理想电容响应,裸铜基体模型(图7(a))中的双电层电容被常相位元件(CPEdl)取代。溶液配比和反应时间影响的样模型(图7(b))中的Rc和CPEc 分别代表被常相位元件所取代的涂层电阻和涂层电容[20]。

图6 溶液体积比对铜表面氧化层影响的电化学阻抗试验

图7 等效电路模型
一般来说,在Nyquist 图中,高频范围内的容抗弧直径可以被认为是电荷转移电阻(Rct),是由电解质电阻以及电解质和电极界面处的电荷扩散的贡献。通过对电容环的直径大小和低频阻抗模量(|Z|)来估计涂层的耐腐蚀性,更大的电容环直径和更高的|Z|在低频区域意味着涂层具有更好的耐腐蚀性[20]。由图6可以看出,Nyquist图中所有样品的容抗弧比裸铜基体的大。同时,Bode 图中所有样品在低频(0.1 Hz)区的阻抗模量|Z|均明显大于裸铜基体,这表明所制备的表面含铜氧化物的铜基样品在3.5% NaCl 溶液中的耐腐蚀能力比裸铜基体强。此外,对比不同溶液配比所制备的样品的容抗弧半径和低频区的|Z|值,可以看出溶液体积比为1∶0.5和1∶1的V1和V2样品具有更大的容抗弧半径,低频区具有较高的|Z|值,表明在样品表面形成了一层保护膜阻碍了样品表面与腐蚀液之间的电荷传递,从而导致了样品表面的电荷转电阻增大[21]。同时,由于反应溶液配比的影响铜线材表面的氧化物形貌、粗糙程度、均匀性和致密性等,由其微观形貌(图3)在形态上致密性的差异也印证了这一点。图5的Tafel 曲线结果,与电化学阻抗谱测试的结果一致。然而,当溶液体积配比不断变化,其样品的容抗半径大小和阻抗模量|Z|值都相对最小,可能是由于铜表面氧化层形成本身的不均匀和缺陷,如缝隙、气孔等,影响其耐腐蚀性能。同时,对比图5和表3可看出,V4样品的动电位极化曲线右移,其Icorr值相对较大,Ecorr值较小,也表明了其腐蚀速度较快,耐蚀性较差。综合上述物相、微观形貌和电化学腐蚀性能的分析表征可以得出,在溶液配比为1∶1 时得到样品的耐腐蚀性能相对良好。因此,在后续试验中选取溶液配比为1:1 的反应溶液研究铜线材不同反应时间对耐腐蚀性能的影响。
2.2 反应时间的影响
2.2.1 物相分析
图8所示为2.5 mol/L的NaOH溶液和0.2 mol/L的(NH4)2S2O8溶液等体积混合后在不同浸渍时间(0.5 h、1.0 h、1.5 h、2.0 h)浸渍烧结后铜丝表面的XRD图谱。由图8可见,该铜丝表面产生了铜的氧化物,CuO 衍射峰在36.7°、42.6°和61.8°处对应晶面分别为(111)、(200)、(220),随着反应时间的不断增加,其衍射峰强度不断减弱。同时,在衍射角为49.5°和73.7°处对应Cu2O的衍射峰,随着反应时间的不断变化,其衍射峰强度不断增强。表明不同反应时间获得的样品表面均得到了铜的氧化物。然而,当反应时间为1.0 h时样品表面产生CuO的衍射峰强度相对更显著。此外,在XRD图谱中未见其他杂质的衍射峰存在。
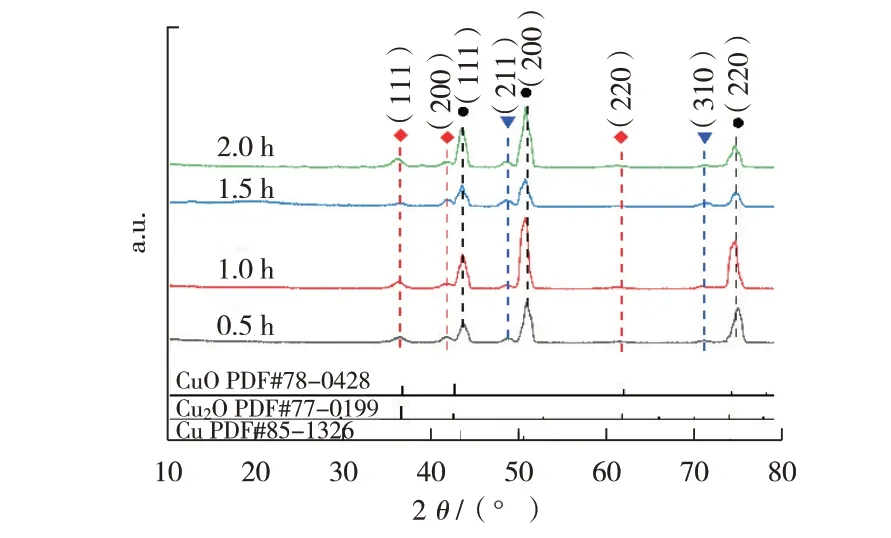
图8 不同反应时间下表面含氧化铜的铜线XRD谱图
2.2.2 微观形貌
图9所示为2.5 mol/L的NaOH溶液和0.2 mol/L的(NH4)2S2O8溶液等体积混合后和铜线在不同反应时间(0.5 h、1.0 h、1.5 h、2.0 h)浸渍烧结后铜丝材表面的SEM图片,由图9可以看出,反应时间0.5 h 时微观形貌是以尺寸大小均匀的片状结构密集堆积,其大小约为200~400 nm。当反应时间不断增大时,样品表面片状物质弥散分布形成平整表面,均匀性和致密性相对良好。当反应时间为2.0 h 时,其表面形貌凹凸不平,以片絮状物质结构分布,粗糙度增大,致密性降低。

图9 不同反应时间下表面含氧化铜的铜线微观形貌
2.2.3 电化学腐蚀行为
不同反应时间获得表面氧化层的铜试样在3.5% NaCl 溶液中的动电位极化曲线如图10 所示。对曲线的Tafel区进行拟合,结果见表4。由该图的动电位极化曲线可知,与裸铜基体相比,所有制备的表面含氧化铜的铜基体都具有低的Icorr值和高的Ecorr、Rp值,表明制备的样品的耐腐蚀性能相对良好。同时,当溶液反应时间不断增加时,所制备样品的Icorr值先减小后增大,而Ecorr呈现不断减小的趋势。通过对曲线的Tafel 区进行参数拟合可看出,当溶液反应时间为0.5 h时,T1 样品的Icorr为2.07×10-6A/cm2;当溶液反应时间为1.0 h 时,其样品的Icorr为6.93×10-7A/cm2,表明T2 样品具有最低的腐蚀速率,经过3.5%NaCl 水溶液的腐蚀后,样品的质量损失较小。
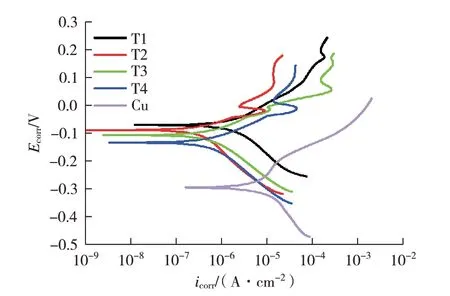
图10 反应时间对铜表面氧化层影响的动电位极化曲线
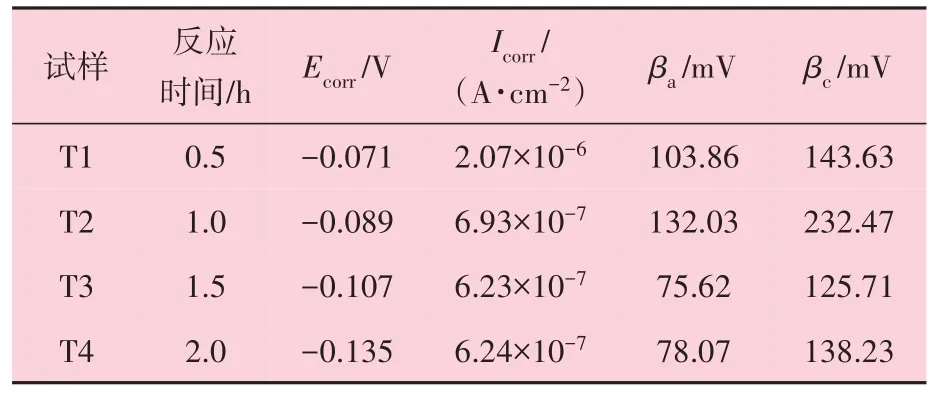
表4 动电位极化曲线拟合的电化学参数
为了进一步表征材料的耐腐蚀性能,对其进行电化学交流阻抗试验,图11 是不同反应时间制备的表面含有氧化铜的铜基体和裸铜基体的Nyquist 和Bode 图。由Nyquist 图可以看出,所有样品的容抗弧的直径均比裸铜基体的大,在Bode 图中所有样品在低频区的阻抗模量|Z|均明显大于裸铜基体,表明制备样品比裸铜基体在3.5% NaCl 溶液中的耐腐蚀能力强,说明了所制备的表面含铜氧化物的铜基体具有一定的耐腐蚀性能。此外,对比不同反应时间所制备的样品的容抗弧直径和低频区的|Z|值可知,在溶液反应时间为1.0 h 时,该样品具有更大的容抗弧半径和较高的|Z|值,表明样品反应时间为1.0 h 时的耐腐蚀性能更好。

图11 反应时间对铜表面氧化层影响的电化学交流阻抗试验
同时,随着反应时间的增大,对应的容抗弧直径明显先变大后变小,对应Bode 图的阻抗模量|Z|值出现同样的变化趋势。图11 的Tafel 曲线的结果,与电化学阻抗谱测试的结果一致。出现这种现象,是由于溶液和铜基材反应过程的初期其氧化产物并没有完成形成,导致铜线材表面氧化层具有不连续性和不均匀性。随着反应时间的增长,表面氧化层逐渐生成并导致表面形貌的粗糙度增加。此外,由微观形貌(图9)可以看出,表面形成的形貌具有不致密性、不均匀性,可能导致局部区域氧化层厚度的差异,甚至存在铜基体暴露在外的可能性。因此,在反应时间不断增大时,其样品的耐腐蚀性能呈现下降的趋势。
3 结 论
(1)采用化学氧化法在超细铜线表面制备氧化物CuO,研究了溶液配比和反应时间对物相分析、微观形貌和耐腐蚀性的影响。
(2)当氢氧化钠与过硫酸铵溶液配比为1∶1和铜线材反应1.0 h,经过1.0 h 热烧结后得到的样品表层物质主要是CuO,存在小部分的Cu2O,其表面微观形貌呈密集分布的片状结构,尺寸大小约300 nm。
(3)通过电化学腐蚀试验表征了样品表面氧化层的耐腐蚀性能。对比裸铜基体,超细铜线表面氧化膜具有一定的耐腐蚀性能。相对于裸铜,由于铜氧化物的化学稳定性良好,不易与电解液发生反应。因此,具有氧化层的样品具有较小的腐蚀速率。
