积雪草酸对实验性蛛网膜下腔出血大鼠脑损伤的保护作用
2024-04-01武潇潇胡玉鲲吴江
武潇潇 胡玉鲲 吴江


摘要:目的 探討积雪草酸(AA)对实验性蛛网膜下腔出血(SAH)大鼠脑损伤的神经保护作用。方法 将108只成年SD大鼠分为假手术(Sham)1组、SAH+Vehicle(空载)组与SAH+AA组,每组36只;42只大鼠分为Sham2组及SAH后3、6、12、24、48、72 h组,每组6只。除Sham组外,其余各组采用单侧颈外动脉线刺法建立SAH模型,造模后SAH+AA组灌胃AA溶液(30 mg/kg)。采用踏空实验和改良Garcia评分评估神经行为学改变,Western blot检测脑组织谷胱甘肽过氧化物酶4(GPX4)蛋白表达,酶联免疫吸附试验检测脑组织谷胱甘肽(GSH)和丙二醛(MDA)浓度,Fluoro-Jade B染色检测神经元死亡情况。结果 与Sham1组相比,SAH+Vehicle组踏空步数比例明显增多且改良Garcia评分明显降低,脑组织GPX4蛋白表达水平和GSH含量降低,MDA含量升高,死亡神经元数目增多(均P<0.05)。与SAH+Vehicle组相比,SAH+AA组踏空步数比例下降且改良Garcia评分升高,脑组织GPX4蛋白表达升高,MDA含量下降,GSH含量升高,死亡神经元数目明显下降(P<0.05)。结论 AA可能通过抑制脂质过氧化减轻大鼠SAH后的脑损伤。
关键词:积雪草酸;脂质过氧化;蛛网膜下腔出血;脑损伤
中图分类号:R743.35文献标志码:ADOI:10.11958/20231956
Protective effect of asiatic acid on brain injury after experimental subarachnoid
hemorrhage in rats
WU Xiaoxiao1, HU Yukun2, WU Jiang3△
1 Suzhou Medical College of Soochow University, Suzhou 215000, China; 2 the Affiliated Changshu Hospital of Nantong University; 3 the First Affiliated Hospital of Soochow University
△Corresponding Author E-mail: szjiangwu@163.com
Abstract: Objective To explore the neuroprotective effect of asiatic acid (AA) on brain damage after experimental subarachnoid hemorrhage (SAH) in rats. Methods A total of 108 adult SD rats were divided into the sham1 group, the SAH+vehicle group and the SAH+AA group, with 36 rats in each group. The 42 rats were divided into the sham2 group, 3, 6, 12, 24, 48 and 72 h after SAH groups, with 6 rats in each group. Except the sham group, SAH model was established by unilateral external carotid artery puncture method in other groups. After modeling, the SAH+AA group was given AA solution (30 mg/kg) by gavage. Neurobehavioral changes were assessed by foot fault test and modified Garcia score. Western blot assay was used to detect the protein level of glutathione peroxidase 4 (GPX4) in brain tissue. ELISA was used to detect the concentrations of glutathione (GSH) and malondialdehyde (MDA). Fluoro Jade B (FJB) staining was used to detect the neuronal death. Results Compared with the sham1 group, the SAH+vehicle group showed a significant increase in the proportion of empty steps and a significant decrease in the modified Garcia score, a significant decrease in GPX4 protein levels, a significant increase in MDA concentration (P<0.05), a decrease in GSH concentration (P<0.01) and a significant increase in the number of dead neurons (P<0.05). Compared with the SAH+vehicle group, a significant decrease in the proportion of empty steps, a significant increase in the modified Garcia score, a significant increase in GPX4 protein level, a significant decrease in MDA concentration, a significant increase in GSH concentration (P<0.05) and a significant decrease in the number of dead neurons in the SAH+AA group (P<0.05). Conclusion AA may reduce brain injury after SAH in rats by inhibiting lipid peroxidation.
Key words: asiatic acid; lipid peroxidation; subarachnoid hemorrhage; brain damage
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是出血性脑卒中的主要形式之一,也是一种致死致残率高的神经外科急重症[1-2]。目前已有大量实验研究证实SAH后神经损伤与氧化应激有关,是导致预后不良的主要病理改变[3-5]。积雪草酸(asiatic acid,AA)是热带植物积雪草中天然存在的五环三萜类化合物,具有强大的抗氧化和抗炎等广泛的生物活性[6-7]。已有研究证实,AA可以穿透血脑屏障,并在脑梗死等神经系统疾病中发挥神经保护作用[5,8]。本研究旨在探讨AA在SAH中的神经保护作用及可能机制,为改善SAH患者预后提供潜在的治疗途径。
1 材料与方法
1.1 材料
1.1.1 实验动物 150只SPF级成年健康雄性SD大鼠,8~10周龄,体质量280~330 g,购自昭衍新药研究中心有限公司,动物生产许可证号:SCXK(苏)2023-0004。大鼠以常规棒状颗粒饲料喂养,自由饮水,定期更换饲料,清理鼠笼,动物房温度18~22 ℃,维持昼夜循环。本研究过程中动物的使用符合《国家实验动物饲养和使用指南》的相关规定,实验及操作经过苏州大学附属第一医院医学伦理会批准(编号:2021伦审批第124号)。
1.1.2 主要试剂和仪器 AA(纯度98.23%)购自Aktin Chemicals公司,二甲基亚砜(DMSO)购自Sigma公司,兔抗鼠谷胱甘肽过氧化物酶4(glutathione peroxidase,GPX4)抗体(DF 6701)、磷酸甘油醛脱氢酶(GAPDH)抗体(AF 7021)购自Affinity公司,抗兔IgG抗体(7074S)购自Cell Signaling公司,丙二醛(MDA)酶联免疫吸附试验(ELISA)检测试剂盒购自同仁化学公司,谷胱甘肽(GSH)ELISA检测试剂盒购自BioVision公司,Western blot相关试剂购自上海碧云天生物技术有限公司,Fluoro-Jade B(FJB)粉末购自Biosensis公司。光学显微镜(SMZ745型)、荧光显微镜(DS-Ri2型)购自日本Nikon公司,多功能酶标仪(DR-200Bn型)购自无锡华卫德朗仪器有限公司。溶液配制:空载溶液为50 mL生理盐水+50 μL DMSO,AA溶液为50 mL生理盐水+50 μL DMSO+150 mg AA粉末。
1.2 方法
1.2.1 实验分组及大鼠SAH模型的建立 大鼠喂养1~2周后按照随机数字表法将108只大鼠分为假手术(Sham)1组、SAH+Vehicle组(溶剂对照)、SAH+AA组(给药),每组36只。剩余42只分为Sham2组及SAH后3、6、12、24、48、72 h组,每组6只。除Sham组外,其余组均采用单侧颈外动脉线刺法构建SAH模型。术前8 h禁食,称体质量后,使用4%水合氯醛溶液(10 mL/kg)腹腔注射麻醉。常规消毒备皮后将大鼠固定在动物实验台上,在颈部做纵向切口,分离肌肉和筋膜,暴露颈外动脉。头侧解剖并结扎颈外动脉远端,继续解剖并暴露颈总动脉和颈内动脉。悬吊颈内动脉以暂时阻断血流,用动脉夹夹住远端颈总动脉以阻断血流。用显微剪刀在颈外动脉残端上剪开一个破口,然后沿着破口插入线栓,直到栓线标记处到达颈内外动脉分叉口处再向内行进0.5~1.0 cm,直至感觉到突破;5 s后,拔出线栓,结扎颈外动脉残端,松开颈总动脉的动脉夹。观察血管的再灌注情况。缝合切口并进行术后护理[9]。Sham组仅结扎颈外动脉远端。
1.2.2 干预时间及给药方式 (1)干预时间:将Sham2组及SAH后3、6、12、24、48、72 h组的42只大鼠麻醉后处死,用150 mL PBS灌注心脏后完整取出脑组织,取颞底脑组织,置入IP细胞裂解液中充分裂解30 min。4 ℃、12 000 r/min离心10 min,分离上清液,使用BCA检测试剂盒测量上清液中蛋白质含量并平衡浓度。平衡后的样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,电泳后将目的蛋白转移至硝酸纤维素膜。封闭液封闭60 min,添加GPX4一抗(1∶1 000),在4 ℃孵育过夜。次日用PBST冲洗3次,添加抗兔IgG二抗(1∶2 000),在室温下孵育60 min。最后在显影仪上用增强化学发光法曝光,Image J软件测量目的条带的灰度值并计算GPX4蛋白相对表达量[10]。根据GPX4表达水平确定SAH后取材时间。
(2)给药方式:SAH+AA组大鼠在造模后按照30 mg/kg剂量[11]灌胃AA溶液(参与行为学实验大鼠在SAH后3 h给药,每隔24 h给药1次,共3次,其余实验大鼠在SAH后3 h给药,隔12 h给药1次,共2次)。SAH+Vehicle组在大鼠SAH造模3 h后通过灌胃给药,根据AA需要量计算相应计量给予空载溶液。Sham1组不予处理。
1.2.3 踏空实验 将大鼠置于升高的网格铁架上,网格大小为6 cm×6 cm。大鼠把爪子放在铁丝上,沿着格子移动。为了便于记录步态,从格子下方对大鼠进行录像。当神经受损的前肢负重时,可能会掉落到铁丝之间,即为踏空[12]。记录左侧前爪的踏空步数和总步数,计算踏空比例。大鼠于造模前3 d进行训练,每天3次,每次录像1 min,取平均值作为术前基础值。在建模后的第3、5、7、14天,每组取12只大鼠进行测试。
1.2.4 改良Garcia评分 大鼠于建模前1 d进行评分,每只大鼠测评3次,取平均值作为基线水平,在建模后第3、5、7天,每组取12只大鼠进行评估。改良Garcia评分用于评估SAH后大鼠的身体本体感觉、攀爬、前肢运动、触须侧转、肢体对称性以及自主运动6项,每项0~3分,总分18分;評分越高,代表神经功能越好[13]。
1.2.5 Western blot 各组取6只大鼠,在SAH后24 h处死,PBS灌注心脏后完整取出脑组织,参照1.2.2中步骤检测脑组织中GPX4表达。
1.2.6 脑组织Fluoro-Jade B(FJB)染色 各组取6只大鼠在SAH后24 h处死,PBS及4%多聚甲醛灌注心脏后完整取出脑组织,取含有颞底的整块脑组织制成石蜡切片。切片在70 ℃的烘箱中放置1 h,然后用二甲苯和乙醇水溶液对切片进行脱蜡。将切片置入0.06%的高锰酸钾溶液中15 min,然后用去离子水冲洗2 min,再浸入FJB工作液(0.1%乙酸)中浸泡30 min。然后将切片在50~60 ℃烘烤15 min,二甲苯透明,中性树胶封片。荧光显微镜下采用蓝色激发光(波长为450~490 nm)观察及图像采集[14],计数死亡神经元数量。
1.2.7 ELISA检测脑组织中MDA及GSH含量 各组取6只大鼠,在SAH后24 h处死,用PBS灌注心脏完整取出脑组织,PBS冲洗,每组取20 mg颞底脑组织采用微量板酶标法MDA的含量,根据检测试剂盒说明进行操作;同上方法处死大鼠后,取100 mg颞底脑组织,采用微量板酶标法检测GSH的含量,根据检测试剂盒说明进行操作。
1.3 统计学方法 采用GraphPad Prism 8.0.2软件进行数据分析。符合正态分布的计量资料以[x] ±s表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,SAH后不同时点指标比较采用重复测量资料的方差分析。以P<0.05为差异有统计学意义。
2 结果
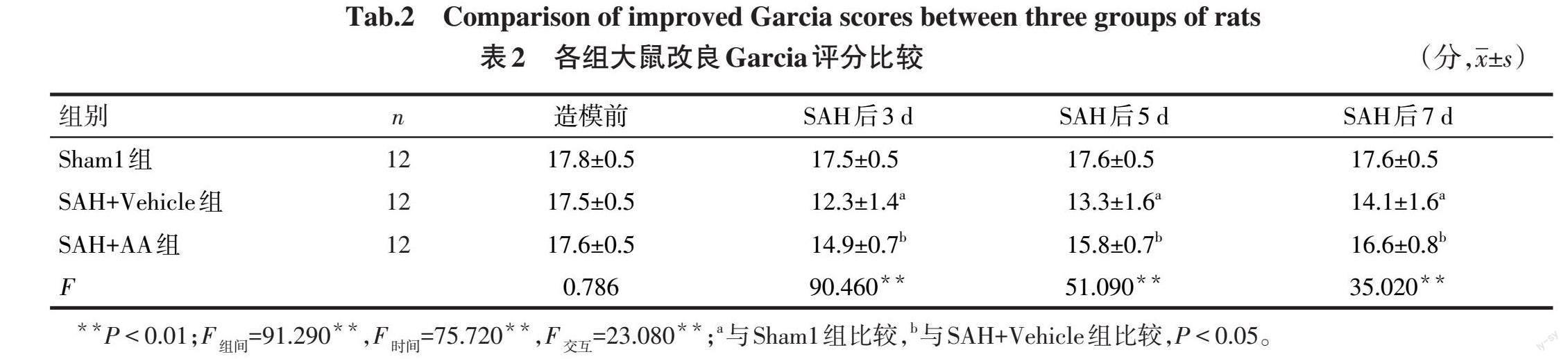
2.1 AA可提高大鼠SAH后行为学表现 与Sham1组相比,SAH+Vehicle组SAH后各时点踏空步数比例增多,改良Garcia评分降低(P<0.05),与SAH+Vehicle组相比,SAH+AA组踏空步数比例下降,改良Garcia评分升高(P<0.05),见表1、2。
2.2 SAH后脑组织中GPX4表达水平降低 Western blot结果显示,与Sham2组相比,SAH后24 h脑组织中GPX4蛋白表达明显下降,其他时间点差异无统計学意义,见图1。故选择SAH后24 h作为后续实验的取材时间点。
2.3 AA能够减少神经元死亡 见图2。FJB染色结果显示,Sham1组、SAH+Vehicle组、SAH+AA组变性神经元数量分别为(0.67±0.82)、(10.83±1.17)和(7.17±1.17)个/mm2,差异有统计学意义(n=6,F=140.300,P<0.01)。SAH+Vehicle组变性神经元数目较Sham1组增多(P<0.05),而相比SAH+Vehicle组,SAH+AA组中变性神经元出现减少(P<0.05)。
2.4 AA对脂质过氧化蛋白表达的影响 与Sham1组相比,SAH+Vehicle组大鼠脑组织中GPX4蛋白相对表达量和GSH含量降低,MDA含量升高(P<0.05)。与SAH+Vehicle组相比,SAH+AA组GPX4蛋白相对表达量和GSH含量升高,MDA含量下降(P<0.05),见图3、表3。
3 讨论
SAH是出血性脑卒中的一种致命亚型,它通常由颅内动脉瘤破裂导致[15]。目前已有大量针对SAH后神经损伤机制的研究,但是具体干预机制以及有效的治疗手段仍然相对有限[16]。AA作为天然植物中存在的成分,具有抗氧化、保护神经的功能[10,17]。研究发现AA可明显改善缺血性卒中后脑损伤[12]。因此,笔者推测AA可能对SAH同样具有神经保护作用。本研究通过在大鼠SAH后给予AA进行药物干预,观察其在改良Garcia评分、踏空实验等行为学测试中的表现,发现AA可有效改善大鼠SAH后的神经行为学功能损伤。本研究同时观察到AA能够有效减少SAH大鼠神经元的死亡,为SAH后脑损伤的治疗提供了一种新型的药物治疗思路。
研究已经表明,许多神经系统疾病中均有脂质过氧化的出现,并且对于调控神经元死亡具有重要作用[18],其中GSH、MDA以及GPX4则是脂质过氧化的重要标志物[19-20]。本研究发现,在SAH 24 h后大鼠脑组织中GPX4的含量明显下降,这也印证了SAH后脂质过氧化的发生。本研究进一步发现SAH后大鼠脑组织中MDA含量增加,GSH含量下降,确证了SAH后脂质过氧化的发生及其下游产物的堆积。给予AA干预后,脑组织GPX4及GSH的含量较前得到提升,MDA含量下降,死亡神经元数量减少,提示AA可能通过抑制脂质过氧化来减少大鼠SAH后神经元死亡,发挥神经保护作用。本研究探究了AA在SAH中的作用,为SAH后的治疗提供了新的思路方法。但本研究中尚存在着一些局限性,如仅简单验证了AA在大鼠SAH后的神经保护作用,具体的靶向蛋白及下游机制通路尚不明确;另外,GSH的耗竭、GPX4的失活以及MDA的堆积虽然是脂质过氧化发生过程中重要的一环,但根据上述指标的变化尚不能直接表明脂质过氧化的变化情况,疗效证据不足;再者,AA是否通过脂质过氧化以外的其他信号通路来改善大鼠SAH后神经损伤还需进一步明确。
参考文献
[1] SHAH R,WILKINS E,NICHOLS M,et al. Epidemiology report: trends in sex-specific cerebrovascular disease mortality in Europe based on WHO mortality data[J]. Eur Heart,2019,40(9):755-764. doi:10.1093/eurheartj/ehy378.
[2] GBD 2019 Stroke Collaborators. Global,regional,and national burden of stroke and its risk factors,1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol,2021,20(10):795-820. doi:10.1016/S1474-4422(21)00252-0.
[3] LI H,WU J,SHEN H,et al. Autophagy in hemorrhagic stroke:Mechanisms and clinical implications[J]. Prog Neurobiol,2018,163-164:79-97. doi:10.1016/j.pneurobio.2017.04.002.
[4] XU P,TAO C,ZHU Y,et al. TAK1 mediates neuronal pyroptosis in early brain injury after subarachnoid hemorrhage[J]. Neuroinflammation,2021,18(1):188. doi:10.1186/s12974-021-02226-8.
[5] KUSAKA G,ISHIKAWA M,NANDA A,et al. Signaling pathways for early brain injury after subarachnoid hemorrhage[J].Cereb Blood Flow Metab,2004,24(8):916-925. doi:10.1097/01.WCB.0000125886.48838.7E.
[6] NAGOOR MEERAN M F,GOYAL S N,SUCHAL K,et al. Pharmacological properties,molecular mechanisms,and pharmaceutical development of asiatic acid:a pentacyclic triterpenoid of therapeutic promise[J]. Front Pharmacol,2018,9:892. doi:10.3389/fphar.2018.00892.
[7] ZHENG X C,WANG S H. Determination of asiatic acid in beagle dog plasma after oral administration of Centella asiatica extract by precolumn derivatization RP-HPLC[J]. Chromatogr B Analyt Technol Biomed Life Sci,2009,877(5/6):477-481. doi:10.1016/j.jchromb.2008.11.045.
[8] LEE KY,BAE ON,SERFOZO K,et al. Asiatic acid attenuates infarct volume,mitochondrial dysfunction,and matrix metalloproteinase-9 induction after focal cerebral ischemia[J]. Stroke,2012,43(6):1632-1638. doi:10.1161/STROKEAHA. 111.639427.
[9] WANG X,WANG Z,WU J,et al. Thioredoxin 1 regulates the pentose phosphate pathway via ATM phosphorylation after experimental subarachnoid hemorrhage in rats[J]. Brain Res Bull,2022,185:162-173. doi:10.1016/j.brainresbull.2022.05.008.
[10] WANG L,WANG Z,YOU W,et al. Enhancing S-nitrosoglutathione reductase decreases S-nitrosylation of Drp1 and reduces neuronal apoptosis in experimental subarachnoid hemorrhage both in vivo and in vitro[J]. Brain Res Bull,2022,183:184-200. doi:10.1016/j.brainresbull.2022.03.010.
[11]WR?BEL A,ZAPA?A ?,KLUZ T,et al. The potential of asiatic acid in the reversion of cyclophosphamide-induced hemorrhagic cystitis in rats[J]. Int J Mol Sci,2021,22(11):5853. doi:10.3390/ijms22115853.
[12] YANG M F,SUN S Y,LV HG,et al. Ravoxertinib improves long-term neurologic deficits after experimental subarachnoid hemorrhage through early inhibition of ERK1/2[J]. ACS Omega,2023,8(22):19692-19704. doi:10.1021/acsomega.3c01296.
[13] LUCKE-WOLD B,DODD W,MOTWANI K,et al. Investigation and modulation of interleukin-6 following subarachnoid hemorrhage: targeting inflammatory activation for cerebral vasospasm[J]. Neuroinflammation,2022,19(1):228. doi:10.1186/s12974-022-02592-x.
[14] ZHANG J,YUAN G,LIANG T,et al. Nix plays a neuroprotective role in early brain injury after experimental subarachnoid hemorrhage in rats[J]. Front Neurosci,2020,14:245. doi:10.3389/fnins.2020.00245.
[15] 刘胜,李明昌.蛛网膜下腔出血的脑损伤机制及相关生物标志物研究进展[J]. 国际神经病学神经外科学杂志,2023,50(3):51-59. LIU S,LI M C. Research advances in the mechanism of brain injury and related biomarkers in spontaneous subarachnoid hemorrhage[J]. Journal of International Neurology and Neurosurgery,2023,50(3):51-59. doi:10.16636/j.cnki.jinn. 1673-2642.2023.03.011.
[16] 曹兵,丁奇,刘春江,等. 血清Nesfatin-1和MMP-9对动脉瘤性蛛网膜下腔出血预后的预测价值[J]. 天津医药,2020,48(2):119-123. CAO B,DING Q,LIU C J,et al. The prognostic value of serum Nesfatin-1 and MMP-9 in aneurysmal subarachnoid hemorrhage[J]. Tianjin Med J,2020,48(2):119-123. doi:10.11958/20192121.
[17] 胡方园,黄婉静,吴继红,等. 积雪草酸对原代大鼠视网膜神经节细胞低氧损伤的保护作用研究[J]. 中国眼耳鼻喉科杂志,2018,18(4):240-244. HU F Y,HUANG W J,WU J H,et al. Neuroprotection of asiatic acid to the hypoxic injury in rat primary retinal ganglion cells[J]. Chin J Ophthalmol and Otorhinolaryngol,2018,18(4):240-244. doi:10.14166/j.issn.1671-2420.2018.04.007.
[18] 毛权西,李作孝. 依达拉奉右莰醇通过铁死亡-脂质过氧化通路對脑出血大鼠神经保护的作用机制[J]. 天津医药,2023,51(11):1199-1205. MAO Q X,LI Z X. Neuroprotective mechanism of edaravone dexborneol in rats with cerebral hemorrhage through ferroptosis-lipid peroxidation pathway[J]. Tianjin Med J,2023,51(11):1199-1205. doi:10.11958/20221777.
[19] 李秋畅,闫顺昌,蒙亚珍,等. Nrf2-GPX4介导的铁死亡通路参与右美托咪定对脑出血大鼠神经保护作用的机制研究[J]. 天津医药,2022,50(8):817-821. LI Q C,YAN S C,MENG Y Z,et al. Neuroprotective effects of dexmedetomidine on intracerebral hemorrhage of rats by Nrf2-GPX4 mediated iron death pathway[J]. Tianjin Med J,2022,50(8):817-821. doi:10.11958/20212825.
[20] 陈玉,苏建军,韩允,等. 富马酸二甲酯调控Nrf2-GPX4介导的铁死亡途径对大鼠心肌缺血/再灌注损伤的保护作用研究[J]. 天津医药,2022,50(6):601-607. CHEN Y,SU J J,HAN Y,et al. Study on the protective effect of dimethyl fumarate on myocardial ischemia/reperfusion injury by regulating the iron death pathway mediated by Nrf2-GPX4 in rats[J]. Tianjin Med J,2022,50(6):601-607. doi:10.11958/20212639.
(2023-12-10收稿 2023-12-25修回)
(本文编辑 胡小宁)
