基于Nrf2/ARE抗氧化应激途径探究乌梅丸对溃疡性结肠炎小鼠的作用机制
2024-04-01陈静魏运姣罗超黄利华陈橙段莎莎
陈静 魏运姣 罗超 黄利华 陈橙 段莎莎


摘要:目的 探究烏梅丸基于核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)抗氧化应激途径对溃疡性结肠炎(UC)小鼠的作用机制。方法 将70只SPF级雄性C57BL/6小鼠随机分为对照组、UC组、美沙拉嗪组(MES组,0.82 g/kg MES)、乌梅丸低剂量组(WMW-L组,按生药5 g/kg)、乌梅丸中剂量组(WMW-M组,按生药10 g/kg)、乌梅丸高剂量组(WMW-H组,按生药20 g/kg)和乌梅丸高剂量+Nrf2抑制剂ML-385组(WMW-H+ML-385组,乌梅丸按生药20 g/kg+20 mg/kg ML-385),每组10只。末次给药后,对小鼠进行疾病活动指数(DAI)评分及结肠黏膜损伤评分。HE染色观察小鼠结肠黏膜组织的病理学变化。酶联免疫吸附试验(ELISA)测定小鼠血清和结肠组织白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、IL-6水平。硫代巴比妥酸比色法(TBA)测定小鼠血清和结肠组织丙二醛(MDA)含量。黄嘌呤氧化酶法测定小鼠血清和结肠组织超氧化物歧化酶(SOD)活性。二硫代二硝基苯甲酸(DTNB)直接法测定小鼠血清和结肠组织谷胱甘肽过氧化物酶(GSH-px)活力。免疫组织化学染色法观察小鼠结肠组织中Nrf2的阳性表达。Western blot检测小鼠结肠组织血红素加氧酶1(HO-1)和NAD(P)H:醌氧化还原酶1(NQO1)蛋白的表达情况。结果 与对照组相比,UC组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分升高,血清和结肠组织中IL-1β、TNF-α、IL-6、MDA水平升高,结肠组织Nrf2、HO-1、NQO1蛋白表达升高,血清和结肠组织中SOD、GSH-px水平降低(P<0.05),结肠黏膜损伤严重。与UC组相比,MES组、WMW-M组、WMW-H组小鼠相应指标变化与上述相反,而结肠组织Nrf2、HO-1、NQO1蛋白表达升高(P<0.05),结肠黏膜损伤减轻。WMW-L组、WMW-M组、WMW-H组各指标变化呈剂量依赖性。WMW-H组与MES组差异无统计学意义;ML-385减弱了高剂量乌梅丸对UC小鼠结肠黏膜损伤的改善作用。结论 乌梅丸可能通过激活Nrf2/ARE抗氧化应激途径减轻UC小鼠的结肠黏膜损伤。
关键词:结肠炎, 溃疡性;NF-E2相关因子2;抗氧化反应元件;氧化性应激;乌梅丸
中图分类号:R285.5文献标志码:ADOI:10.11958/20230533
The mechanism of Wumei pill on ulcerative colitis in mice based on Nrf2/ARE antioxidant stress pathway
CHEN Jing1, WEI Yunjiao2△, LUO Chao1, HUANG Lihua3, CHEN Cheng1, DUAN Shasha1
1 Department of Pediatrics, 2 Department of Pharmacy, 3 Department of Pathology, the Fourth Hospital of Wuhan,
Wuhan 430034, China
△Corresponding Author E-mail: grqxafrou5@163.com
Abstract: Objective To explore the mechanism of Wumei pill on ulcerative colitis (UC) in mice based on the anti oxidative stress pathway of nuclear factor erythroid 2-related factor 2 (Nrf2)/antioxidant response element (ARE). Methods Seventy SPF male C57BL/6 mice were randomly divided into the control group, the UC group, the mesalazine group (MES group, 0.82 g/kg MES), the low dose Wumei pill group (WMW-L group, 5 g/kg crude drug), the middle dose Wumei pill group (WMW-M group, 10 g/kg crude drug), the high dose Wumei pill group (WMW-H group, 20 g/kg crude drug) and the high dose Wumei pills+Nrf2 inhibitor ML-385 group (WMW-H+ML-385 group, Wumei pills crude drug 20 g/kg+20 mg/kg ML-385), with 10 rats in each group. The disease activity index (DAI) score and colonic mucosa injury score were performed in mice after the last administration. Pathological changes of colonic mucosa in mice were observed by HE staining. The levels of interleukin (IL) -1β, tumor necrosis factor-α (TNF-α) and IL-6 in serum and colon tissue of mice were measured by enzyme-linked immunosorbent assay (ELISA). The content of malondialdehyde (MDA) in serum and colon tissue of mice was determined by thiobarbituric acid colorimetry (TBA). The activity of superoxide dismutase (SOD) in serum and colon tissue of mice was measured by xanthine oxidase method. The activity of glutathione peroxidase (GSH-px) in serum and colon tissue of mice was determined by direct method with dithiodinitrobenzoic acid (DTNB). The positive expression of Nrf2 in colon tissue of mice was observed by immunohistochemistry. The expression of heme oxygenase-1 (HO-1) and NAD(P)H:quinone oxidoreductase-1 (NQO1) proteins in colon tissue of mice were detected by Western blot assay. Results Compared with the control group, the DAI score, colonic mucosa injury score, colonic histopathology score, levels of IL-1β, TNF-α, IL-6 and MDA in serum and colonic tissue, and expression levels of Nrf2, HO-1 and NQO1 protein in colonic tissue of mice were increased in the UC group, levels of SOD and GSH-px in serum and colon tissue decreased (P<0.05), the colon mucosa of mice was seriously damaged. Compared with the UC group, changes of corresponding indexes were contrary to the above in the MES group, the WMW-M group and the WMW-H group. However, the expression levels of Nrf2, HO-1 and NQO1 proteins in colon tissue were increased (P<0.05), and the damage of colon mucosa in mice was alleviated. Changes of the above indexes were dose-dependent in the WMW-L group, the WMW-M group and the WMW-H group. There were no significant differences in the above indexes between the WMW-H group and the MES group. ML-385 attenuated the improvement effect of high dose Wumei pill on colon mucosa injury. Conclusion Wumei pill may alleviate the colon mucosal damage of UC mice by activating Nrf2/ARE antioxidant stress pathway.
Key words: colitis, ulcerative; NF-E2-related factor 2; antioxidant response elements; oxidative stress; Wumei pill
溃疡性结肠炎(ulcerative colitis,UC)是一种非特异性的消化系统炎症性疾病,患者主要症状为腹泻、体质量下降、便血和肠道黏膜病理性损伤[1]。UC患者以青壮年人群多见,且难以痊愈、易复发[2-3]。由于UC的发病机制较为复杂,具体病因难以确定,因此探究UC的发病机制,寻找治疗UC安全、有效的药物成为临床研究的重点。研究显示,UC与氧化应激有着密切的联系,UC患者存在严重的氧化还原系统失衡[4-5]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)途径是一条重要的内源性抗氧化应激通路,Nrf2是帽领(cap‘ncollar,CNC)转录因子家族成员之一,是细胞抗氧化应激体系中的关键转录因子,能维持细胞氧化还原的稳态,当其与ARE结合时,在调节细胞抗氧化和抗炎基因的表达过程中具有重要作用[6-7]。乌梅丸来源于《伤寒论·厥阴病篇》,由乌梅、附子、干姜、细辛、川椒、桂枝、黄连、黄柏、人参、当归等十味中药组成,具有平调阴阳、和畅气血等功效,常用于治疗UC、心脑血管疾病、糖尿病、肿瘤等[8]。已有大量证据表明乌梅丸治疗UC具有显著的作用,但其作用机制尚未明确。有研究者认为可能与其多成分作用于多靶点,影响多个信号通路有关[9-10]。本研究建立UC小鼠模型,探究乌梅丸治疗UC的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 70只雄性C57BL/6小鼠,6周龄,SPF级,体质量18~20 g,购自湖北省实验动物研究中心,生产许可证号:SCXK(鄂)2020—0018。所有小鼠饲养在武汉大学动物实验中心[使用许可证号:SYXK(鄂)2019—0013]SPF级环境中,温度(22±2)℃、相对湿度50%~60%,人工光照黑暗循环12 h/12 h,小鼠自由获取食物和水。适应性饲养7 d后用于后续实验。本实验经我院动物伦理委员会批准(批准号:H20220923),实验过程符合3R原则。
1.1.2 主要药物制备 乌梅丸由本院中药房煎制,由乌梅16 g、细辛6 g、桂枝6 g、附子6 g、干姜10 g、川椒4 g、黄连16 g、黄柏6 g、人参6 g、当归4 g组成。以上药物中附子先煎0.5 h,其他药物加水浸泡0.5 h后加入,常规煎煮2次后混合、过滤、水浴、蒸发,制成1 g/mL(以生药含量计)的水煎液,4 ℃冰箱保存备用。美沙拉嗪缓释颗粒购自上海爱的发制药有限公司,研磨后用100目筛过筛,以蒸馏水溶解配制成0.041 g/mL的混悬药液,置于4 ℃储存。
1.1.3 主要试剂与仪器 葡聚糖硫酸钠(dextran sulfate sodium,DSS)购自美国MP Biomedicals公司;HE染色试剂盒购自北京索莱宝科技有限公司;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6酶联免疫吸附试验(ELISA)检测试剂盒购自碧云天生物技术有限公司;血红素加氧酶1(heme oxygenase 1,HO-1)、NAD(P)H:醌氧化还原酶1(quinone oxidoreductase-1,NQO1)、GAPDH、Nrf2一抗和羊抗兔IgG二抗購自Cell Signaling Technology公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-px)试剂盒购自南京建成生物研究所。凝胶成像仪、iMark多功能酶标仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 UC小鼠模型的建立 参照文献[11]方法和本实验室前期预实验结果,构建小鼠UC模型。造模前小鼠禁食24 h,不禁水。24 h后提起鼠尾将其悬空,使挣扎以排出大肠远端的粪便。随机抽取60只C57BL/6小鼠,自由饮用5%DSS溶液7 d制备UC模型,第8天全部更换为蒸馏水。当小鼠出现精神萎靡、食欲减退、懒动、体质量下降,逐渐出现黏液脓血便,则说明UC小鼠模型建立成功。
1.2.2 动物分组与给药 将成功造模的60只UC小鼠按随机数字表法分为UC组、美沙拉嗪组(MES组,0.82 g/kg MES)、乌梅丸低剂量组(WMW-L组,按生药5 g/kg)、乌梅丸中剂量组(WMW-M组,按生药10 g/kg)、乌梅丸高剂量组(WMW-H组,按生药20 g/kg)和乌梅丸高剂量+Nrf2抑制剂ML-385组(WMW-H+ML-385组,乌梅丸按生药20 g/kg+20 mg/kg ML-385[12]),每组10只。另10只未造模小鼠设为对照组,自由饮用蒸馏水。本实验剂量的设置根据前期预实验结果来确定。UC模型建立后MES组、WMW-L组、WMW-M组、WMW-H组按相应药物剂量灌胃乌梅丸和MES,并腹腔注射等量生理盐水;WMW-H+ML-385组灌胃相应剂量乌梅丸,腹腔注射ML-385;对照组和UC组灌胃和腹腔注射等量的生理盐水。每日1次,共14 d。
1.2.3 小鼠疾病活动指数(DAI)评分 末次给药后,根据小鼠体质量、大便性状及便血情况进行DAI评分[13]。0分:体质量无降低,大便性状正常,无便血;1分:体质量降低1%~5%,大便松散,大便隐血;2分:体质量降低6%~10%,大便松散,大便隐血;3分:体质量降低11%~15%,大便稀溏,肉眼血便;4分:体质量降低大于15%,大便稀溏,肉眼血便。
1.2.4 小鼠结肠黏膜损伤评分 末次给药后,所有小鼠禁食不禁水24 h,次日小鼠摘眼球取血,以3 000 r/min离心15 min,分离血清,分装后置-20 ℃冰箱保存待测。所有小鼠脱颈处死,立即解剖,取出肛门至盲肠末端的整个肠段,迅速沿着肠系膜纵轴剪开,用预冷生理盐水漂洗干净,然后将结肠平展开,观察肠黏膜的溃疡和炎症情况,对小鼠进行结肠黏膜损伤评分[14]。评分标准:0分,正常无损伤;1分,充血但没有溃疡;2分,充血且肠壁增厚,无溃疡;3分,1处较小溃疡灶,直径<1 cm;4分,较大溃疡,直径1~2 cm,无肠管与周边脏器粘连;5分:溃疡灶直径1~2 cm,但肠管增厚,且与邻近脏器严重粘连。之后将其剪成2部分,其中一部分放入-80 ℃保存,另一部分放入4%多聚甲醛固定,待制备病理切片。
1.2.5 HE染色观察小鼠结肠黏膜组织学变化 取1.2.4中多聚甲醛固定后的结肠组织,进行石蜡包埋、切片(5 μm),根据HE染色试剂盒说明书进行HE染色、封片,在光镜下(400倍)观察各组小鼠结肠的组织学改变情况,根据参考文献[15]的病理学评分标准进行病理学评分。
1.2.6 血清和结肠组织炎性因子、氧化指标的检测 取1.2.4中血清和冻存的结肠组织,结肠组织制备组织匀浆,匀浆以3 000 r/min离心10 min,取上清液,采用ELISA试剂盒检测血清和结肠组织中IL-1β、TNF-α、IL-6含量,严格按照试剂盒说明书进行操作。
硫代巴比妥酸比色法(TBA)测定小鼠血清和结肠组织MDA含量。取匀浆液或血清0.5 mL置于10 mL试管中,加入2 mL 0.6%TBA,用保鲜膜封口,扎一小孔后沸水浴15 min,取出后用流水冷却,1 000 r/min离心10 min,取上清液,采用酶标仪测定450 nm、532 nm和600 nm波长处的吸光度(A)值。CMDA=6.45×(A532-A600)-0.56×A450。
采用黄嘌呤氧化酶法测定小鼠血清和结肠组织SOD活性,二硫代二硝基苯甲酸(DTNB)直接法测定小鼠血清和结肠组织GSH-px活力,严格按照试剂盒说明书进行操作。
1.2.7 免疫组织化学染色检测小鼠结肠组织Nrf2蛋白表达 取1.2.5中制备的结肠组织切片,经过烤片、脱蜡、梯度乙醇脱水等操作后,使用枸橼酸溶液浸泡切片以修复抗原。3%过氧化氢孵育,10%胎牛血清室温下封闭。然后使用PBS清洗,根据免疫组化染色试剂盒说明书加入Nrf2一抗(1∶400),4 ℃过夜。次日经PBS洗涤后加入二抗,室温孵育30 min;再次使用PBS洗涤,加入DAB显色,苏木素复染,清水冲洗,透明,二甲苯挥发、封片。在显微镜下观察并拍照。棕褐色或棕黄色着色的为阳性细胞。
1.2.8 Western blot法检测小鼠结肠组织HO-1、NQO1蛋白的表达 用RIPA裂解液提取1.2.4中冻存的结肠组织总蛋白,并根据BCA蛋白定量检测试剂盒对蛋白进行定量。用凝胶电泳分离蛋白质,并进行PVDF转膜。用5%脱脂奶粉封闭后,将膜与HO-1(1∶1 000)、NQO1(1∶1 000)、GAPDH(1∶1 000)一抗在4 ℃下孵育过夜。次日,在常温下加入相应二抗(1∶5 000),继续孵育2 h,加入ECL试剂进行显色,在凝胶成像仪下进行曝光,以GAPDH蛋白作为内参,利用Image Lab软件对目标蛋白的灰度值进行计算。
1.3 统计学方法 应用Graph Pad Prism 7.0软件进行数据分析。符合正态分布的计量资料以均数±标准差([[x] ±s])表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
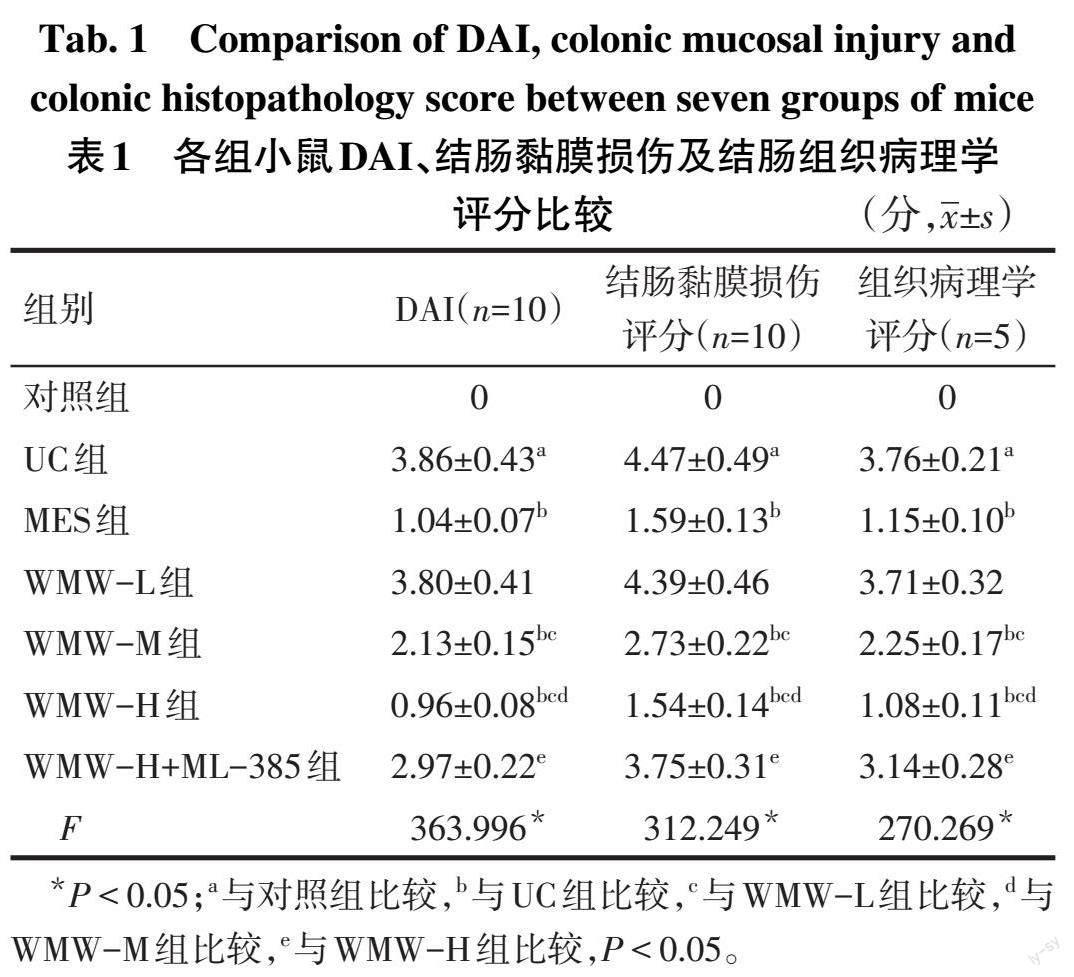
2.1 各组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分比较 与对照组相比,UC组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分升高(P<0.05);与UC组相比,MES组、WMW-M组、WMW-H组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分下降(P<0.05),WMW-L组变化差异无统计学意义(P>0.05);WMW-L组、WMW-M组、WMW-H组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分依次降低(P<0.05);WMW-H组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分低于WMW-H+ML-385组(P<0.05),与MES组差异无统计学意义(P>0.05),见表1。
2.2 各组小鼠结肠组织病理学改变 对照组小鼠结肠组织结构正常,层次分明,腺体排列有序,黏膜、固有层、肌层未见明显异常。与对照组相比,UC组小鼠结肠组织隐窝结构丢失、杯状细胞减少,溃疡形成,伴有大量炎性细胞浸润。与UC组相比,MES组、WMW-M组、WMW-H组小鼠结肠组织隐窝结构破坏减轻,上皮结构和杯状细胞结构相对完整,炎性细胞浸润减少;WMW-L组、WMW-M组、WMW-H组结肠组织损伤依次减轻。WMW-H+ML-385组结肠组织损伤较WMW-H组加重。见图1。
2.3 各组小鼠血清和结肠组织炎性因子比较 与对照组相比,UC组小鼠血清和结肠组织中IL-1β、TNF-α、IL-6水平升高(P<0.05)。与UC组相比,MES组、WMW-M组、WMW-H组小鼠血清和结肠组织中IL-1β、TNF-α、IL-6水平降低(P<0.05),WMW-L组无明显变化(P>0.05)。WMW-L组、WMW-M组、WMW-H组小鼠血清和结肠组织中IL-1β、TNF-α、IL-6水平依次降低(P<0.05);WMW-H组小鼠血清和结肠组织中IL-1β、TNF-α、IL-6水平低于WMW-H+ML-385组(P<0.05),与MES组差异无统计学意义(P>0.05),见表2。
2.4 各组小鼠血清和结肠组织氧化应激指标比较 与对照组相比,UC组小鼠血清和结肠组织中SOD、GSH-px水平降低,MDA水平升高(P<0.05)。与UC组相比,MES组、WMW-M组、WMW-H组小鼠血清和结肠组织中SOD、GSH-px水平升高,MDA水平降低(P<0.05),WMW-L组无明显变化(P>0.05)。WMW-L组、WMW-M组、WMW-H组小鼠血清和结肠组织中SOD、GSH-px水平依次升高,MDA水平依次降低(P<0.05);WMW-H组小鼠血清和結肠组织中SOD、GSH-px水平高于WMW-H+ML-385组,MDA水平低于WMW-H+ML-385组(P<0.05),小鼠血清和结肠组织SOD、MDA、GSH-px水平与MES组差异无统计学意义(P>0.05),见表3。
2.5 各組小鼠结肠组织中Nrf2、HO-1、NQO1蛋白表达水平比较 与对照组相比,UC组小鼠结肠组织Nrf2、HO-1、NQO1蛋白表达升高(P<0.05)。与UC组相比,MES组、WMW-M组、WMW-H组小鼠结肠组织Nrf2、HO-1、NQO1蛋白表达升高(P<0.05),WMW-L组无明显变化(P>0.05)。WMW-L组、WMW-M组、WMW-H组小鼠结肠组织Nrf2、HO-1、NQO1蛋白表达依次升高(P<0.05);WMW-H组小鼠结肠组织Nrf2、HO-1、NQO1蛋白表达高于WMW-H+ML-385组(P<0.05),与MES组差异无统计学意义(P>0.05),见图2—5。
3 讨论
UC的发病原因目前尚未明确,研究认为UC的发生发展与环境、遗传、免疫、精神心理等因素密切相关[16]。研究显示,在全世界范围内UC的患病率较高[17]。目前临床治疗UC一般采取控制炎症、抑制免疫反应等手段为主。本研究采取DSS诱导小鼠发生UC,这种建模方法与人类患UC相似,造模方法简便,成功率高,是研究UC常用的模型。氧化应激与UC的发病密切相关,是UC重要的发病机制之一。SOD、GSH-px水平降低和MDA水平升高标志体内氧化应激反应的过度激活,能客观反映机体脂质过氧化反应对组织的损伤程度[18]。本研究结果显示,与对照组相比,UC组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分、血清和结肠组织中IL-1β、TNF-α、IL-6及SOD、GSH-px水平均升高,MDA水平降低,与蒋晓梅等[14]研究结果一致,提示DSS可诱导小鼠发生结肠炎性损伤和氧化应激损伤,UC小鼠模型构建成功。
乌梅丸是中医中“寒热并用、温清结合、敛肺固涩”的代表方,方中重用味酸之乌梅,取其酸主收涩,可涩肠止泻;川椒、细辛、附子、桂枝、干姜均为辛热之品,既可温中祛寒,又可温肾暖脾而助运;黄连、黄柏味苦性寒,苦能下蛔,寒能清热,可清热燥湿止痢,人参、当归益气补血,扶助正气,且合桂枝养血通脉,调和阴阳以解四肢厥冷。全方组寒热并用,邪正兼顾,攻补兼施,通理气血,调和三焦,共奏温中补虚、清热燥湿止痢之功效[19-20]。乌梅丸对UC具有显著的治疗效果。研究发现,乌梅丸对2,4,6-三硝基苯磺酸诱导的UC模型大鼠具有显著的调节作用,且可通过抑制Toll样受体/核转录因子-κB/髓样分化因子8(TLRs/NF-κB/myD88)信号通路的活化降低促炎细胞因子的表达,减少炎性因子释放,从而减轻UC反应[21-22]。本研究结果显示,与UC组相比,WMW-M组、WMW-H组小鼠DAI评分、结肠黏膜损伤评分、结肠组织病理学评分、血清和结肠组织中IL-1β、TNF-α、IL-6、MDA水平显降低,血清和结肠组织中SOD、GSH-px水平显著升高;与上述研究一致,说明使用乌梅丸对UC小鼠结肠黏膜损伤的修复作用比自然修复效果好,提示乌梅丸,尤其是高剂量乌梅丸可以减轻UC小鼠的结肠黏膜损伤,其机制与降低炎症反应、改善氧化应激水平有关。
正常生理状态下,Nrf2存在于细胞质中且处于失活状态。当细胞受到炎症、紫外线辐射或氧化应激等刺激时,Nrf2活化从细胞质中转位进入细胞核,与ARE结合,并激活ARE下游一系列抗氧化基因的表达,诱导GSH-px、SOD等多种抗氧化酶及Ⅱ相解毒酶(如HO-1、NQO1)的产生,从而加速清除氧自由基等氧化物质,维持细胞内的氧化还原平衡,减轻机体损伤[23]。林培琦等[24]研究发现Nrf2/ARE信号通路的激活能减轻DNA损伤、促进受损DNA的修复和抑制放射诱导的细胞凋亡,减轻放射治疗中的组织损伤。Ma等[25]研究发现Farrerol通过激活Nrf2/ARE信号通路,有效抑制了顺铂诱导的炎症和肾纤维化,为急性肾损伤的治疗提供了新的潜在靶点。本研究结果显示,与UC组相比,MES组、WMW-M组、WMW-H组小鼠结肠组织Nrf2、HO-1、NQO1蛋白表达显著升高;WMW-L组、WMW-M组、WMW-H组各指标变化呈剂量依赖性。提示乌梅丸可能通过激活Nrf2/ARE抗氧化应激途径减轻UC小鼠的结肠黏膜损伤。为验证此猜想,本研究采用Nrf2抑制剂ML-385来干预高剂量乌梅丸组,结果发现ML-385减弱了乌梅丸对UC小鼠结肠黏膜损伤的改善作用,提示乌梅丸对UC小鼠结肠黏膜损伤的改善作用与激活Nrf2/ARE抗氧化应激途径相关。
综上所述,乌梅丸可能通过激活Nrf2/ARE抗氧化应激途径减轻UC小鼠的结肠黏膜损伤。本研究为UC的靶向治疗和发病机制研究提供了新的依据。然而,乌梅丸是否通过其他途径和分子机制治疗UC尚待进一步探究。
参考文献
[1] WIRTZ S,POPP V,KINDERMANN M,et al. Chemically induced mouse models of acute and chronic intestinal inflammation[J]. Nat Protoc,2017,12(7):1295-1309. doi:10.1038/nprot.2017.044.
[2] KUCHARZIK T,KOLETZKO S,KANNENGIESSER K,et al. Ulcerative colitis-diagnostic and therapeutic algorithms[J]. Dtsch Arztebl Int,2020,117(33/34):564-574. doi:10.3238/arztebl.
2020.0564.
[3] DU L,HA C. Epidemiology and pathogenesis of ulcerative colitis[J]. Gastroenterol Clin North Am,2020,49(4):643-654. doi:10.1016/j.gtc.2020.07.005.
[4] ELMAKSOUD H A A,MOTAWEA M H,DESOKY A A,et al. Hydroxytyrosol alleviate intestinal inflammation,oxidative stress and apoptosis resulted in ulcerative colitis[J]. Biomed Pharmacother,2021,142:112073. doi:10.1016/j.biopha.2021.112073.
[5] CHEN S,WU X,YU Z. Juglone suppresses inflammation and oxidative stress in colitis mice[J]. Front Immunol,2021,12:674341. doi:10.3389/fimmu.2021.674341.
[6] HOU Y,LI X,PENG S,et al. Lipoamide ameliorates oxidative stress via induction of Nrf2/ARE signaling pathway in PC12 cells[J]. J Agric Food Chem,2019,67(29):8227-8234. doi:10.1021/acs.jafc.9b02680.
[7] 马娟,郭银雪,谢恂,等. 穿山龙总皂苷经Nrf2/ARE通路抑制慢性肾脏病大鼠血管钙化的作用[J]. 中国老年学杂志,2022,42(12);3011-3016. MA J,GUO Y X,XIE X,et al. Inhibition effect of total saponin from rhizoma dioscorea nipponica on vascular calcification in rats with chronic kidney disease via Nrf2/ARE pathway[J]. Chinese Journal of Gerontology,2022,42(12):3011-3016. doi:10.3969/j.issn.1005-9202.2022.12.045.
[8] 朱黎红,张卫华. 乌梅丸临证思考[J]. 浙江中医药大学学报,2019,43(8):786-788. ZHU L H,ZHANG W H. Thoughts on the clinical syndrome differentiation of Wumei pill[J]. Journal of Zhejiang Chinese Medical University,2019,43(8):786-788. doi:10.16466/j.issn1005-5509.2019.08.012.
[9] 曾荣,金小晶. 乌梅丸治疗溃疡性结肠炎临床应用综述[J]. 辽宁中医药大学学报,2020,22(6):115-118. ZENG R,JIN X J. A review of the clinical application of Wumei pill in ulcerative colitis[J]. Journal of Liaoning University of Traditional Chinese Medicine,2020,22(6):115-118. doi:10.13194/j.issn.1673-842x.2020.06.029.
[10] 马清林,臧凯宏,杜丽东,等. 乌梅丸治疗溃疡性结肠炎的网络药理学研究[J]. 中药药理与临床,2019,35(2):11-16. MA Q L,ZANG K H,DU L D,et al. Network pharmacology study of Wumei Pill in the treatment of ulcerative colitis[J]. Pharmacology and Clinics of Chinese Materia Medica,2019,35(2):11-16. doi:10.13412/j.cnki.zyyl.2019.02.003.
[11] 付敏军,石荣珍,沈建君,等. 新麦纤散对DSS诱导UC大鼠的治疗作用及机制分析[J].中国实验方剂学杂志,2018,24(5):126-130. FU M J,SHI R Z,SHEN J J,et al. Curative effect and mechanism of Xinmaixian Powder on ulcerative colitis rats induced by dextran sodium sulfate[J]. Chinese Journal of Experimental Traditional Medical Formulae,2018,24(5):126-130. doi:10.13422/j.cnki.syfjx.2018050126.
[12] 殷玉琨,陳佳阳,刘丽星,等. Nrf2抑制剂ML-385腹腔注射对小鼠乳腺癌骨转移的抑制作用及其与骨桥蛋白的关系[J]. 山东医药,2022,62(23):45-48. YIN Y K,CHEN J Y,LIU L X,et al. Inhibitory effect of intraperitoneal injection of Nrf2 inhibitor ML-385 on bone metastasis of mouse breast cancer and its relationship with osteopontin[J]. Shandong Medical Journal,2022,62(23):45-48. doi:10.3969/j.issn.1002-266X.2022.23.010.
[13] 王雨欣,黄雨彤,杨盼盼,等. 水苏糖对小鼠溃疡性结肠炎的改善作用[J]. 中国食品学报,2022,22(10):171-179. WANG Y X,HUANG Y T,YANG P P,et al. The protective effect of stachyose on ulcerative colitis in mice[J]. Journal of Chinese Institute Of Food Science and Technology,2022,22(10):171-179. doi:10.16429/j.1009-7848.2022.10.019.
[14] 蒋晓梅,刘翀,朱延焱. 黄连总生物碱对溃疡性结肠炎模型大鼠肠黏膜损伤及p38-PPARγ/NF-κB通路的影响[J]. 中国药师,2019,22(12):2188-2193. JIANG X M,LIU C,ZHU Y Y. Effects of the total alkaloids of coptis chinensis on intestinal mucosal injury and p38-PPARγ/NF-κB pathway in rats with ulcerative colitis[J]. China Pharmacist,2019,22(12):2188-2193. doi:10.3969/j.issn.1008-049X.2019.12.007.
[15] 車璐. 蒲公英甾醇对溃疡性结肠炎的保护作用及其机制[D]. 郑州:郑州大学,2020. CHE L. Protective effect of dandelion sterol on ulcerative colitis and its mechanism[D]. Zhengzhou:Zhengzhou University,2020.
[16] PORTER R J,KALLA R,HO G T. Ulcerative colitis:Recent advances in the understanding of disease pathogenesis[J]. F1000Res,2020,9:F1000 Faculty Rev-294. doi:10.12688/f1000research.20805.1.
[17] FEUERSTEIN J D,MOSS A C,FARRAYE F A. Ulcerative Colitis[J]. Mayo Clin Proc,2019,94(7):1357-1373. doi:10.1016/j.mayocp.2019.01.018.
[18] SHEN J,CHENG J,ZHU S,et al. Regulating effect of baicalin on IKK/IKB/NF-kB signaling pathway and apoptosis-related proteins in rats with ulcerative colitis[J]. Int Immunopharmacol,2019,73:193-200. doi:10.1016/j.intimp.2019.04.052.
[19] 张云娜,韩俊泉,刘喆,等. 乌梅丸治疗溃疡性结肠炎的学术经验[J]. 中国中西医结合外科杂志,2023,29(4):535-536. ZHANG Y N,HAN J Q,LIU Z,et al. Academic experience of Wumei Pill in treating ulcerative colitis[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2023,29(4):535-536. doi: 10.3969/j.issn.1007-6948.2023.04.022.
[20] 何梦婷,黄凯歌,陈德轩. 从乌梅丸浅谈厥阴病类腹痛的治疗[J]. 中医临床研究,2022,14(22):104-106. HE M T,HUANG K G,CHEN D X. A brief discussion on treating abdominal pain of Jueyin disease with Wumei Wan[J]. Clinical Journal Of Chinese Medicine,2022,14(22):104-106. doi:10.3969/j.issn.1674-7860.2022.22.030.
[21] 郭琴,张立石,王颖,等. 乌梅丸及其拆方对TNBS致溃疡性结肠炎大鼠的作用研究[J]. 中国中医基础医学杂志,2021,27(7):1099-1103. GUO Q,ZHANG L S,WANG Y,et al. Effects of Wumei Pill and its separated prescriptions on TNBS induced ulcerative colitis in rats[J]. Journal of Basic Chinese Medicine,2021,27(7):1099-1103. doi:10.19945/j.cnki.issn.1006-3250.2021.07.015.
[22] 张旭东,刘宏岩. 乌梅丸对溃疡性结肠炎大鼠TLRs/NF-κB/myD88信号通路影响的研究进展[J]. 吉林中医药,2019,39(3):410-413. ZHANG X D,LIU H Y. Research progress on the effect of Wumei Pill on TLRs/NF-κB/myD88 signal pathway of ulcerative colitis in rats[J]. Jilin Journal of Chinese Medicine,2019,39(3):410-413. doi:10.13463/j.cnki.jlzyy.2019.03.038.
[23] HE F,ANTONUCCI L,KARIN M. NRF2 as a regulator of cell metabolism and inflammation in cancer[J]. Carcinogenesis,2020,41(4):405-416. doi:10.1093/carcin/bgaa039.
[24] 林培琦,龙远铸,张霓霓,等. Nrf2/ARE信号通路激活对放射治疗中减轻组织损伤的作用机制[J]. 中国组织工程研究,2022,26(11):1780-1787. LIN P Q,LONG Y Z,ZHANG N N,et al. Activation of Nrf2/ARE signal pathway reduces radiotherapy-induced tissue injury[J]. Chinese Journal of Tissue Engineering Research,2022,26(11):1780-1787. doi:10.12307/2022.366.
[25] MA N,WEI Z,HU J,et al. Farrerol ameliorated cisplatin-induced chronic kidney disease through mitophagy induction via Nrf2/PINK1 pathway[J]. Front Pharmacol,2021,12:768700. doi:10.3389/fphar.2021.768700.
(2023-04-18收稿 2023-05-18修回)
(本文编辑 陈丽洁)
