黄芪阳和汤调控PI3K/AKT/NF-κB信号通路促进糖尿病足溃疡大鼠创面愈合
2024-04-01鲍亚玲雷慧马君赵新梅
鲍亚玲 雷慧 马君 赵新梅

摘要:目的 基于磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/核因子-κB(NF-κB)信號通路探究黄芪阳和汤对糖尿病足溃疡(DFU)大鼠创面愈合的影响。方法 构建DFU大鼠模型,将建模成功的48只大鼠随机分为模型组,黄芪阳和汤低(8.5 g/kg)、高(17 g/kg)剂量组,黄芪阳和汤高剂量(17 g/kg)+LY294002(PI3K/AKT通路抑制剂,0.3 mg/kg)组;每组12只;另取12只大鼠为对照组。各组大鼠给予对应药物干预,连续4周。第14、28天给药后,观察大鼠一般状态及创面变化,计算创面愈合率,检测大鼠空腹血糖(FBG)水平和大鼠创面周围组织经皮氧分压(TcpO2);酶联免疫吸附试验检测大鼠血清血管内皮生长因子(VEGF)、缺氧诱导因子-1α(HIF-1α)、C反应蛋白(CRP)、白细胞介素(IL)-6水平;苏木素-伊红染色观察大鼠创面组织病理学变化;免疫组织化学染色测定大鼠创面组织微血管密度;蛋白免疫印迹法检测大鼠创面组织中PI3K、磷酸化PI3K(p-PI3K)、AKT、磷酸化AKT(p-AKT)、NF-κB p65、磷酸化NF-κB p65(p-NF-κB p65)、NF-κB抑制蛋白α(IκB-α)蛋白表达。结果 对照组大鼠毛色光滑,饮食、饮水、排泄均正常,较活跃,创面愈合快,创面组织炎症反应较轻,新生血管较多,肉芽组织中成纤维细胞及胶原基质丰富;模型组大鼠毛色暗淡无光泽,活动减少,且出现多饮、多食、多尿症状,创面颜色较深,且周围组织出现水肿、溃疡,创面组织可见大量炎性细胞浸润,伴组织坏死、渗出,新生血管及成纤维细胞较少,创面愈合率、创面周围组织TcpO2、血清VEGF、HIF-1α、创面组织微血管密度、p-PI3K、p-AKT、IκB-α蛋白表达水平降低,FBG、血清CRP、IL-6、创面组织p-NF-κB p65蛋白表达升高(P<0.05);与模型组相比,黄芪阳和汤低、高剂量组大鼠状态逐渐改善,创面组织病变程度依次减轻,创面愈合率、创面周围组织TcpO2、血清VEGF、HIF-1α、创面组织微血管密度、p-PI3K、p-AKT、IκB-α蛋白表达水平依次升高,FBG、血清CRP、IL-6、创面组织p-NF-κB p65蛋白表达依次降低(P<0.05);LY294002能部分逆转高剂量黄芪阳和汤对DFU大鼠的治疗作用(P<0.05)。结论 黄芪阳和汤能调控PI3K/AKT/NF-κB信号通路,抑制DFU大鼠炎症反应,促进血管新生,从而促进创面愈合。
关键词:黄芪阳和汤;糖尿病足溃疡;创面愈合;磷脂酰肌醇3-激酶;蛋白激酶B;NF-κB
中图分类号:R285.5文献标志码:ADOI:10.11958/20230561
Huangqi Yanghe Decoction regulates PI3K/AKT/NF-κB signaling pathway to promote
wound healing in diabetes foot ulcer rats
BAO Yaling1, LEI Hui1△, MA Jun2, Zhao Xinmei2
1 Zhangjiakou University, Zhangjiakou 075000, China; 2 Department of Endocrinology, Zhangjiakou First Hospital
△Corresponding Author E-mail: 115386879@qq.com
Abstract: Objective To explore the effect of Huangqi Yanghe Decoction on wound healing of diabetic foot ulcer (DFU) rats based on phosphatidylinositol 3-kinase (PI3K)/protein kinase B (AKT)/nuclear factor-κB (NF-κB) signal pathway. Methods DFU rat model was constructed, and 48 rats successfully modeled were randomly divided into the model group, the Huangqi Yanghe Decoction low (8.5 g/kg) group, the Huangqi Yanghe Decoction high (17 g/kg) dose group and the Huangqi Yanghe Decoction high dose (17 g/kg)+LY294002 (PI3K/AKT pathway inhibitor, 0.3 mg/kg) group. There were 12 rats in each group. Another 12 rats were selected as the control group. Rats in each group were given corresponding drug intervention for 4 weeks. After the 14th and 28th day-administration, the general state and wound changes of rats were observed, and the wound healing rate was calculated. The fasting blood glucose (FBG) level of rats was measured, and the percutaneous partial pressure of oxygen (TcpO2) of tissue around the wound was detected. Serum levels of vascular endothelial growth factor (VEGF), hypoxia inducible factor-1α (HIF-1α), C-reactive protein (CRP) and interleukin (IL)-6 were determined by enzyme linked immunosorbent assay. Histopathological changes of the wound were observed by hematoxylin-eosin staining. Immunohistochemical staining was used to measure the microvascular density of rat wound tissue. The protein expression levels of PI3K, phosphorylated PI3K (p-PI3K), AKT, phosphorylated AKT (p-AKT), NF-κB p65, phosphorylated NF-κB p65 (p-NF-κB p65) and NF-κB inhibitory protein α (IκB-α) in rat wound tissue were determined by Western blot assay. Results Rats in the control group had smooth hair color, normal diet, drinking water and excretion, more active, wound healing fast, less inflammatory reaction in wound tissue, and there were more new blood vessels. Fibroblasts and collagen matrix were abundant in granulation tissue. In the model group, the fur color of rats was dull and matte, and the activity was reduced. The symptoms of polydipsia, polyphagia and polyuria were appeared in the model group, the wound color was dark, and edema and ulcer appeared in the surrounding tissue, a large number of inflammatory cells infiltrated in the wound tissue, accompanied by tissue necrosis and exudation, fewer neovascularization and fibroblasts were observed. Wound healing rate, TcpO2 in wound surrounding tissue, serum VEGF, HIF-1α, microvascular density, p-PI3K, p-AKT and IκB-α protein expression levels in wound tissue were decreased, and FBG, serum CRP, IL-6, p-NF-κB p65 protein expression in wound tissue were increased (P<0.05). Compared with the model group, the state of rats was gradually improved in the Huangqi Yanghe Decoction low and high dose groups, and the lesion degree of wound tissue was reduced successively, wound healing rate, TcpO2 in wound surrounding tissue, serum VEGF, HIF-1α, microvascular density, p-PI3K, p-AKT and IκB-α protein expression levels in wound tissue were increased in turn (P<0.05). The FBG, serum CRP, IL-6 and p-NF-κB p65 protein expression in wound tissue were decreased in turn (P<0.05). LY294002 could partially reverse the therapeutic effect of high-dose Huangqi Yanghe Decoction on DFU rats (P<0.05). Conclusion Huangqi Yanghe Decoction can regulate PI3K/AKT/NF-κB pathway, inhibit inflammatory response in DFU rats, promote angiogenesis and thus promote wound healing.
Key words: Huangqi Yanghe Decoction; diabetic foot ulcer; wound healing; phosphatidylinositol 3-kinase; protein kinase B; nuclear factor-κB
糖尿病足(DF)是糖尿病的常见并发症,为下肢远端血管病变合并神经病变,进一步形成足部感染、溃疡,称为糖尿病足溃疡(DFU)[1]。DFU是患者截肢和长期住院的重要原因,糖尿病患者高位截肢发生风险较非糖尿病患者高10~30倍,且截肢后的5年病死率为39%~68%[2-3]。DFU的病理过程非常复杂,涉及受损的皮肤、肌肉、肌腱、骨骼、神经和血管,并伴有持续的高血糖状态[4],这使DFU较正常伤口难以愈合,且治疗费用高,长期创面存在会导致原病情加重。目前DFU的治疗方法主要包括控制血糖、抗感染、外科清创术和外用生长因子[5],但治疗效果并不理想。需要不断研究促进DFU疾病治愈的新方法以降低致残率和病死率。有研究表明,中国传统医药在治疗糖尿病及其相关并发症方面有显著的作用[6]。阳和汤出自清代王洪绪《外科证治全生集》,临床上被广泛应用于治疗DFU[7]、下肢血管病变[8];且研究发现其可加速创面愈合,结合负压技术能够缩短DF患者创面愈合时间,临床疗效明显[9]。黄芪及以黄芪为主药的方剂可明显促进创面愈合,降低高血糖,有效提升早期DF的治疗效果[10-11]。因此,本研究以阳和汤为主方,加入生黄芪,简称黄芪阳和汤。通过构建DFU大鼠模型,探究黄芪阳和汤对DFU大鼠创面愈合的影响及可能的作用机制,为黄芪阳和汤的临床应用提供实验参考。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性SD大鼠,10周齡,体质量353~379 g,购自湖北绿雪生物产业有限公司,动物生产许可证号:SCXK(鄂)2022-0015。将所有大鼠放在可控制的光照下保持12 h明暗交替,温度22~26 ℃,相对湿度为45%~60%,可以自由获取食物和水。本实验经张家口学院伦理委员会批准(批准号:ZJKXY伦审2022-113)。
1.1.2 药物与试剂 黄芪阳和汤[组方:熟地50 g、肉桂5 g(去皮,研粉)、麻黄3 g、鹿角胶15 g、白芥子10 g、姜炭3 g、生甘草5 g、生黄芪100 g],以上中药均购自河北豪通中药饮片有限公司,加水500 mL煎煮1 h,过滤药液;再加水500 mL继续煎煮1 h,过滤第2次的药液;将2次的药液合并,经旋转蒸发仪浓缩成生药质量浓度为0.85 g/mL、1.7 g/mL的药液。链脲佐菌素(STZ)、PI3K/AKT通路抑制剂(LY294002)、HE染色试剂盒、山羊血清、BCA试剂盒、ECL试剂均购自武汉科前生物技术有限公司;血管内皮生长因子(VEGF)、缺氧诱导因子-1α(HIF-1α)、C反应蛋白(CRP)、白细胞介素(IL)-6酶联免疫吸附试验(ELISA)试剂盒,蛋白裂解液均购自深圳纽邦生物技术有限公司;兔抗大鼠CD31一抗,羊抗兔二抗,鼠源磷脂酰肌醇3-激酶(PI3K)、磷酸化PI3K(p-PI3K)、蛋白激酶B(AKT)、磷酸化AKT(p-AKT)、核因子-κB p65(NF-κB p65)、磷酸化NF-κB p65(p-NF-κB p65)、NF-κB抑制蛋白α(IκB-α)、β-肌动蛋白(β-actin)一抗,羊抗鼠二抗均购自济南思科生物科技有限公司。
1.1.3 仪器 血糖仪(型号Accu-Chek Active)、酶标仪(型号iMark680)、荧光显微镜(型号IX73)均购自天津科德生物技术有限公司;经皮氧分压监测仪(型号PeriFlux 5000)、凝胶成像系统(型号OmegaLum C)均购自广州威佳科技有限公司。
1.2 方法
1.2.1 模型的建立及分组给药 构建DFU大鼠模型[12]:大鼠喂养高脂高糖饲料(含66.5%基础饲料+10%猪油+20%蔗糖+ 2.5%胆固醇+1%胆酸钠),4周后,一次性腹腔注射STZ 60 mg/kg(注射前大鼠禁食12 h),3 d后尾尖处取血检测空腹血糖(FBG),若FBG>16.7 mmol/L,且大鼠出现多食、多饮、多尿的表现,即为糖尿病大鼠建模成功。随后麻醉大鼠,脱去右后足背部毛发,碘伏消毒,切除足背全层皮肤,创建5 mm× 2 mm的矩形全层伤口,完成DFU大鼠造模[12]。将造模成功的48只大鼠按照随机数字表法分为模型组,黄芪阳和汤低(8.5 g/kg)、高(17 g/kg)剂量组,黄芪阳和汤高剂量(17 g/kg)+LY294002(0.3 mg/kg)组[13],每组12只。另取12只健康大鼠作为对照组,以普通饲料喂养,使用等量生理盐水代替STZ腹腔注射,以上述方式创建足背伤口。
给药剂量换算:黄芪阳和汤根据临床给药剂量(70 kg成人给药剂量191 g),按种属间体表面积换算,大鼠对应给药剂量为成人的6.3倍,换算大鼠等效剂量约为17 g/kg,因此,设置黄芪阳和汤低、高剂量为8.5、17 g/kg。
建模后,对照组、模型组大鼠不进行药物干预,灌胃蒸馏水早晚各1次;黄芪阳和汤低、高剂量组大鼠每天分别给予8.5、17 g/kg的黄芪阳和汤灌胃给药(生药含量为0.85、1.7 g/mL的药液,灌胃体积10 mL/kg),早、晚各1次;黄芪阳和汤高剂量+LY294002组大鼠每天给予17 g/kg的黄芪阳和汤灌胃给药(灌胃体积10 mL/kg),早晚各1次,同时腹腔注射0.3 mg/kg的LY294002,每日注射1次。各组连续给药4周。
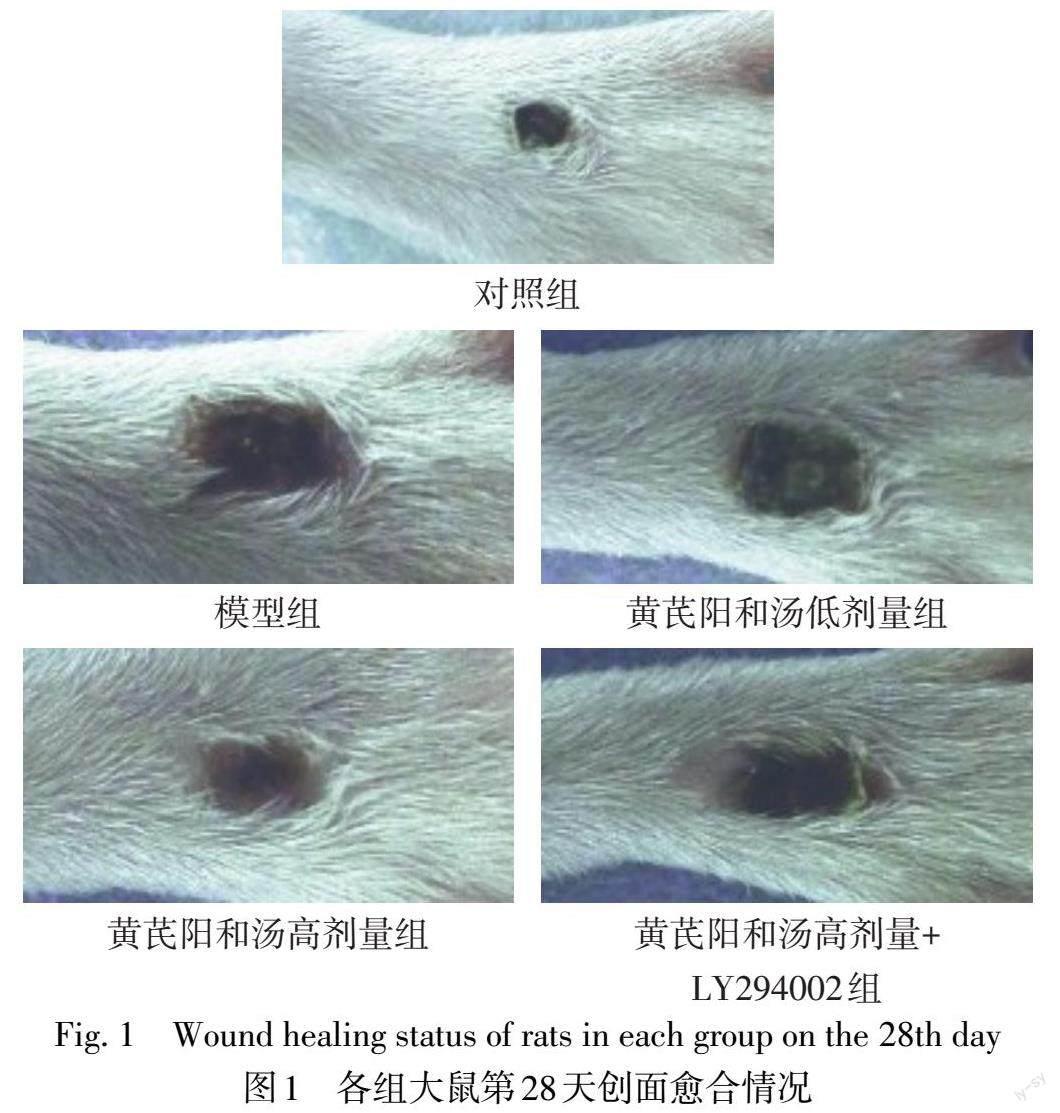
1.2.2 大鼠一般状态和伤口愈合情况观察 实验期间观察大鼠一般状态及创面变化,并于第14、28天给药后使用数码相机拍照,记录伤口创面的愈合情况,并通过Image-Pro Plus 6.0软件分析溃疡区域面积。计算大鼠创面愈合率,创面愈合率(%)=(1-给药后溃疡区域面积/给药前溃疡区域面积)×100%。
1.2.3 大鼠FBG水平的检测 在第14、28天给药后,采集大鼠尾静脉血,采用血糖仪测量大鼠FBG水平。
1.2.4 大鼠创面周围组织经皮氧分压(TcpO2)的检测 于第14、28天给药后,采用TcpO2监测系统检测大鼠创面周围组织TcpO2。大鼠腹腔注射戊巴比妥钠麻醉后,将创面周围毛发剃去,清洗干净,将TcpO2探头固定在大鼠创面周围皮肤上(不漏气),放置电极,连续监测15 min。待TcpO2稳定后,读数并记录监测数值。
1.2.5 大鼠血清生长因子(VEGF、HIF-1α)和炎性因子(CRP、IL-6)的检测 末次给药结束24 h后,腹主动脉取血3 mL,静置后以4 700 r/min离心17 min,取上清液,按照ELISA试剂盒说明书检测血清中VEGF、HIF-1α、CRP、IL-6水平。
1.2.6 大鼠创面组织病理学变化的检测 取血完成后,颈椎脱臼处死大鼠,取大鼠创面及周围3 mm组织,并将其分为2份,1份于-80 ℃冰箱中保存;另外1份固定于4%多聚甲醛溶液中,石蜡包埋,4 ?m厚度切片;取部分切片HE染色,在显微镜下观察表皮再生、肉芽组织形成和炎性细胞浸润情况。
1.2.7 免疫荧光染色测定创面组织微血管密度 使用兔抗大鼠CD31一抗进行免疫荧光染色,分析创面组织微血管密度。取1.2.6中的切片,在3%正常山羊血清中封闭,然后与兔抗大鼠CD31一抗在4 ℃孵育24 h,洗去一抗,滴加羊抗兔二抗(1∶200),室温下孵育1 h,洗去二抗,甘油封片,荧光显微镜下观察并计算创面周围组织微血管密度(微血管被染成红色),微血管密度=微血管染色面积/视野区域面积×100%,用Image J软件定量分析。每张切片观察5个区域,取平均值。
1.2.8 Western blot检测大鼠创面组织中PI3K/AKT/NF-κB信号通路相关蛋白的表达 取1.2.6中-80 ℃保存的大鼠创面组织,解冻后研磨匀浆,蛋白裂解液裂解,BCA法进行蛋白定量。取等量蛋白样品上样(30 μg),凝胶电泳分离,湿转法转膜,5%脱脂奶粉封闭1 h,然后在4 ℃下与稀释比例为1∶1 450的鼠源PI3K、p-PI3K、AKT、p-AKT、NF-κB p65、p-NF-κB p65、IκB-α、β-actin一抗孵育过夜。TBST洗涤,加稀释比例为1∶2 200的羊抗鼠二抗在室温下孵育2 h。ECL显色,分析膜上蛋白质表达水平。
1.3 统计学方法 采用SPSS 24.0软件进行数据分析。计量资料以均数±标准差([x] ±s)表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
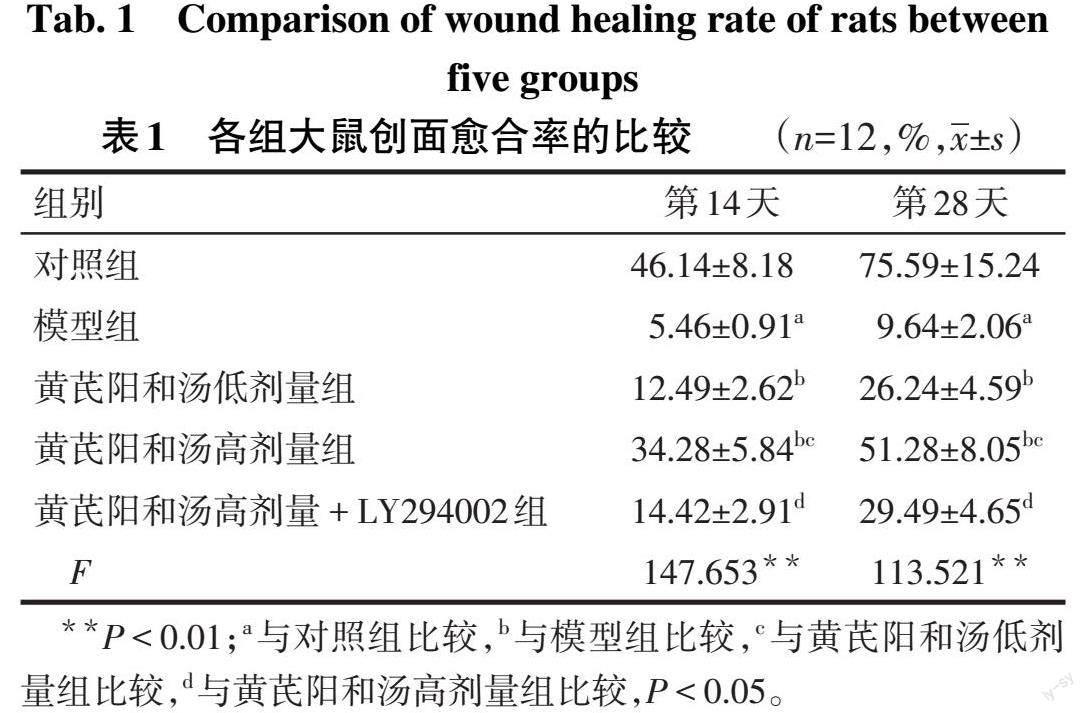
2.1 黄芪阳和汤对DFU大鼠一般状态和创面愈合的影响 对照组大鼠毛色光滑,饮食、饮水、排泄均正常,较活跃,创面愈合快;与对照组相比,模型组大鼠毛色暗淡无光泽,活动减少,且出现多饮、多食、多尿症状,创面颜色较深,周围组织出现水肿、溃疡,第14、28天给药后创面愈合率降低(P<0.05);与模型组相比,黄芪阳和汤低、高剂量组大鼠状态逐渐改善,第14、28天给药后创面愈合率依次升高(P<0.05);与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组大鼠第14、28天给药后创面愈合率降低(P<0.05)。见图1、表1。
2.2 各组大鼠FBG水平变化 与对照组相比,模型组大鼠第14、28天给药后FBG水平升高(P<0.05);与模型组相比,黄芪阳和汤低、高剂量组大鼠第14、28天给药后FBG水平依次降低(P<0.05);与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组大鼠第14、28天给药后FBG水平升高(P<0.05)。见表2。
2.3 各组大鼠创面周围组织TcpO2比较 与对照组相比,模型组大鼠第14、28天给药后创面周围组织TcpO2降低(P<0.05);與模型组相比,黄芪阳和汤低、高剂量组大鼠第14、28天给药后创面周围组织TcpO2依次升高(P<0.05);与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组大鼠第14、28天给药后创面周围组织TcpO2降低(P<0.05)。见表3。
2.4 各组大鼠血清VEGF、HIF-1α、CRP、IL-6水平比较 与对照组相比,模型组大鼠血清VEGF、HIF-1α水平降低,CRP、IL-6水平升高(P<0.05);与模型组相比,黄芪阳和汤低、高剂量组大鼠血清VEGF、HIF-1α水平依次升高,CRP、IL-6水平依次降低(P<0.05);与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组血清VEGF、HIF-1α水平降低,CRP、IL-6水平升高(P<0.05)。见表4。
2.5 各组大鼠创面组织病理学变化 对照组大鼠创面组织炎症反应较轻,新生血管较多,肉芽组织中成纤维细胞及胶原基质丰富;模型组大鼠创面组织可见大量炎性细胞浸润,伴组织坏死、渗出,新生血管及成纤维细胞较少;与模型组相比,黄芪阳和汤低、高剂量组大鼠创面炎性细胞减少,肉芽下方新生血管旺盛;与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组大鼠创面组织炎性细胞增多,成纤维细胞及新生血管减少。见图2。
2.6 各组大鼠创面组织微血管密度比较 对照组、模型组、黄芪阳和汤低剂量组、黄芪阳和汤高剂量组、黄芪阳和汤高剂量+LY294002组大鼠创面组织微血管密度分别为(34.92±5.45)%、(10.15±1.91)%、(18.24±3.15)%、(30.31±4.48)%、(20.09±3.06)%,组间比较差异有统计学意义(n=12,F=80.757,P<0.01)。与对照组相比,模型组大鼠创面组织微血管密度降低(P<0.05);与模型组相比,黄芪阳和汤低、高剂量组大鼠创面组织微血管密度依次升高(P<0.05);与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组大鼠创面组织微血管密度降低(P<0.05)。见图3。
2.7 各组大鼠创面组织PI3K/AKT/NF-κB信号通路相关蛋白表达变化 与对照组相比,模型组大鼠创面组织p-PI3K、p-AKT、IκB-α蛋白表达水平降低,p-NF-κB p65蛋白表达升高(P<0.05);与模型组相比,黄芪阳和汤低、高剂量组大鼠创面组织p-PI3K、p-AKT、IκB-α蛋白表达水平依次升高,p-NF-κB p65蛋白表达依次降低(P<0.05);与黄芪阳和汤高剂量组相比,黄芪阳和汤高剂量+LY294002组大鼠创面组织p-PI3K、p-AKT、IκB-α蛋白表达水平降低,p-NF-κB p65蛋白表达升高(P<0.05)。见图4、表5。
3 讨论
中医认为DFU属于“脱疽”范畴,其发病机制为阴阳俱虚、气阴两虚、血脉瘀阻。而肾主骨、生髓,肾阳不足则缺少温煦生发之力,导致寒阻血凝,血液运行不畅[14]。因此,可从补肾、益气、温阳、活血角度出发寻找DFU的治疗方法。
阳和汤具有温阳散寒、补血通滞的功效,方中熟地可滋阴补血,鹿角胶温阳补肾,肉桂、姜炭可温通血脉,麻黄散寒通络,白芥子驱寒通滞。已有研究表明,阳和汤治疗DFU效果显著,可明显缩短创面愈合时间[9]。本研究所用黄芪阳和汤是在阳和汤的基础上加黄芪以增加其益气排脓的功效,而且黄芪在临床上也被广泛用于糖尿病及其并发症的治疗[15]。TcpO2可用于评估糖尿病周围血管病变的状况,可以有效反映下肢动脉病变所致的微循环状态,具有敏感度和特异度高,检测方便、经济、可靠、重复性好等优点,目前已有研究应用TcpO2预测DFU溃疡愈合情况[16]。本研究结果显示,DFU大鼠一般状态较差,创面组织病理损伤严重,创面愈合率、创面周围组织TcpO2较健康大鼠降低,FBG水平较健康大鼠升高,表明DFU模型建立成功;而经黄芪阳和汤治疗后,大鼠一般状态好转,创面组织病变程度减轻,且创面愈合率、创面周围组织TcpO2升高,FBG降低,且剂量越高效果越好,提示黄芪阳和汤用于治疗DFU可发挥降血糖、促进创面愈合的作用。黄芪阳和汤组方中麻黄、甘草、黄芪等中药及其主要成分均被报道有降血糖作用[17-19],推测其降糖作用可能与方中的一些中药或活性成分有关,究竟是何种成分发挥降血糖作用及其机制尚待进一步研究。
高血糖通过升高促炎细胞因子水平和降低生长因子水平,并通过减少血液循环及伤口中的细胞增殖、迁移延迟创面愈合[20]。血管生成是伤口愈合过程中必不可少的部分。研究表明高糖可诱导内皮细胞损伤,抑制血管生成和伤口愈合,而促进血管生成可加速糖尿病大鼠的伤口愈合[21]。本研究结果显示,DFU大鼠创面组织微血管密度较低,而黄芪阳和汤干预后,大鼠创面组织微血管密度升高。HE染色亦显示黄芪阳和汤可减少炎性细胞浸润,促进肉芽组织形成、成纤维细胞增殖和血管生成,加速伤口愈合。CRP是糖尿病及大血管病变的危险因子,DF创面愈合缓慢与CRP、IL-6过高表达有关[22]。HIF-1α可调节细胞内的氧代谢,是唯一能在缺氧状态下发挥活性的转录因子;VEGF是HIF-1α的下游基因,可特异性地促进血管内皮细胞生长及血管新生,有利于血管内皮细胞的增殖[23]。本研究结果显示,黄芪阳和汤可降低血清炎性因子CRP、IL-6水平,升高生长因子VEGF、HIF-1α水平,提示黄芪阳和汤可抑制局部组织炎症反应,促进血管生成并增加血液运输氧气的功能,进而加速DFU大鼠创面愈合。
PI3K/AKT和NF-κB信号在炎症及血管生成中起关键作用。LY294002为PI3K/AKT通路的阻断剂,可抑制PI3K磷酸化,阻断PI3K/AKT通路影响血管生成。PI3K是PI3K/AKT/NF-κB通路的上游启动子,在生长因子刺激下可进一步激活AKT,促进内皮细胞的增殖、迁移,进而产生新的微血管[24]。研究表明,PI3K/AKT通路在糖尿病中会受到抑制,激活PI3K/AKT通路可促进血管新生,从而促进伤口愈合[25]。NF-κB是涉及先天免疫和炎症反应的多效调节剂,可调节炎性因子的分泌,抑制PI3K/AKT通路可導致NF-κB抑制性蛋白IκBα表达下调,促进NF-κB磷酸化,进而调节促炎因子的表达[26]。本研究结果显示,黄芪阳和汤可升高DFU大鼠创面组织中p-PI3K、p-AKT、IκB-α蛋白表达水平,降低p-NF-κB p65蛋白表达,提示黄芪阳和汤可激活PI3K/AKT通路,抑制NF-κB的活化。为了进一步验证黄芪阳和汤的作用机制,本研究在高剂量黄芪阳和汤干预的基础上使用LY294002来抑制PI3K/AKT通路的激活,结果显示,LY294002可部分逆转高剂量黄芪阳和汤对DFU大鼠的治疗效果,提示黄芪阳和汤对DFU大鼠创面愈合的促进作用可能与激活PI3K/AKT通路,抑制NF-κB的活化,进而降低炎症反应,促进血管新生有关。但黄芪阳和汤能否通过其他信号通路起作用还有待后续研究。
参考文献
[1] DAYYA D,O'NEILL O J,HUEDO-MEDINA T B,et al. Debridement of diabetic foot ulcers[J]. Adv Wound Care (New Rochelle),2022,11(12):666-686. doi:10.1089/wound.2021.0016.
[2] YANG S L,HU L Y,HAN R,et al. Neuropeptides,inflammation,biofilms,and diabetic foot ulcers[J]. Exp Clin Endocrinol Diabetes,2022,130(7):439-446. doi:10.1055/a-1493-0458.
[3] BIZ C,RUGGIERI P. Distal metatarsal osteotomies for chronic plantar diabetic foot ulcers[J]. Foot Ankle Clin,2022,27(3):545-566. doi:10.1016/j.fcl.2022.02.003.
[4] ALDANA P C,CARTRON A M,KHACHEMOUNE A. Reappraising diabetic foot ulcers:a focus on mechanisms of ulceration and clinical evaluation[J]. Int J Low Extrem Wounds,2022,21(3):294-302. doi:10.1177/1534734620944514.
[5] BOLTON L. Diabetic foot ulcer:treatment challenges[J]. Wounds,2022,34(6):175-177. doi:10.25270/wnds/2022.175177.
[6] 张荣荣,王刚,李梦虎. 中西医结合治疗糖尿病足的研究进展[J]. 中国中西医结合外科杂志,2022,28(5):740-743. ZHANG R R,WANG G,LI M L. Research progress in the treatment of diabetes foot with integrated traditional Chinese medicine and western medicine[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2022,28(5):740-743. doi:10.3969/j.issn.1007-6948.2022.05.029.
[7] 陈晶,刘欣欣,李瑒,等. 阳和汤的临床应用和基础研究进展[J]. 中华中医药学刊,2022,40(8):10-13. CHEN J,LIU X X,LI Y,et al. Research progress on indications of yanghe decoction(阳和汤)[J]. Chinese Archives of Traditional Chinese Medicine,2022,40(8):10-13. doi:10.13193/j.issn.1673-7717.2022.08.003.
[8] 侯俊杰,李大勇,李世征,等. 加味阳和汤治疗寒凝血瘀证下肢动脉硬化闭塞症的临床疗效及对血清ET-1、NO水平变化的影响[J]. 中华中医药学刊,2019,37(9):2093-2097. HOU J J,LI D Y,LI S Z,et al. Clinical efficacy of Jiawei Yanghe Decoction in treating lower extremity arteriosclerosis obliterans with cold coagulation and blood stasis syndrome and its effect on serum levels of ET-1 and NO[J]. Chinese Archives of Traditional Chinese Medicine,2019,37(9):2093-2097. doi:10.13193/j.issn.1673-7717.2019.09.010.
[9] 王永靈,廖明娟,李琰,等. 阳和汤加减结合负压技术治疗糖尿病足65例[J]. 中医外治杂志,2020,29(2):50-51. WANG Y L,LIAO M J,LI Y,et al. Treatment of 65 cases of diabetes foot with Yanghe decoction plus negative pressure technique[J]. Journal of External Therapy of Traditional Chinese Medicine,2020,29(2):50-51. doi:10.3969/j.issn.1006-978X.2020.02.026
[10] 牛文晶,刘鹏,王军. 基于网络药理学探讨黄芪-当归治疗糖尿病足的作用机制[J]. 中国中西医结合外科杂志,2022,28(2):252-257. NIU W J,LI P,WANG J. Mechanism of Huangqi-Danggui on diabetic foot based on network pharmacology[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2022,28(2):252-257. doi:10.3969/j.issn.1007-6948.2022.02.020.
[11] 马艳春,段莹,胡建辉,等. 黄芪治疗糖尿病及其并发症研究进展[J]. 中医药学报,2022,50(6):103-107. MA Y C,DUAN Y,HU J H,et al. Research progress of astragalus membranaceus in treating dm and its complications[J]. Acta Chinese Medicine and Pharmacology,2022,50(6):103-107. doi:10.19664/j.cnki.1002-2392.220141.
[12] 张春玲,陈露,赵伟,等. 基于转换生长因子-β1/Smad3信号通路观察丹黄散在糖尿病大鼠足溃疡创面愈合中的作用[J]. 中国临床药理学杂志,2020,36(21):3473-3476,3480. ZHANG C L,CHEN L,ZHAO W,et al. Danhuang powder promotes the wound healing of diabetic foot ulcer through transforming growth factor-β1/Smad3 signaling pathway in rats[J]. The Chinese Journal of Clinical Pharmacology,2020,36(21):3473-3476,3480. doi:10.13699/j.cnki.1001-6821.2020.21.019.
[13] 賈湘隆,徐旭英. 基于PI3K/AKT通路对回阳生肌膏促进糖尿病阴证疮面的微血管新生作用机制的初探[J]. 中华中医药杂志,2020,35(2):646-649. JIA X L,XU X Y. Preliminary mechanism study of Huiyang Shengji Ointment on affecting microvascular neogenesis of yin syndrome wound of diabetes based on PI3K/AKT pathway[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(2):646-649.
[14] 耿树军,杨军,莫爵飞. 132例缺血性糖尿病足溃疡患者局部病变的中医证候特征[J]. 中医杂志,2022,63(20):1958-1964. GENG S J,YANG J,MO J F. Characteristics of traditional Chinese medicine syndromes of local lesions in 132 patients with ischemic diabetic foot ulcer[J]. Journal of Traditional Chinese Medicine,2022,63(20):1958-1964. doi:10.13288/j.11-2166/r.2022.20.011.
[15] 马斌,柴智,王金虹. 基于VOSviewer软件的黄芪治疗糖尿病研究文献计量分析[J]. 中国药房,2020,31(21):2634-2639. MA B,CHAI Z,WANG J H. Bibliometric analysis of astragalus membranaceus in the treatment of diabetes based on VOSviewer software[J]. China Pharmacy,2020,31(21):2634-2639. doi:10.6039/j.issn.1001-0408.2020.21.13.
[16] 莫嘉敏,颜晓东,黄秀禄,等. 下肢动脉病变和组织微循环状况对伤口负压治疗糖尿病足溃疡的疗效影响[J]. 中华糖尿病杂志,2021,13(3):209-214. MO J M,YAN X D,HUANG X L,et al. Effects of different lower extremity arterial disease and tissue microcirculation on negative pressure therapy for diabetic foot ulcer[J]. Chinese Journal of Diabetes,2021,13(3):209-214. doi:10.3760/cma.j.cn115791-20200713-00439.
[17] 卓小玉,陈晶,田明,等. 麻黄的化学成分与药理作用研究进展[J]. 中医药信息,2021,38(2):80-83. ZHUO X Y,CHEN J,TIAN M,et al. Research progress on chemical constituents and pharmacological effects of ephedra sinica[J]. Information on Traditional Chinese Medicine,2021,38(2):80-83. doi:10.19656/j.cnki.1002-2406.210216.
[18] 肖先,李春燕,刘晓龙,等. 甘草的主要化学成分及药理作用研究进展[J]. 新乡医学院学报,2023,40(3):280-285. XIAO X,LI C Y,LIU X L,et al. Research progress of main chemical constituents and pharmacological effects of Glycyrrhizae Radix et Rhizoma[J]. Journal of Xinxiang Medical University,2023,40(3):280-285. doi:10.7683/xxyxyxb.2023.03.016.
[19] 马艳春,胡建辉,吴文轩,等. 黄芪化学成分及药理作用研究进展[J]. 中医药学报,2022,50(4):92-95. MA Y C,HU J H,WU W X,et al. Research progress on chemical constituents and pharmacological effects of Radix Astragali[J]. Acta Chinese Medicine and Pharmacology,2022,50(4):92-95. doi:10.19664/j.cnki.1002-2392.220092.
[20] AITCHESON S M,FRENTIU F D,HURN S E,et al. Skin wound healing:normal macrophage function and macrophage dysfunction in diabetic wounds[J]. Molecules,2021,26(16):4917. doi:10.3390/molecules26164917.
[21] WANG B S,MA X F,ZHANG C Y,et al. Astragaloside IV improves angiogenesis and promotes wound healing in diabetic rats via the activation of the SUMOylation Pathway[J]. Biomed Environ Sci,2021,34(2):124-129. doi:10.3967/bes2021.018.
[22] BASIRI R,SPICER M,LEVENSON C,et al. Improving dietary intake of essential nutrients can ameliorate inflammation in patients with diabetic foot ulcers[J]. Nutrients,2022,14(12):2393-2403. doi:10.3390/nu14122393.
[23] ZHAO K,JIANG Y P,ZHANG J,et al. Celastrol inhibits pathologic neovascularization in oxygen-induced retinopathy by targeting the miR-17-5p/HIF-1α/VEGF pathway[J]. Cell Cycle,2022,21(19):2091-2108. doi:10.1080/15384101.2022.2087277.
[24] LUO L,LIANG H,LIU L. Myristicin regulates proliferation and apoptosis in oxidized low-density lipoprotein-stimulated human vascular smooth muscle cells and human umbilical vein endothelial cells by regulating the PI3K/Akt/NF-κB signalling pathway[J]. Pharm Biol,2022,60(1):56-64. doi:10.1080/13880209.2021.2010775.
[25] WANG J,WU H,PENG Y X,et al. Hypoxia adipose stem cell-derived exosomes promote high-quality healing of diabetic wound involves activation of PI3K/Akt pathways[J]. J Nanobiotechnology,2021,19(1):202-214. doi:10.1186/s12951-021-00942-0.
[26] ZHONG R,XIA T,WANG Y,et al. Physalin B ameliorates inflammatory responses in lipopolysaccharide-induced acute lung injury mice by inhibiting NF-κB and NLRP3 via the activation of the PI3K/Akt pathway[J]. J Ethnopharmacol,2022,284(1):114777. doi:10.1016/j.jep.2021.114777.
(2023-04-23收稿 2023-07-13修回)
(本文編辑 陈丽洁)
