LEC1 等转录因子基因在花生小种子突变体种子发育过程中的表达分析
2024-04-01朱秀瑾郭凤丹夏晗赵传志侯蕾
朱秀瑾 郭凤丹 夏晗 赵传志 侯蕾


摘要:花生突变体ssm1 与其对照亲本鲁花11 号(LH11)相比,种子皱缩变小,百仁重、单株生产力和含油量显著降低。 为了探究导致该突变体种子变小且含油量降低的原因,本试验研究了种子发育关键转录因子基因LCE1 等在突变体ssm1 及其对照LH11 合子受精及种子发育不同阶段的表达情况。 结果表明,AhLEC1 在花生未受精子房(DBP0)时期表达量较低,且在ssm1 和对照LH11 中无明显差异,在受精后的子房(DBP1)和入土10 d(DAP10)和20 d(DAP20)种子中表达量上调,并且在LH11 中的表达量极显著高于突变体ssm1、转录因子基因AhFUS3、AhABI3、AhAGL15 和AhWRI1 在ssm1 中表达均有不同程度下调。 其中,与脂肪酸合成和糖酵解关系密切的AhWRI1 基因在ssm1 中的表达量显著下调。 因此推测,ssm1 中AhLEC1 基因的表达量显著下调,影响AhFUS3、AhABI3 和AhWRI1 等基因的表达,进而导致ssm1 种子胚胎发育和油脂积累的异常。
关键词:花生、小种子突变体ssm1、转录因子基因LEC1、基因表达、种子发育、油脂积累
中图分类号:S565.2、Q786文献标识号:A文章编号:1001-4942(2024)01-0010-07
油脂是油料作物种子主要的贮藏物质,为种子萌发和幼苗生长提供能量。 花生(Arachis hy ̄pogaea L.)是我国重要的油料作物之一,我国花生生产量和消费量均居世界第一。 我国食用油大量依赖进口,提高花生油产量是解决油料短缺的有效途径[1] ,提高籽仁含油量和产量是花生育种的重要工作。 研究发现,多种转录因子对种子中油脂积累具有重要的调控作用。 例如,LEAFY COT ̄YLEDON1(LEC1)、LEC2、ABSCISIC ACID INSEN ̄SITIVE 3(ABI3)、FUSCA3(FUS3)、WRINKLED1(WRI1)和AGAMOUS ̄Like15(AGL15)等转录因子在调控胚胎发育、脂肪酸合成和糖酵解途径等方面都起着重要作用[2-14] 。 LEC1 被认为是种子发育的关键调控因子,属于核因子Y(nuclear fac ̄tor-Y, NF-Y)转录因子家族,编码HAP3 复合体的一个亚基,通过与CCAAT 顺式作用元件结合调控基因的表达[3] 。 在胚胎发育早期,LEC1 对维持胚柄细胞以及子叶的特性具有重要意义,而在胚胎发育后期,LEC1 在种子积累储存脂肪和蛋白质等大分子物质以及种子获得抗脱水能力过程发挥重要作用[4-13] 。 在油菜种子中过量表达Bn ̄LEC1 基因可使籽粒中的含油量提高2% ~ 20%,脂肪酸生物合成、蔗糖合成和運输、糖酵解等途径相关基因表达上调,这些生物学途径所需碳通量增加[15] 。 在拟南芥幼苗、种子以及大豆种子中,利用芯片分析LEC1 基因的异位表达和缺失突变体,结果表明,ABI3、FUS 和LEC2 都受到LEC1 的调控[15] 。 WRI1 在拟南芥种子的油脂积累过程中发挥着极其重要的作用,拟南芥wri1 突变体中糖酵解和脂肪酸合成相关基因的表达呈下降趋势[16] ,种子含油量显著降低[17] 。 研究发现,WRI1 控制着多个糖酵解途径关键酶的基因以及参与脂肪酸合成的基因的表达,包括PKP2、乙酰辅酶A 羧化酶(ACCase)、蔗糖合成酶(SucroseSynthase 2,SUS2)等,而WRI1 的表达受到LEC1和LEC2 的调控,因此,LEC 是调节脂肪酸合成代谢的关键基因[16,18] 。 AGL15 编码一种MADS 结构域的转录因子,在种子发育过程中调节LEC2、ABI3 和FUS3 等基因的表达[19] 。
油料作物种子的正常生长发育与种子中油脂的积累密切相关。 植物种子油脂合成途径已经较为清楚,但是调控花生种子油脂合成的分子机理仍不明确,因此阐明花生种子发育过程中油脂合成的调控机理,对花生高油育种有重要意义。 我们前期研究中获得一个种子变小、种皮皱缩的花生突变体ssm1,与对照亲本LH11 相比,该突变体种子含油量显著降低,“球形胚”时期的胚胎明显变小,且胚胎数目变少。 LH11 和ssm1 种子发育不同时期的转录组数据表明,在糖酵解途径及脂肪酸生物合成和代谢途径存在显著富集,参与脂肪酸合成和代谢以及糖酵解途径的众多基因在ssm1 中表达显著下调[20] 。 为分析种子早期发育中的关键调控基因,本研究利用qRT-PCR 技术分析了LEC1 等转录因子基因在突变体合子受精及种子发育时期的表达变化,以期为筛选导致突变表型的候选基因、解析花生发育和油脂积累的调控网络、深入研究调控花生油脂合成的分子机理及培育高含油量花生新品种提供参考。
1 材料与方法
1.1 植物材料
以山东省农业科学院农作物种质资源研究所特色作物资源与分子技术创新团队实验室保存的鲁花11 号(LH11)及其突变体ssm1 作为试验材料。 将LH11 用60 Coγ 辐照诱变,对收获的M2 代种子进行调查,获得一个稳定遗传的小种子株系,命名为ssm1(small seed mutant 1)。
2020 年4 月底将LH11 与突变体M4 代种子种植在山东省农业科学院试验基地,株距20 cm,行距50 cm,单粒播种[21] 。 播种140 d 后收获,对单株结果数、单株幼果数、百果重和百仁重等性状进行统计分析。
于花生开花期和荚果发育不同阶段,采集开花之前未受精的子房(DBP0)、受精1 d 的子房(DBP1)以及入土10 d(DAP10)、20 d(DAP20)、40 d(DAP40)膨大的未成熟种子。 采集的样品用液氮速冻后放入-80 ℃冰箱保存。
1.2 种子营养成分含量测定
含油量及蛋白质、脂肪酸的含量测定分别参照NY/ T 1285—2007、GB 5009.5—2016、GB 5009.6—2016 规程进行,在中国科学院油料作物研究所完成。
1.3 RNA 提取与cDNA 合成
RNA 使用天根公司的RNA 提取试剂盒进行提取,然后利用艾瑞克生物公司的反转录试剂盒进行反转录合成cDNA。
1.4 qRT-PCR 检测
参照陈娜等[22] 的方法和条件进行qRT -PCR。 qRT-PCR 的SYBR Green PreMix 试剂盒购自艾瑞克生物公司。 qRT-PCR 反应体系[23] 为20μL,包括2×SYBR? Green Pro Taq HS Premix 10μL,稀释至8 ng/ μL 的cDNA 2 μL,正、反向引物各1 μL,ddH2O 6 μL。 反应程序:95 ℃ 30 s、95 ℃ 5 s,60 ℃ 30 s,40 个循环。 以花生Actin 基因为内参,每个时期的样品重复3 次,采用2-ΔΔCt法[24] 计算目标基因的相对表达量,用log2FC[log2(Fold Change)] 值表示基因相对表达的差异倍数。 qRT-PCR 所用引物见表1。
2 结果与分析
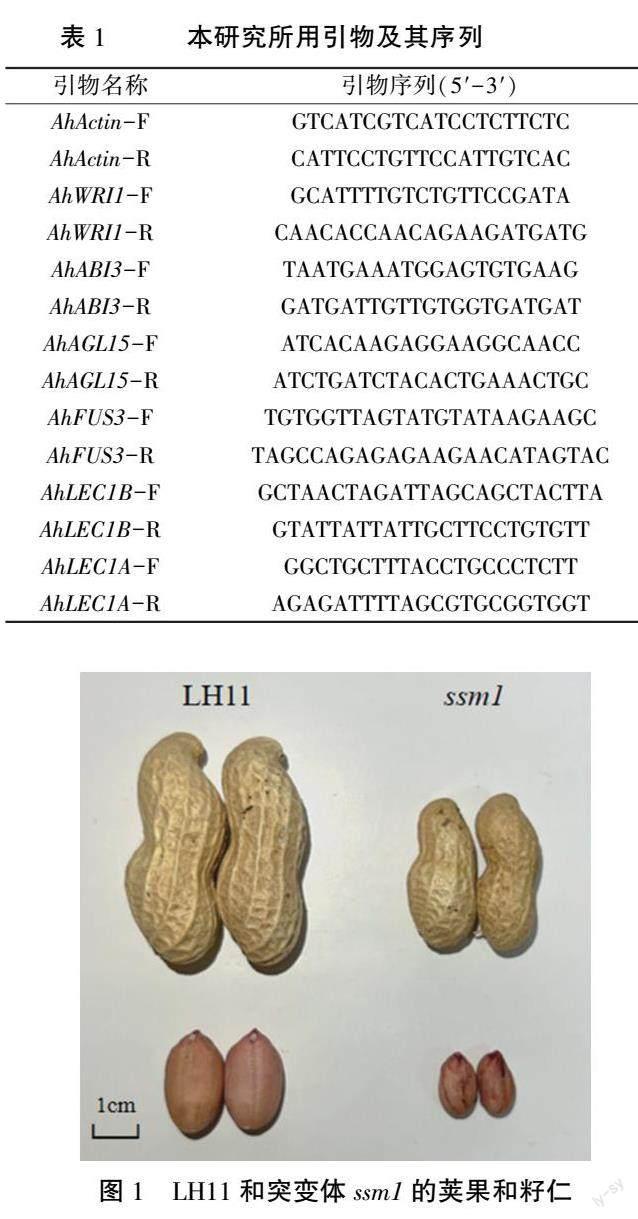
2.1 花生ssm1 突变体表型分析
籽仁大小是影响花生产量的重要农艺性状之一[25] 。 突变体ssm1 的荚果和种子明显小于LH11,且种皮皱缩、颜色较深(图1)。 以LH11 作为对照,对成熟后的突变体ssm1 的部分农艺性状进行分析,发现ssm1 的单株幼果数增多,单株结果数显著增加,分别较对照增加38.46%和88.04%、百果重、百仁重分别较对照降低64.96%、60.31%,差异达极显著水平、公斤仁数极显著增加,约是LH11 的2.5 倍、虽然突变体ssm1 的结果数多,但由于种子变小,幼果数多,产量大幅度降低,单株生产力较LH11 降低34.11%(表2)。
2.2 种子营养成分含量与脂肪酸的组成
对ssm1 和LH11 干种子粗蛋白含量、含油量和主要脂肪酸含量进行测定,结果(表3)表明,ssm1 的含油量显著降低,比LH11 降低13.53%。ssm1 突变体的粗蛋白、棕櫚酸、花生酸含量稍有升高,与LH11 差异较小、硬脂酸、油酸和亚油酸含量略降低,十七碳烷酸、十七碳一烯酸分别比LH11 降低33.33%、25.00%,而亚麻酸、花生一烯酸、山嵛酸、芥酸、二十四碳烷酸含量明显升高。
2.3 LEC1 等转录因子基因的表达
利用qRT-PCR 分别检测了LH11 和突变体ssm1 中AhLEC1A、AhLEC1B、AhFUS3、AhABI3、AhAGL15、AhWRI1 基因在花生合子受精及种子发育不同阶段的表达情况,结果(图2) 表明,在LH11 中,AhLEC1A、AhLEC1B、AhFUS3、AhWRI1 和AhAGL15 在种子发育早期的表达总体上均呈现先上升后下降的趋势,而AhABI3 的表达呈一直上升趋势。 在ssm1 中, 各基因表达水平明显低于LH11,其中,AhLEC1A 和AhABI3 表达呈持续上调趋势、AhWRI1 在DBP0—DAP10 时期表达量升高,之后变化不大,各时期表达量均显著低于LH11、其余基因表达变化趋势基本与LH11 中一致,且除AhLEC1B 在DBP0 和DAP40 以及Ah ̄FUS3 在DAP40 时期外, 表达量均显著低于LH11。 AhLEC1A 和AhLEC1B 在LH11 和ssm1 的未受精子房( DBP0) 中差异不明显, 但是在DBP1—DAP20 时期,即受精后子房以及胚胎发育早期,在ssm1 中的表达显著下调,且AhLEC1B 表达量的升高具有明显的延迟性。 其中,AhLEC1A在DAP10、DAP20 时期表达量分别比LH11 降低52.04%、45.44%、AhLEC1B 在种子胚胎发育早期(DAP10)表达较LH11 大幅下调,降低77.88%。而LEC1 下游调控的转录因子基因AhFUS3、AhA ̄GL15 在种子发育早期(DBP0—DAP20 时期) 的表达量逐步升高,但ssm1 的表达量显著低于LH11、AhABI3 在ssm1 中的表达量明显低于LH11,且除DBP1 外, 均达显著水平。 推测在ssm1 中,AhLEC1 可能作为上游关键调控因子,其表达下调引起AhFUS3、AhABI3、AhWRI1 等下游转录因子基因表达量降低。 例如,AhWRI1 在ssm1种子发育过程中表达量显著降低,在营养物质积累的DAP20 时期其在ssm1 中的表达量比LH11下调82.94%。
3 讨论与结论
LEC1 与植物胚胎发育和种子成熟密切相关,作为先驱转录因子在胚胎发育早期就被激活表达,原胚期和整个胚胎发生过程中都能检测到其表达[26] ,是调控胚胎成熟过程的关键因子[27] 。前期对LH11 和ssm1 的DAP10、DAP20、DAP40时期种子进行了转录组测序,发现与脂肪酸合成和代谢以及糖酵解相关通路中的众多基因在ssm1 中表达显著下调。 本研究对LEC1 等转录因子基因的表达模式进行分析,发现AhLEC1A 和AhLEC1B 在ssm1 合子受精和种子发育早期的表达与LH11 相比大幅度降低且表达延迟。 另外,在子房受精之前,AhLEC1A、AhLEC1B 的表达量在LH11 和ssm1 中差异并不明显,但是受精后开始出现显著差异,直至DAP40 时期两者之间又无明显差异,说明LEC1 在合子受精后开始对早期胚胎发育进行调控。
在LEC1 过表达的油菜和拟南芥中发现脂肪酸种类和脂质水平显著增加[15] 、甘蓝型油菜lec1突变体中种子含油量下降,与糖酵解和脂肪酸修饰的相关基因表达下调[28] 。 WRI1 控制着多个糖酵解途径关键酶的基因以及参与脂肪酸合成的基因的表达。 拟南芥wri1 突变体中关于糖酵解和脂肪酸代谢相关酶活性降低,wri1 种子的含油量降低80%[29] 。 这些转录因子基因在胚胎和种子发育时期特异性表达,过量表达或抑制表达这些基因能提高含油量,证明了它们在调控种子脂肪合成方面的重要作用[15,28] 。 在本研究中,AhL ̄EC1A、AhLEC1B 正常表达的LH11 中其下游转录因子基因AhFUS3 和AhWRI1 在DAP10 时期后大幅度升高、但是在ssm1 中,AhLEC1A、AhLEC1B 在DBP1—DAP20 时期表达下调且显著低于LH11,AhFUS3 和AhWRI1 的表达量同样显著下调且表达量的升高出现延迟性,同时,受到LEC1 调控的ABI3 和调节FUS3 等基因表达的AGL15 转录因子基因在ssm1 中的表达量也降低。 DAP10—DAP20 时期是养分物质积累的重要时期, 在LH11 中LEC1 以及下游转录因子基因的表达趋势与油脂合成相关基因表达趋势一致,都呈上升趋势,与油脂积累同步、而在ssm1 中,LEC1 及其下游转录因子基因表达与LH11 相比在同时期显著下调,油脂合成相关基因表达也显著下调。 作为LEC1 靶基因的WRI1 转录因子在花生小种子突变体ssm1 中表达显著降低,而受WRI1 转录因子调控的PKp2B(丙酮酸激酶)在ssm1 种子中表达量几乎为零,糖酵解途径中FBPB(果糖-1,6-二磷酸酶)和PFKB(磷酸果糖激酶)基因在ssm1中表达也显著下调[20] ,影响了脂肪酸从头合成所需原料乙酰CoA 的正常合成。
ssm1 表現出种子皱缩、种皮颜色较深以及含油量下降的表型,这与拟南芥wri1 突变体[29] 和甘蓝型油菜lec1 突变体[28] 表型基本一致。 可以推测,AhLEC1A、AhLEC1B 作为上游转录因子,其表达量的显著下调影响了AhFUS3、AhABI3 和Ah ̄WRI1 等下游转录因子的表达,进而影响了脂肪酸合成和代谢以及糖酵解途径中基因的表达,导致种子含油量明显降低。 因此推测LEC1 基因参与了早期胚胎的发育调控,并且激活了下游转录因子的表达,共同参与脂肪合成和糖酵解途径。但是关于LEC1 及其下游转录因子如何调控脂肪合成通路还有待进一步研究。
参 考 文 献:
[1] 黄莉,陈玉宁,罗怀勇,等. 花生种子大小相关性状QTL 定位研究进展[J]. 作物学报,2022,48(2):280-291.
[2]Angeles ̄Nú?ez J G, Tiessen A. Mutation of the transcriptionfactor LEAFY COTYLEDON2 alters the chemical compositionof Arabidopsis seeds, decreasing oil and protein content, whilemaintaining high levels of starch and sucrose in mature seeds[J]. Journal of Plant Physiology, 2011,168(16):1891-1900.
[3] Lee H, Fischer R L, Goldberg R B, et al. Arabidopsis LEAFYCOTYLEDON1 represents a functionally specialized subunit ofthe CCAAT binding transcription factor[J]. Proceedings of theNational Academy of Sciences of the United States of America,2003,100(4):2152-2156.
[4] Pelletier J M, Kwong R W, Park S, et al. LEC1 sequentiallyregulates the transcription of genes involved in diverse develop ̄mental processes during seed development[J]. Proceedings ofthe National Academy of Sciences of the United States of Amer ̄ica, 2017,114(32):6710-6719.
[5] Zhang S B, Wong L, Meng L, et al. Similarity of expressionpatterns of knotted1 and ZmLEC1 during somatic and zygoticembryogenesis in maize (Zea mays L.)[J]. Planta, 2002,215(2):191-194.
[6] Yazawa K, Takahata K, Kamada H. Isolation of the gene enco ̄ding carrot LEAFY COTYLEDON1 and expression analysisduring somatic and zygotic embryogenesis[J]. Plant Physiologyand Biochemistry, 2004,42(3):215-223.
[7] Fambrini M, Durante C, Cionini G, et al. Characterization ofLEAFY COTYLEDON1 ̄LIKE gene in Helianthus annuus and itsrelationship with zygotic and somatic embryogenesis[J]. Devel ̄opment Genes and Evolution, 2006,216(5):253-264.
[8] Alemanno L, Devic M, Niemenak N, et al. Characterization ofleafy cotyledon1 ̄like during embryogenesis in Theobroma cacaoL.[J]. Planta, 2008,227(4):853-866.
[9] Cao S, Kumimoto R W, Siriwardana C L, et al. Identificationand characterization of NF ̄Y transcription factor families in themonocot model plant Brachypodium distachyon [ J ]. PLoSONE, 2011,6:107-126.
[10] Salvini M, Sani E, Fambrini M, et al. Molecular analysis of asunflower gene encoding an homologous of the B subunit of aCAAT binding factor[J]. Molecular Biology Reports, 2012,39(6):6449-6465.
[11] West M A L, Yee K M, Danao J, et al. LEAFY COTYLE ̄DON1 is an essential regulator of late embryogenesis and cotyle ̄don identity in Arabidopsis[J]. The Plant Cell, 1994,6(12):1731-1745.
[12] Mu J Y, Tan H L, Zheng Q, et al. LEAFY COTYLEDON1 is akey regulator of fatty acid biosynthesis in Arabidopsis[J]. PlantPhysiology, 2008,148(2):1042-1054.
[13] Junker A, M?nke G, Rutten T, et al. Elongation ̄related func ̄tions of LEAFY COTYLEDON1 during the development of Ara ̄bidopsis thaliana[J]. The Plant Journal: for Cell and Molecu ̄lar Biology, 2012,71(3):427-442.
[14] Tan H L, Yang X H, Zhang F X, et al. Enhanced seed oil pro ̄duction in canola by conditional expression of Brassica napusLEAFY COTYLEDON1 and LEC1 ̄LIKE in developing seeds[J]. Plant Physiology, 2011,156(3):1577-1588.
[15] Kagaya Y, Toyoshima R, Okuda R, et al. LEAFY COTYLE ̄DON1 controls seed storage protein genes through its regulationof FUSCA3 and ABSCISIC ACID INSENSITIVE3[J]. Plant &Cell Physiology, 2005,46(3):399-406.
[16] Ruuska S A, Girke T, Benning C, et al. Contrapuntal networksof gene expression during Arabidopsis seed filling[J]. The PlantCell, 2002,14(6):1191-1206.
[17] Cernac A, Benning C. WRINKLED1 encodes an AP2/ EREBdomain protein involved in the control of storage compound bio ̄synthesis in Arabidopsis[J]. The Plant Journal: for Cell andMolecular Biology, 2004,40(4):575-585.
[18] Baud S,Mendoza M S,To A,et al. WRINKLED1 specifies theregulatory action of LEAFY COTYLEDON2 towards fatty acidmetabolism during seed maturation in Arabidopsis [ J]. ThePlant Journal: for Cell and Molecular Biology, 2007,50(5):825-838.
[19] Zheng Y M, Ren N, Wang H, et al. Global identification oftargets of the Arabidopsis MADS domain protein AGAMOUS ̄Like15[J]. Plant Cell, 2009,21: 2563-2577.
[20] Guo F, Zhu X, Zhao C, et al. Transcriptome analysis and geneexpression profiling of the peanut small seed mutant identifiedgenes involved in seed size control[J]. International Journal ofMolecular Sciences, 2022,23(17):9726-9731.
[21] 李歡倪,仇静静,马俊杰,等. 花生半矮化突变体sdm1 的表型分析与赤霉素响应研究[J]. 山东农业科学,2017,49(12):1-5.
[22] 陈娜,潘丽娟,迟晓元,等. 花生果糖-1,6-二磷酸醛缩酶基因AhFBA1 的克隆与表达[J]. 作物学报,2014,40(5):934-941.
[23] 潘丽娟,梁丹,刘风珍,等. 花生AhFUSCA3 基因的原核表达及在非生物胁迫下的表达分析[J]. 花生学报,2016,45(4):1-4,29.
[24] Livak K J, Schmittgen T D. Analysis of relative gene expressiondata using real ̄time quantitative PCR and the 2-ΔΔCt method[J]. Methods,2001,25(4):402-408.
[25] 郭建斌,李威涛,罗怀勇,等. 花生种子大小相关性状QTL定位及与出仁率的关系[J]. 植物遗传资源学报,2022,23(5):1465-1473.
[26] Tamar L, Masaaki O, Kelly M Y, et al. Arabidopsis LEAFYCOTYLEDON1 is sufficient to induce embryo development invegetative cells[J]. Cell,1998,93(7):5-18.
[27] 郭晓芳,严海燕,何骥,等. 花生ABI3 同源基因的定位分析[J]. 武汉植物学研究,2006,24(1):22-26.
[28] Thomas K, Gil S, Christiane V, et al. Regulation of storageprotein gene expression in Arabidopsis [ J ]. Development,2003,130(24):6065-6073.
[29] Focks N, Benning C. wrinkled1: a novel, low ̄seed ̄oil mutantof Arabidopsis with a deficiency in the seed ̄specific regulationof carbohydrate metabolism[J]. Plant Physiology, 1998,118(1):91-101.
