高寒地区菊芋青贮物料耐低温乳酸菌的筛选与鉴定
2024-03-28魏晓强孙雪梅张海旺王丽慧杨世鹏钟启文芦光新
魏晓强,孙雪梅,张海旺,王丽慧,杨世鹏,司 诚,钟启文,芦光新
(1.青海大学农林科学院, 青海 西宁 810016;2.青藏高原种质资源研究与利用实验室,青海 西宁 810016;3.青海大学农牧学院, 青海 西宁 810016)
青海省位于青藏高原东部,是我国四大牧区之一,平均海拔3 000 m 以上,年均气温≤ 5 ℃,属于典型高寒地区[1]。目前全省草地载畜量1 608.07 万羊单位,位于全国前列,但由于冷季缺草等因素使畜牧业发展严重受阻[2-3]。虽然近年来发展人工种草来缓解饲草不足问题,但受制于特殊气候环境条件,依然无法满足省内庞大的牧草需求[4-5]。种植“食饲两用”经济作物来补充饲草来源是解决问题的有效途径之一。菊芋(Helianthus tuberosus)作为一种收获块茎的“食饲两用”经济作物,具有耐寒[6]、抗旱[7]、耐盐碱[8-9]、耐病、抗逆性强[10]等特点,能适应恶劣的气候环境,在荒地、盐碱地、砂砾等土壤中均可生长。其地上茎叶产量高,营养价值丰富,适口性好,茎叶饲用价值高于马铃薯(Solanum tuberosum)和向日葵(Helianthus annuus),被视为一种优质粗饲料纳入中国饲料原料数据库[11-12]。
青贮作为饲料一种贮藏方式,通过乳酸菌(lactic acid bacteria,LAB)发酵产生有机酸,保证饲料鲜嫩及营养价值,还能刺激家畜食欲,增加采食量[13-14]。菊芋发酵后乳酸、干物质、氨氮含量均符合优等青贮饲料比例[15]。环境温度是影响LAB 活性的重要因素[16]。通常菊芋青贮在室温40~45 d 完成发酵[17],但青海省在菊芋收获期间日平均气温10 ℃左右,夜间有时降到0 ℃以下,低温会延缓发酵进程,增加发酵时间,促进有害菌生长[18-19]。研究表明,环境温度较低时,添加低温LAB 可以有效提高青贮质量。李平[20]以玉米(Zea mays)和苜蓿(Medicago sativa)为青贮原料,15 ℃下添加3 株低温LAB 后,物料pH 和NH3-N 含量降低,乳酸含量显著增加。目前关于菊芋青贮LAB 添加剂的研究只停留在常温筛选[17,21-22],耐低温LAB 添加剂还未见报道,高寒地区因其独特的地理环境,微生物长期生存会具有耐低温、耐酸和耐盐性强等适应环境的特性[23-24],从高寒地区作物源生地采集耐低温LAB 资源更为有效[25-26]。
因此,本研究从高寒地区菊芋地上部青贮物料中分离产酸高、生长快、耐低温的LAB 菌株,通过生理生化鉴定及16S rDNA 测序技术确定菌株属种,以筛选出适合菊芋低温青贮发酵的LAB 添加菌株,为青海省菊芋产业多元化发展及低温青贮技术建立提供理论依据。
1 材料与方法
1.1 试验材料
供试材料选取青海大学农林科学院自主选育品种‘青芋2 号’菊芋。供试材料‘青芋2 号’于2021 年5 月上旬种植在西宁市青海大学农林科学院园艺创新基地试验田(101°44′57.76″ E, 36°43′8.35″ N,海拔2 266.6 m)及贵南县茫曲镇加土乎村(100°46′24.7656″ E,35°33′59.4539″ N,海拔3 084.0 m)农田中。
1.2 试验设计
待菊芋生长至成熟期,2021 年10 月5 日刈割地上部茎叶,粉碎裹包青贮,粉碎长度(2 ± 1) cm,裹包规格550 mm (直径) × 520 mm (高),共3 个裹包;自然环境发酵90 d 后开包削去外层10 cm 青贮料,取内层青贮材料200 g 放入无菌自封袋密封并加入冰袋,每个裹包3 次重复,共9 次重复,2 h 内带到实验室开展LAB 分离纯化。
1.3 指标测定及方法
1.3.1 乳酸菌分离纯化
称取20 g 青贮样品放置于锥形瓶中,加180 mL无菌水充分震荡1 h 混匀,静置30 min 后取上清液依次稀释为10-1、10-2、10-3、10-4、10-5共5 个梯度,制成菌液稀释液。取各梯度稀释液10 μL 涂布于MRS固体培养基,30 ℃倒置培养48 h,综合菌落形态特征进行辨别及编号,挑选单菌落划线扩大培养3 次。编号菌株依次进行革兰氏染色镜检、接触酶(过氧化氢酶)、葡萄糖产气试验,初步判定革兰氏染色试验阳性、接触酶阴性为LAB 菌株,葡萄糖产气阴性为同型发酵LAB,阳性为异型发酵LAB[27]。所筛选的LAB 菌株贮存于NB 培养基(含10%二甲基亚砜),-80 ℃保存。
1.3.2 乳酸菌耐低温能力测定
将贮存于-80 ℃的LAB 菌株4 ℃解冻,MRS液体培养基活化24 h,定菌数到1 × 108cfu·mL-1,按3%接种量接种于新的MRS 液体培养基,恒温培养箱0、5、10、15 ℃培养3 d,培养前后测定吸光度(absorbance, OD600)。生长情况按OD600值增长量划分,增长量0~0.2 为弱生长(W),0.2~0.4 为正常生长(+),0.4 以上为强生长(+ +),0 为不生长(-),液体MRS 为空白对照。
1.3.3 低温乳酸菌功能测定
菌种制备:取100 μL 定菌数到1 × 108cfu·mL-1的活化菌液接种于10 mL MRS 液体培养基中,37 ℃培养48 h 后按3%接种量接种于各试验管中,液体MRS 为空白对照。
产酸:每2 h 测定pH,设置3 次重复,初始pH为6.5,24 h 后绘制产酸曲线。
生长:每4 h 测定OD600值,设置3 次重复,36 h后绘制生长曲线。
耐酸:用HCl 溶液调节管内MRS 培养基pH 为3.0、3.5、4.0、6.0、7.0、8.0,接种72 h 后分析耐酸能力。
耐盐:配置含3.0% 和6.5% NaCl 的MRS 培养基,接种72 h 后分析耐盐能力[26]。
1.3.4 乳酸菌16S rDNA 测序及系统发育树构建
DNA 制备:菌株活化后于MRS 液体培养基培养24 h,收菌体无菌水清洗3 次用于DNA 提取。利用天根细菌基因组DNA 提取试剂盒,参照试剂盒说明书提取各菌株DNA,-20 ℃保存备用。
16S rDNA 扩增测序:采用细菌16S rDNA 通用引物F27 (5′-AGAGTTTGATCCTGGCTCAG-3′)和R1492 (5′-AAGTCGTAACAAGGTAACC-3′),引物合成于华大基因科技有限公司。PCR 反应体系:2 ×PCR Master Mix 10 μL,ddH2O 8 μL,引物(10 μmol·L-1)各0.5 μL,DNA 模板1 μL,总体积20 μL。反应程序:95 ℃ 5 min 预变性,然后94 ℃ 45 s,退火55 ℃45 s,72 ℃ 45 s,30 个循环,最后72 ℃ 1 min,4 ℃保存。PCR 产物进行1%琼脂糖凝胶电泳检测后送四川帕诺米克生物科技有限公司测序。所测得菌株序列上传至www.ncbi.nlm.nih.gov 数据库。
构建系统发育树:将美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库中已知菌株相关序列与所测得菌株16S rRNA 序列进行比对,确定所测菌株种属。MEGA 11.0 进行菌株序列比对与系统进化树的构建。
1.4 数据分析
采用Excel 2019 软件对数据进行基础统计;采用Origin 2022 软件分析菌株生长能力及产酸能力;采用SPSS 21.0 软件对菌株各时间段内生长能力及产酸能力数据统计分析,用平均值±标准误表示测定结果,并对所得数据进行单因素ANOVA 分析及Duncan 法多重比较,P< 0.05 表示差异显著。
2 结果与分析
2.1 乳酸菌分离纯化及耐低温能力鉴定
通过观察菌落形态特征,从MRS 培养基中挑选出298 株LAB 菌株,经革兰氏染色、过氧化氢酶和葡萄糖产气试验,最终筛选出34 株LAB 菌株,其中同型发酵LAB 26 株、异型发酵LAB 8 株(表1);将筛选出的34 株LAB 菌株在0、5、10、15 ℃下培养3 d后进行筛选,发现在0 ℃下菌株均不能生长;5 ℃下有13 株能生长,分别为菌株XN07、XN25、GN02、XN01、XN09、XN11、XN16、XN18、XN24、XN30、XN33、GN10、GN12;10 ℃下13 株能生长;15 ℃下均能生长。根据菌株在低温下的生长能力,选取在5 ℃下能生长的13 株菌株进行后续试验。
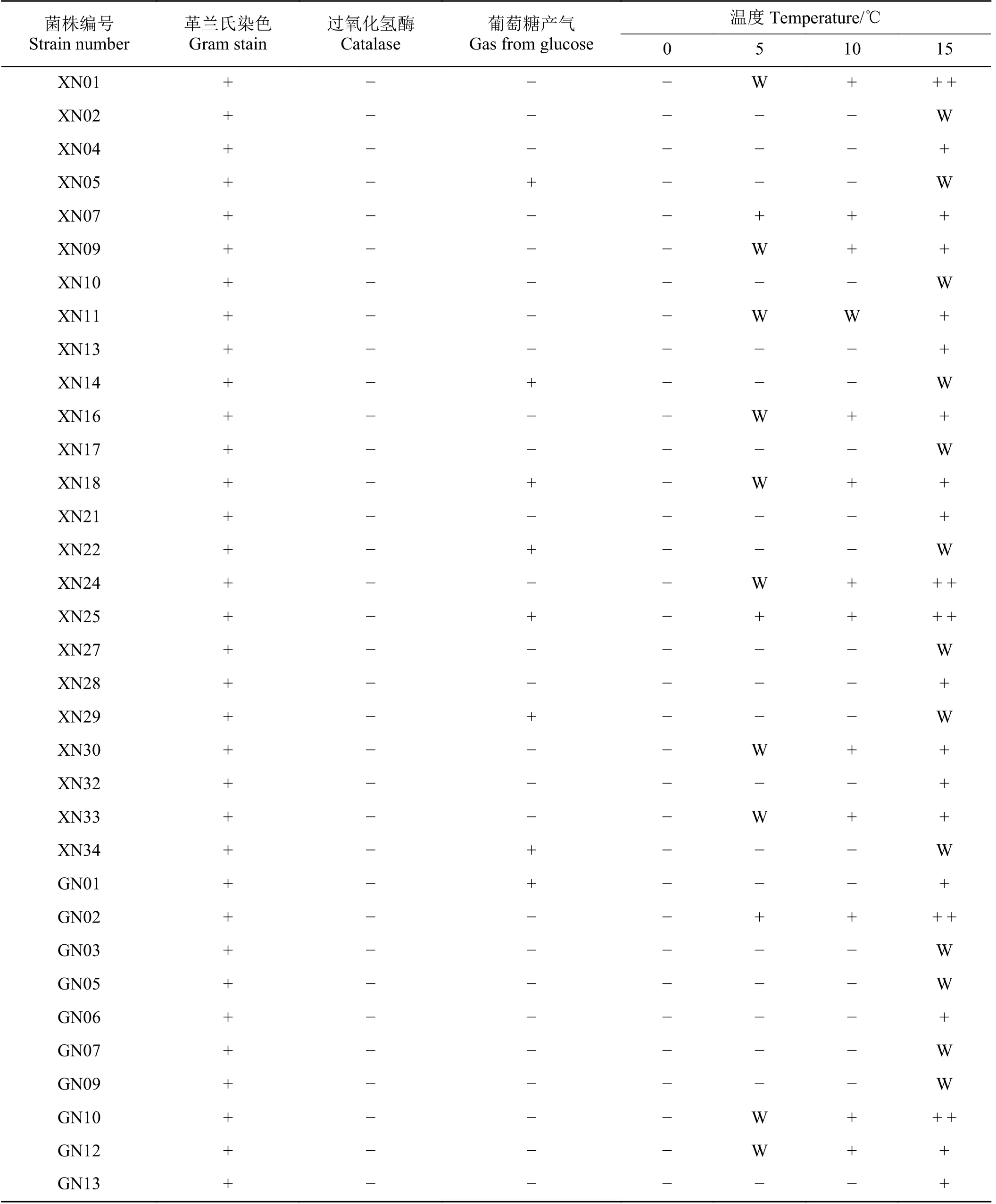
表1 LAB 特征及耐低温能力鉴定Table 1 Characteristics of LAB and identification of low temperature resistance
2.2 耐低温乳酸菌糖酵解及生理生化特性
所筛选菌株XN18、XN25 为异型发酵LAB,其余均为同型发酵LAB。糖酵解试验中同型发酵LAB 菌株能共同发酵的糖有葡萄糖、果糖、乳糖、半乳糖、麦芽糖、蔗糖、纤维二糖、果聚糖、棉籽糖、山梨醇、水杨苷、七叶灵、甘露醇,菌株GN10 能发酵鼠李糖,所有同型发酵LAB 菌株均不能发酵淀粉;异型发酵LAB 菌株中,菌株XN18 不能发酵纤维二糖、果聚糖、淀粉,菌株XN25 不能发酵纤维二糖、淀粉、鼠李糖、山梨醇、水杨苷、甘露醇(表2)。

表2 耐低温LAB 糖酵解及生理生化特性Table 2 Glycolytic mode and physiological and biochemical characteristics of low-temperature-tolerant LAB
13 株耐低温LAB 菌株中,菌株XN01、XN07、XN09、XN24、XN30、GN02、GN10 能在pH 3.0 条件下生长,且均为同型发酵LAB,对低pH 耐受性较强;除异型发酵LAB 菌株XN18、XN25 外,其余菌株均能在pH 3.5 条件下生长;pH 4.0~8.0、NaCl 3%~6.5%条件下,所有菌株都能生长,表现出了较强的耐酸性及耐盐性(表2)。
2.3 耐低温乳酸菌生长及产酸能力分析
所得菌株生长曲线均呈先上升后下降的趋势(图1)。其中菌株XN09、XN24、GN02、GN10 生长8 h后进入对数生长期,OD600值迅速上升,菌株GN02 在24 h 时OD600值为2.63,最早达到生长峰值,且高于其余菌株,菌株XN09、GN10 于28 h 时达到生长峰值;菌株XN01、XN07、XN16、XN25、XN30、XN33、GN12 在12 h 后开始迅速生长,于28、32 h 相继达到生长峰值,菌株XN33 在20 h 时生长速率变缓;菌株XN11、XN18 最晚进入对数生长期,32 h 达到峰值;36 h 后,菌株GN02、GN10、GN12 生长趋于平稳,OD600值分别为2.23、2.26、2.23,高于其余菌株。

图1 耐低温LAB 菌株生长情况Figure 1 Growth of low-temperature-tolerant LAB strains
所有菌株的产酸曲线均呈下降趋势(图2)。0~8 h 内菌株产酸较慢,仅有菌株GN12 产酸较快(pH 5.23),最终pH 为4.29;菌株XN25 在8 h 时降幅开始增大,12 h 时趋于平稳,最终pH 为4.69;10~16 h 时多数菌株都开始迅速产酸,菌株GN02在10 h 时降幅变大,菌株XN01、XN07、XN24、XN33在12 h 时降幅变大,菌株XN09、GN10 在16 h 时降幅变大,并始终保持下降趋势;20~24 h内,所有菌株产酸速率基本趋于平缓;全部产酸过程中,菌株XN11、XN16、XN18、XN30、GN12 降幅较为稳定;24 h 时,所有同型发酵LAB pH 均在4.3 以下,高于异型发酵LAB,菌株XN07、XN09、XN24、GN02、GN10 pH 均在3.8 以下,分别为3.72、3.65、3.72、3.64、3.59,高于其余菌株。

图2 耐低温LAB 菌株产酸情况Figure 2 Acid production by low temperature-tolerant LAB strains
2.4 菊芋青贮耐低温乳酸菌16SrRNA 序列分析
通过16SrRNA 测序分析测得13 株耐低温LAB 序列并上传至NCBI 数据库获得登录号(表3)。结合图3 可知,菌株GN12 与植物乳杆菌Lactiplantibacillus plantarumc10 归为同一族群,进化亲缘度74%,序列相似度98.95%;菌株XN09 与植物乳杆菌L.plantarumKB-7 归为同一族群,进化亲缘度93%,序列相似度98.40%;菌株GN02 与植物乳杆菌L.plantarumHBUAS59622 归为同一族群,进化亲缘度73%,序列相似度99.44%;菌株XN33 与植物乳杆菌L.plantarum2652 归为同一族群,进化亲缘度70%,序列相似度98.75%;菌株XN16 与植物乳杆菌L.plantarumAR113 归为同一族群,进化亲缘度84%,序列相似度97.72%;菌株XN25 与短乳杆菌L.brevis2033 归为同一族群,进化亲缘度100%,序列相似度99.30%;菌株XN18 与棒状乳杆菌L.coryniformisHBUAS56116 归为同一族群,进化亲缘度100%,序列相似度99.23%。菌株XN07、XN11、XN30 与植物乳杆菌L.plantarum3334、L.plantarum8276、L.plantarum1417 归为同一族群,进化亲缘度84%,序列相似度分别为99.09%、98.68%、99.16%。菌株XN01、GN10 与植物乳杆菌L.plantarumHBUAS67128、L.plantarumUIWO2,戊糖乳杆菌L.pentosusHBUAS68361、L.pentosusc18、L.pentosusMRKAK3 归为同一族群,进化亲缘度82%,两种菌株与植物乳杆菌、戊糖乳杆菌的序列相似度均相同。菌株XN24 与植物乳杆菌L.plantarumHBUAS53364、戊糖乳杆菌L.pentosusHBUAS68361 的序列相似度都为95.25%。

图3 耐低温LAB 菌株系统发育树Figure 3 Phylogenetic tree of low temperature-tolerant LAB strains
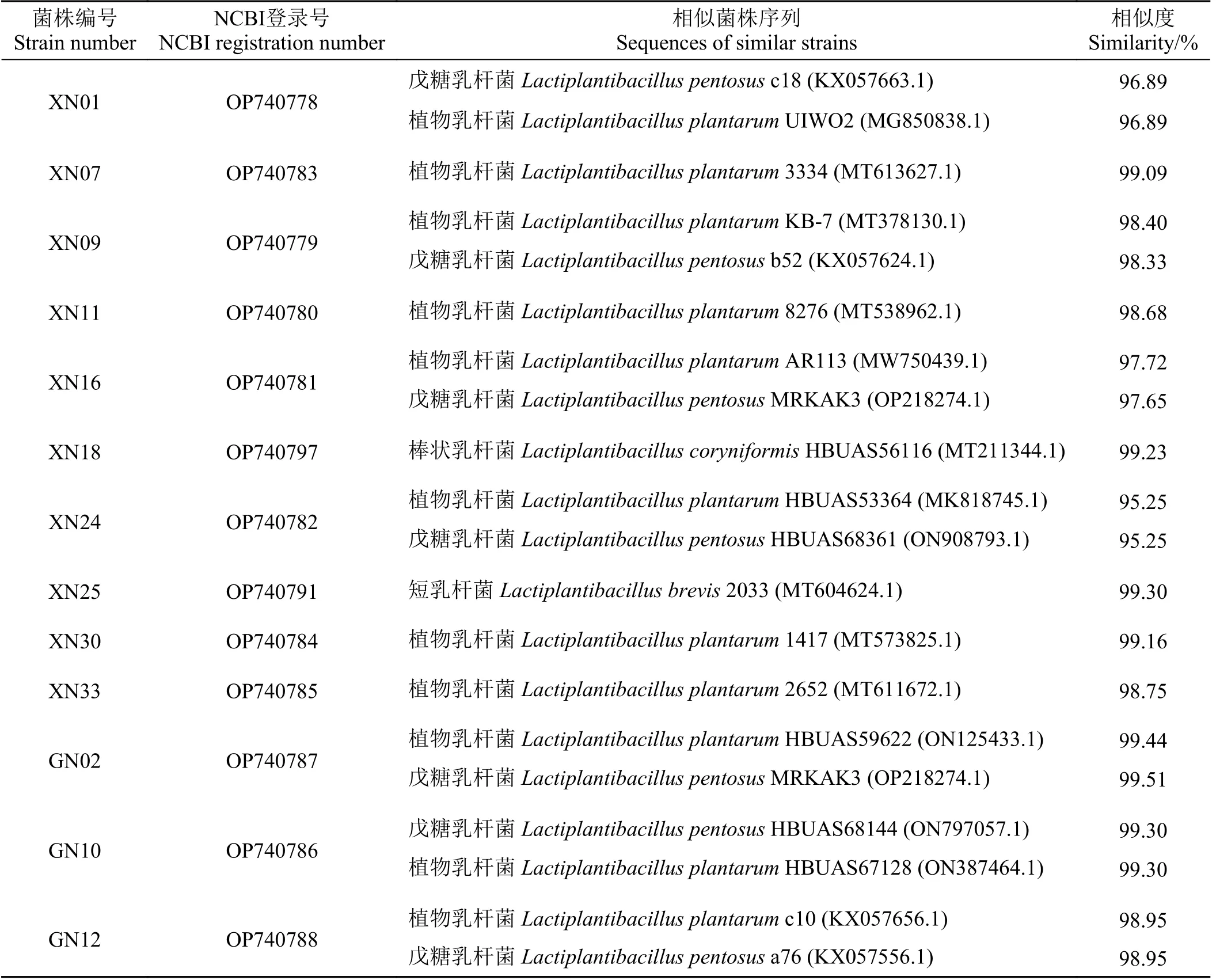
表3 耐低温LAB 菌株相似序列比对Table 3 Comparison of similar sequences of low temperature-tolerant LAB strains
3 讨论与结论
低温是延缓青贮发酵进程的主要因素之一,尤其在常年气温较低的高寒地区,低温延长了青贮饲料的发酵时间,导致青贮饲料中的可溶性物质大量流失,降低了饲料整体营养水平[28]。有研究表明,低温青贮时添加耐低温LAB 可以有效改善发酵进程,调控低温对青贮造成的负面影响,提升青贮品质[29]。Zhu 等[30]在燕麦(Avena sativa)青贮中添加耐低温LAB FO3,5 ℃青贮60 d 后pH、NH3-N 含量均显著降低,乳球菌(Lactococcus schleifer)比例增加,肠杆菌(Enterobacter hormaeche and Edwards)比例减少,显著提高发酵质量,同时调节细菌群落。因此低温青贮中筛选可供添加的耐低温LAB 显得尤为重要。在高寒地区,微生物为应对低温、低氧、低气压等恶劣环境,其功能基因发生突变,形成独特的生理机能和抗逆能力[27]。赵继丽[31]从青海省农牧交错区燕麦 + 箭筈豌豆(Vicia sativa)混播种植方式中筛选得到7 株LAB 在4 ℃培养条件下均可正常生长,菌株GN3 可耐受2 ℃低温条件,并通过基因功能分析发现屎肠球菌(Enterococcus faecalis)GN3 菌株在极端环境下具备与生存能力相关的基因,低温下将其接入4 种燕麦青贮种植方式中均有很好的效果。因此本研究从高寒地区菊芋青贮物料中筛选出13 株耐低温LAB,后续添加到菊芋青贮过程中抵御低温对青贮造成的影响具有很强的可操作性。
LAB 根据糖发酵模式分为3 个代谢类群:不发酵戊糖或葡糖糖酸盐的专性同型发酵LAB,发酵戊糖或葡萄糖酸盐的同型发酵LAB,从葡萄糖产生等量乳酸、CO2、乙酸(或乙醇) 的异型发酵LAB[32]。本研究从高寒地区青贮90 d 的菊芋青贮材料中筛选出13 株能在5 ℃条件下生长的耐低温LAB,其中11 株同型发酵LAB,2 株异型发酵LAB,同型发酵LAB 表现出更强的耐酸性。有研究表明玉米、燕麦等作物在青贮60 d 后优势菌群为异型发酵LAB[30,33],但在本研究筛选菌种中占比更高的是同型发酵LAB,异型发酵LAB 仅有2 株,这可能是因为在发酵初期,外界环境温度比发酵中后期要高,青贮环境中的耐低温同型发酵LAB 逐渐成为优势菌群,抑制了异型发酵LAB 的繁殖;随着发酵时间的推进,异型发酵LAB 一般在发酵后期45~60 d 后开始出现[34],但由于环境温度逐渐降低,低温抑制了异型发酵LAB 的繁殖,最终导致在青贮90 d 后同型发酵LAB 依然是青贮环境中的优势菌群,此情况下同型发酵LAB 会不断消耗材料中的可溶性糖,加速营养物质流失。
青贮生产中一般选用生长能力快、产酸能力强的LAB 添加剂,在青贮发酵起始阶段能快速繁殖产酸,使青贮环境pH 迅速下降,有效抑制有害微生物,保证优良的青贮品质。本研究中,各菌株生长曲线呈先上升后下降的趋势,产酸曲线呈下降趋势,与前人研究结果一致[35],菌株GN02、GN10 表现出更强的生长能力及产酸能力。这也是前人研究中同型发酵LAB 适合作为低温发酵添加剂的依据之一[14,36],但也有研究表明异型发酵LAB 能提升青贮饲料的有氧稳定性[37]。本研究中,异型发酵LAB 菌株XN25 产酸能力与生长能力均高于XN18,在5 ℃条件下能正常生长,具有作为低温青贮发酵添加剂的潜力,这与李海萍等[38]的研究结果相似,但相关研究较少,需进一步挖掘菌株的特异性功能。
基于16S rRNA 编码基因测序技术是目前划分细菌种类最常用的技术之一[39],一般细菌种间进化亲缘度高于70%,序列相似度大于97%可以判定为同种细菌[40]。本研究中,菌株XN01、GN10 与植物乳杆菌和戊糖乳杆菌进化亲缘度为82%,且植物乳杆菌和戊糖乳杆菌在序列上的差异仅有2 bp;依据《乳酸细菌分类鉴定及试验方法》[41],植物乳杆菌不能发酵鼠李糖,戊糖乳杆菌能发酵鼠李糖;因此结合糖酵解结果鉴定出菌株XN01 为植物乳杆菌,菌株GN10 为戊糖乳杆菌;菌株XN24 序列相似度为95.25%,小于97%,不满足鉴定条件,无法判定其种别。
综上,本研究从高寒地区菊芋青贮材料中筛选出12 株耐低温LAB,分别为植物乳杆菌XN01、XN07、XN09、XN11、XN16、XN30、XN33、GN02、GN12,戊糖乳杆菌GN10,棒状乳杆菌XN18,短乳杆菌XN25。综合产酸及生长能力,优选出植物乳杆菌GN02、戊糖乳杆菌GN10、短乳杆菌XN25 适合作为青海高原菊芋青贮发酵LAB 添加剂。
