单宁酸对豌豆蚜谷胱甘肽-S-转移酶活性与基因表达的影响
2024-03-28王继祖王森山宋丽雯
王继祖,刘 磊,王森山,宋丽雯
(甘肃农业大学植物保护学院, 甘肃 兰州 730070)
豌豆蚜(Acyrthosiphon pisum)是豆科作物上的一种害虫,具有繁殖速度快、环境适应性强等特点,近年来对苜蓿(Medicago sativa)等豆科植物的产量和质量造成了严重的威胁。在我国西北苜蓿种植区,豌豆蚜每年给苜蓿生产造成10%~30%的经济损失[1]。
单宁酸是植物的次生代谢产物,通过影响昆虫的取食,从而对昆虫的生长发育产生不利影响[2]。邵娅等[3]研究发现,单宁酸对豌豆蚜的生长发育及繁殖具有明显抑制作用。陆宴辉等[4]用单宁酸饲喂蚜虫发现,当浓度在100 mg·kg-1以内时,单宁酸对棉蚜(Aphis gossypii)的生长发育具有抑制作用;当单宁酸浓度大于200 mg·kg-1时,棉蚜死亡率高达100%。单宁酸、没食子酸还明显抑制麦长管蚜(Sitobion avenae)羧酸酯酶(carboxylesterase, CarE)和谷胱甘肽-S-转移酶(glutathione-S-transferaes, GST)的活力,降低蚜虫解毒能力[5]。有研究表明,虽然苜蓿中含有单宁酸,但是豌豆蚜可以在苜蓿上正常生长发育[6],表明其具有代谢单宁酸的能力。
谷胱甘肽-S-转移酶是具有多种功能的超基因家族酶系,普遍存在动植物、微生物中。目前研究表明,昆虫谷胱甘肽-S-转移酶基因分为Delta、Epsil、Omega、Sigma、Theta和Zeta6 个家族,其中Delta和Epsilon家族是昆虫特有的GSTs家族[7]。现已报道的豌豆蚜20 个GST基因主要以Delta和Sigma亚家族为主[8]。GST 主要功能是催化有毒物质形成低毒、易溶于水的化合物而排出体外,减少或避免对机体造成损伤[9]。GST 作为昆虫代谢外源物质的主要酶之一,其活性受到植物次生物质的诱导。研究表明,肉桂酸、水杨酸、花椒毒素、槲皮素、黄酮、香豆素、单宁酸、没食子酸和芦丁等植物次生物质均能诱导斜纹夜蛾(Spodoptera litura)体内GST 活性[10]。Wang 等[11]的研究结果表明,取食添加芦丁、槲皮素、尼古丁、苦参碱、印楝素或鱼藤酮的人工饲料后,短星翅蝗(Calliptamus abbreviatus)的GST 活性均显著增加。亚洲小车蝗(Oedaleus asiaticus)的GST活性与食物中植物次生化合物的含量呈正相关关系[12],类似的结果也在麦长管蚜中发现[13]。表明不同的植物次生物质均可诱导昆虫体内GST 活性,且在一些昆虫中存在剂量效应。
GST家族基因在昆虫代谢植物次生物质的功能已经被证实。斜纹夜蛾8 个GST基因经番茄碱处理后上调,RNA 干扰降低其中一个GST基因GSTS1的表达后,番茄碱对幼虫的毒性增加[14]。花椒毒素、单宁酸、没食子酸或芦丁等植物次生物质均可引起斜纹夜蛾SlGSTE1转录水平显著上调[15]。此外,降低褐飞虱(Nilaparvata lugens)体内NlGSTE1的表达量,导致褐飞虱对阿魏酸的敏感性增加[16]。干扰NlGST1-1的转录水平,导致褐飞虱对含有芦竹碱的饲料更加敏感[17],此外,褐飞虱NlGST1-1的转录水平被降低后,若虫的相对增长率和雌虫繁殖力也显著降低[18]。这些研究结果表明一种植物次生物质可以诱导多个GST基因的上调,而且一个GST基因可以参与昆虫对多种植物次生物质的代谢,但豌豆蚜中GST基因的转录是否受到单宁酸的影响尚不清楚。
为明确单宁酸对豌豆蚜体内GST 活性的影响,解析豌豆蚜不同组织GST基因在单宁酸处理前后转录水平的差异及变化规律,本研究以绿色型豌豆蚜为供试材料,测定豌豆蚜在单宁酸处理48 h 后GST 活性变化;通过分析文献与豌豆蚜基因组数据,确定豌豆蚜体内存在22 条GST基因;利用qPCR 解析豌豆蚜不同组织GST基因转录水平对单宁酸的响应,旨为探究GST基因在豌豆蚜代谢单宁酸中的功能奠定一定的基础。
1 材料与方法
1.1 供试虫源
挑选发育健康的绿色型豌豆蚜成蚜于离体蚕豆(Vicia faba)叶片上,在光照培养箱内进行培养[温度:25 ℃,光周期:16 h/8 h (光/暗)],待产蚜后剔除成蚜,培育至3 龄若蚜时用于试验。
1.2 主要仪器与试剂
主要仪器:酶标仪(BioTek Instruments, Inc)、高速冷冻离心机、HQH-H300 智能人工气候箱(上海跃进医疗器械有限公司)、荧光定量PCR 仪(美国Applied Biosystems 公司)、Eppendorf 型移液枪和水浴锅等。
主要试剂:异丙醇(甘肃中瑞化工有限公司)、氯仿(成都市科隆化学品有限公司)、无水乙醇(成都市科隆化学品有限公司)、谷胱甘肽-S-转移酶活性检测试剂盒(上海优选生物科技有限公司)、反转录试剂盒试剂盒(宝生物工程Takara 有限公司)、qPCR试剂盒(苏州近岸蛋白质科技股份有限公司)等。
1.3 研究方法
1.3.1 单宁酸对豌豆蚜GST 活性的影响测定
试验设置对照和处理两组。采用离体叶片植物介导法[19],将蚕豆苗插入1.5 mL 离心管中,再加入2 g·L-1单宁酸1 000 μL。然后将离心管转移至一个覆盖着纱布的透明塑料杯中,之后将3 龄若蚜挑取至塑料杯中的蚕豆苗上。让其摄入单宁酸48 h,对照为清水。每个处理40 只蚜虫,48 h 后每个处理收集0.02 g 蚜虫鲜重,用于GST 活性测定,3 个生物重复。收集的蚜虫经液氮冷冻后保存于-80 ℃冰箱备用,测定时加入缓冲液研磨,制成酶液。
GST 活性测定方法:使用GST 活性检测试剂盒,参照说明书测定并计算出豌豆蚜的酶比活力。
1.3.2 单宁酸对豌豆蚜GST基因表达的测定
1)样品收集
试验设置同1.3.1,每处理设4 个重复,每个重复50 只蚜虫,48 h 后进行解剖,分别收集头、胸、腹、中肠。收集的蚜虫组织经液氮冷冻后保存于-80 ℃冰箱备用。
2) cDNA 的制备
将样品在低温环境下研磨,用Trizol 法提取各组织总RNA,ScanDrop 微量核酸蛋白测定仪测定总RNA 浓度,选择A260/A280> 1.8 且A260/A230> 1.8的样品,按照反转录试剂盒使用说明进行反转录。转录后的cDNA 保存于-20 ℃作为qPCR 模板备用。
3)引物设计
豌豆蚜GTS基因的引物序列如表1 所列。

表1 豌豆蚜GST 基因qRT-PCR 引物序列Table 1 Primer sequence from qRT-PCR for the GST genes of pea aphids
1.4 数据分析
采用Excel 2016 统计试验数据,整理后的数据根据2-ΔΔCt法计算相对表达量[20]。使用SPSS 23.0 软件进行统计分析,用独立样本t检验进行基因表达量显著性分析,以P< 0.05 表示差异具有统计学意义,使用Origin 2018 软件进行绘图。
2 结果
2.1 单宁酸对豌豆蚜GST 活性的影响
豌豆蚜取食2 g·L-1单宁酸48 h 后,其GSTs 活性为7.598 nmol·(min·g)-1,对照组GSTs 活性为11.036 nmol·(min·g)-1。测定结果表明,GST 活性有所下降,但与对照组相比差异不显著(P> 0.05)。
2.2 单宁酸对豌豆蚜GST 基因qRT-PCR 分析
2.2.1 豌豆蚜头部GST基因qRT-PCR 分析
通过对豌豆蚜头部GST基因表达量测定分析,结果显示,蚜虫取食单宁酸后,其头部有11 个基因表达水平变化显著(P< 0.05) (图1),其中ApGST101、ApGST102、ApGST104、ApGST109、ApGST2、ApGSTX1、ApGSTD6显著上调表达(图1A),ApGST101表达量上调2.5 倍;ApGST104、ApGSTX1上调表达3 倍左右;ApGST103、ApGST108、ApGSCD、ApGSTomega表达量下调(图1B),其中ApGST108、ApGSTCD下调表达3 倍左右;ApGST103、ApGSTomega下调表达1.4 倍左右。有11 个基因表达水平不显著(P> 0.05) (图1C)。
2.2.2 豌豆蚜胸部GST基因qRT-PCR 分析
蚜虫取食单宁酸后,其胸部有15 个基因表达水平变化显著(P< 0.05) (图2),其中ApGST101、ApGST102、ApGST103、ApGST104、ApGST109、ApGST2、ApGSTX4、ApGSTD5、ApGSTD6、ApGSTthet均上调表达,ApGSTD6相对表达量为对照组的6.4 倍;ApGST107、ApGST108、ApGST3、ApGSTX3、ApGSTomega被单宁酸抑制,呈下调表达(图2B),其中ApGST107、ApGSTomega下调表达5 倍左右;ApGST108、ApGST3、下调表达3.5倍;ApGSTX3下调表达1.6 倍。有7 个基因表达差异不显著(P> 0.05) (图2C)。

图2 豌豆蚜取食单宁酸48 h 胸部GST 基因表达量的变化Figure 2 Changes in GST genes expression in the thorax of pea aphids treated with tannic acid for 48 hours
2.2.3 豌豆蚜腹部GST基因qRT-PCR 分析
蚜虫取食单宁酸后,其腹部有16 个基因表达水平变化显著(P< 0.05) (图3),ApGST101、ApGST103、ApGST104、ApGST105、ApGST107、ApGST702、ApGSTX1、ApGSTX5、ApGSTD6、ApGSTthet显著上调表达,其中ApGST101、ApGST105表达量达到对照的5 倍;在单宁酸诱导下,ApGST108、ApGST109、ApGSTD5和ApGSTomega下调表达2 倍左右(图3B);ApGST3、ApGSTX3分别下调表达3.9 倍和6.2 倍。有6 个基因表达量差异不显著(P> 0.05) (图3C)。
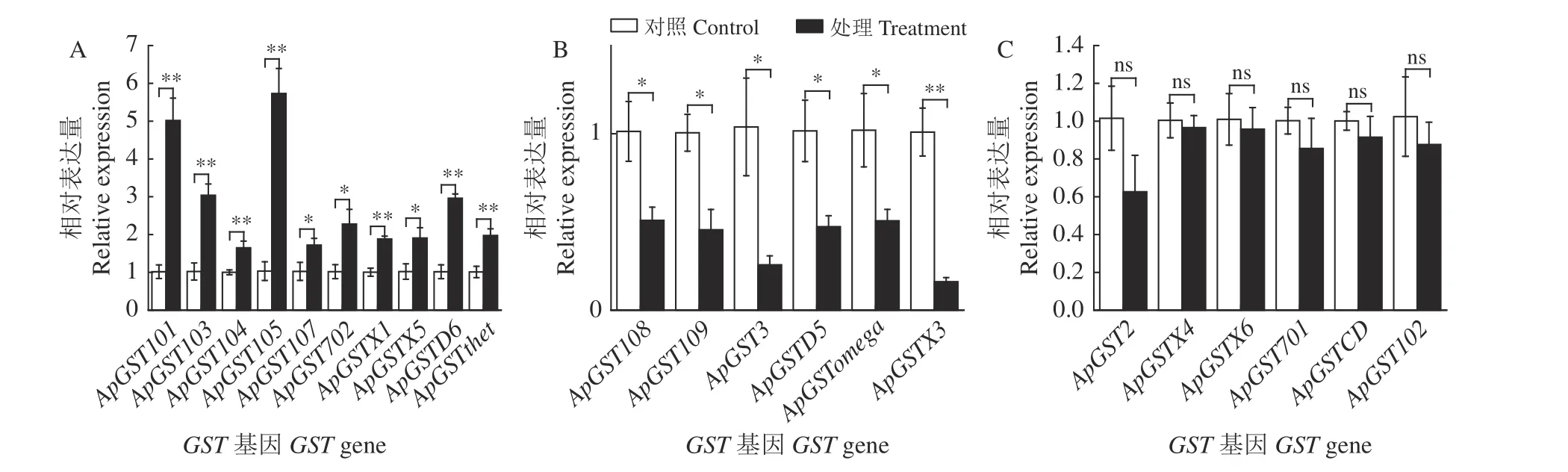
图3 豌豆蚜取食单宁酸48 h 腹部GSTs 基因表达量的变化Figure 3 Changes in GST gene expression in the abdomen of pea aphids treated with tannic acid for 48 hours
2.2.4 豌豆蚜中肠GST基因qRT-PCR 分析
蚜虫取食单宁酸后,其中肠有13 个基因表达水平具显著性差异(P< 0.05) (图4),其中ApGST104、ApGST105、ApGST107、ApGST2、ApGST3、ApGSTD6、ApGSTX4、ApGSTX6、ApGSTCD显著上调表达(图4A),APGST105表达量上调最高,为对照的3.2 倍;有4 个基因下调表达(图4B),ApGSTomega下调表达最高,为7 倍左右;ApGST102和ApGST701下调表达2 倍左右;ApGSTthet下调表达3.3 倍。有9 个基因表达量差异不显著(P> 0.05) (图4C)。

图4 豌豆蚜取食单宁酸48 h 中肠GST 基因表达量的变化Figure 4 Changes in GST gene expression in the midgut of pea aphids treated with tannic acid for 48 hours
3 讨论
单宁酸是植物次级代谢产物,广泛存在于植物中,对许多害虫物种的生长具有内源性抑制作用[21]。研究表明,单宁酸在昆虫肠道中会与叶蛋白或消化酶形成复合物,降低昆虫对食物的利用率并延缓昆虫生长发育[22-23]。解毒酶在昆虫代谢外源物质中发挥重要的作用,是维持昆虫正常生理功能的重要物质[24]。昆虫的主要解毒酶包括细胞色素P450 酶(Cytochrome P450, CYP450)、GST、羧酸酯酶(CarE)等。昆虫在代谢外源物质的过程中,GST 将其底物与谷胱甘肽分子结合,使底物更易溶于水;CYP450氧化其底物使其对偶联酶具有反应性;CarE 可水解许多含有内源性和外源性酯的化合物[25]。解毒酶在昆虫与寄主植物之间的相互作用中具有重要作用[26]。本研究发现单宁酸可影响GST 的活性并且在不同组织中对GST基因表达有一定的影响。
植物次生物质对不同昆虫的作用效果也不同。辣椒素对烟青虫(Helicoverpa assulta) GST 有显著的诱导作用,番茄苷则抑制其活性。而番茄苷、辣椒素对棉铃虫(Helicoverpa armigera) GST 并无显著影响[27]。本研究发现,豌豆蚜取食2 g·L-1单宁酸48 h后,GST 活性下降,可能是由于豌豆蚜吸收单宁酸含量超过了自身解毒代谢的极限,导致解毒代谢功能下降,GST 活性降低。单宁酸对GST 活性的影响取决于剂量和时间,低剂量或短时间用单宁酸处理,GST 活性升高,反之,GST 活性降低或没有影响[28]。如单宁酸对杨小舟蛾(Micromelalopha troglodyta) GST诱导具有明显的剂量效应和时间效应关系[29]。通过对马铃薯块茎蛾(Phthorimaea operculella)进行含烟碱饲料饲喂,发现烟碱处理后其体内解毒酶CarE和GST 的含量呈逐渐降低的趋势,可能是马铃薯块茎蛾为了适应烟碱而作出的响应[30]。
研究发现,槲皮素等可以诱导棉铃虫GST基因的上调表达,表明GST基因可能参与了棉铃虫对槲皮素的代谢过程[31]。此外,番茄碱可以诱导斜纹夜蛾GST基因的上调表达,利用RNA 干扰降低其中一个GST基因的表达后,番茄碱对幼虫的毒性增加[32]。本研究通过实时荧光定量RT-qPCR 分析了蚜虫中肠、头部、胸部和腹部中22 个条GST基因的mRNA 相对表达水平。结果显示,GST基因在蚜虫不同组织中具有多样化的表达模式。其中ApGST101在头部的表达量上调了2.5 倍,ApGSTD6在胸部中的相对表达水平上调6.4 倍。这可能是由于唾液腺在解剖过程中并未分离的原因。昆虫唾液腺具有排毒、抵抗植物次生物质和外源有毒物质的作用[33]。不同组织中,桃蛀螟(Dichocrocis punctiferalis)CYP4G113基因在唾液腺中的表达量最高。CYP4G113基因被干扰后,幼虫在玉米(Zea mays)上的存活率、化蛹率等生命参数显著降低。这可能是CYP4G113基因被干扰后影响了桃蛀螟对寄主次生物质的代谢,有毒物质大量积累,导致死亡[34]。当桃蚜(Myzus persicae)取食含有茉莉酸和水杨酸的人工饲料后,唾液腺特异表达基因C002和sigma GST基因表达量显著升高,表明桃蚜利用寄主植物次生代谢产物,提高相关解毒酶或唾液蛋白基因表达量,增强对寄主防御的适应性[35]。
本研究中,ApGST105在中肠组织中表达水平最高。中肠是外源化合物解毒的重要部位,含有高水平表达的GST基因[36]。所以推测ApGST105基因可能参与了豌豆蚜对单宁酸的代谢过程。在对其他昆虫的研究中也有类似结果,如美国白蛾(Hyphantria cunea)取食添加绿原酸的人工饲料后,中肠中1 个GST基因的mRNA 水平被显著诱绿原酸诱导[37]。此外,昆虫的脂肪体在其对植物次生代谢物和外源毒素解毒代谢的过程中也有重要作用[38]。如斜纹夜蛾进食0.01%单宁酸、0.5%单宁酸后,脂肪体SlGSTe1的表达量显著上升,说明在一定浓度范围内,单宁酸可以使脂肪体的SlGSTe1表达上调[14]。而本研究中ApGST105在腹部中表达量上调5 倍,可能是因为脂肪体参与了豌豆蚜代谢单宁酸的过程。
经单宁酸处理48 h 后,豌豆蚜体内GST 活性降低,但部分GST基因显著上调表达。这可能与豌豆蚜部分GST基因下调倍数较高有关。
4 结论
本研究结果显示,单宁酸对GST 活性以及GST基因的转录都产生了影响。后期将根据定量分析GST基因表达量的结果,筛选出关键基因,用RNAi技术验证关键基因的基因功能,进一步阐释豌豆蚜对单宁酸代谢机制。
