基于术前磁共振小肠成像预测克罗恩病患者首次肠切除术后早期吻合口复发风险
2024-03-26何伟涛申晓迪王杨迪杜金芳李雪华熊珊珊李周雷林少春
何伟涛 申晓迪 王杨迪 杜金芳 李雪华 熊珊珊 李周雷 林少春
中山大学附属第一医院1放射科,2消化内科 (广州 510080)
克罗恩病(Crohn′s disease,CD)是一种慢性复发性炎症性肠病,常伴有肠梗阻、肠瘘或肠周脓肿形成[1-2]。约70%的CD患者在确诊后因肠道并发症或保守治疗无效需要行病变肠管切除术[3]。然而,术后1年内,约25%的患者会出现临床复发,超过50%的患者出现内镜复发,而且大部分发生于手术吻合口区域,经常需要再次或反复的手术[4-5]。反复手术可能会导致短肠综合征,导致患者预后不良。早期吻合口复发(early anastomotic recurrence,EAR)高风险的患者在术后积极进行早期药物预防,可有效改善其预后[6]。因此,根据CD患者的EAR风险程度对CD患者进行分层后个体化治疗,是改善其预后和避免再次手术最经济有效的方法。
内镜是目前监测吻合口复发的金标准,并建议在术后6 ~ 12个月内进行[3,7]。影像学对诊断CD术后复发也有较高的准确性[8-9];然而,大部分研究都聚焦于EAR的术后评估,而不是术前预测。在临床上,超过50%的内镜复发患者术后1年内并无明显的临床症状[5],因此患者接受及时随访复查的主观意愿并不强,导致诊断延误和治疗效果下降。如果术前就能对EAR高风险患者进行准确识别,术后及时进行药物预防[6],可降低其复发率并改善预后。
磁共振小肠成像(magnetic resonance enterography,MRE)是评估CD的最重要影像学检查技术[10-11]。结合常规MRE[12]和功能性MRE,如磁化传递成像(magnetization transfer imaging,MTI)[13]和扩散加权相关成像(diffusion-weighted imaging,DWI)[14-16],可提供更全面的病理生理学信息甚至预测复发风险的工具。
本研究旨在术前众多资料中筛查可预测EAR的有效危险因素,并构建一种用于术前预测CD患者首次肠切除术后EAR(≤ 12个月)风险度的列线图模型。为了评估术前指标具备有效预测性,我们在研究前期也同步纳入了术中和术后的可能危险因素进行分析。
1 资料与方法
1.1 患者纳入和排除标准回顾性收集中山大学附属第一医院2015年1月至2018年12月经临床、影像学、内镜及病理综合确诊为CD的择期手术患者的术前(临床、实验室指标、影像)、术中和术后(病理、药物治疗)资料。所有患者均行传统CD肠切除术,即在切除病变肠管时,与肠缘平齐分离并保留病变肠管周围的肠系膜[17]。纳入标准:(1)经临床、影像学、内镜及病理综合确诊为CD;(2)术前行多参数MRE;(3)手术前后临床等资料齐全,在术后有可探及吻合口的内镜复查。排除标准:(1)既往有肠管切除术史;(2)合并其他肠道疾病;(3)MRE图像质量差或MRE距离手术超过3个月;(4)图像质量不佳;(5)术后肠镜复查距离手术时间超过12个月。本研究经本院伦理委员会批准([2020]351;[2021]140),豁免知情同意。
1.2 术前资料收集
1.2.1 术前临床和实验室检查资料由1名放射科医生从电子病历中收集患者术前1周内的临床和实验室检查数据,包括性别、年龄、病程、身高、体质量指数(body mass index,BMI)、吸烟史、C反应蛋白、红细胞沉降率[6]。
1.2.2 MRE扫描方案患者在MRE检查前进行了常规肠道准备[13]。采用3.0-T MR(Magnetom Trio;德国西门子医疗)扫描仪及多通道相控阵体线圈进行扫描,扫描范围自肝顶至耻骨联合,患者取仰卧位。所有患者均行MRE平扫及增强扫描、DWI和MTI检查。扫描序列包括:(1)T2加权成像(T2-weighted imaging,T2WI);(2)DWI,后处理获得扩散峰度成像(diffusion kurtosis imaging,DKI)和体素内不相干运动(intravoxel incoherent motion,IVIM)成像;(3)MTI;(4)脂肪抑制三维容积内插屏气序列(three dimensional volumetric interpolated breath-hold examination,3D-VIBE)T1WI,采用高压注射器以2 mL/s的流速经右侧肘前静脉注射0.2 mL/kg钆喷酸葡胺注射液(Gd-DTPA,北京北陆药业股份有限公司),注射对比剂后立即以相同流速注射0.9%的生理盐水共20 mL,于注射前及注射对比剂后第15秒、第70秒和第7分钟采集动态对比增强图像。
1.2.3 肠道病灶在MRE图和手术切除标本上的匹配定位由1名具有多年腹部影像诊断经验的放射科医师,在知晓患者临床资料的情况下,根据手术记录及大体照片上的肠管解剖标志(如回盲瓣或阑尾,病灶最狭窄部位、肠粘连或肠瘘),将肠道病变最严重处在术前影像和手术切除标本上进行区域对区域的定位标记[13]。
1.2.4 肠道病灶及肠周脂肪的常规MRE序列分析由2名具有多年肠道影像诊断经验的放射科医师,在不知晓临床、手术和病理信息的情况下,对已标记病灶的MRE图进行独立阅片。评价2名医师评估结果的观察者间一致性;然后二人再对定性变量共同讨论达成一致意见,作为最终结果后续分析,定量变量以2名医师测量平均值为最终结果。本研究同时对病变肠段及其周围肠系膜脂肪的MRE参数进行了评估。病变肠段的常规定量参数包括:肠壁最大厚度、最狭窄处内径、狭窄近端肠管最大处内径、狭窄指数(狭窄肠段近端最大内径与最狭窄处内径之比)[18];常规定性参数包括:肠壁不对称增厚[19]、肠壁T2WI信号强度、肠壁动脉期强化方式[12]、小肠梗阻[19]、肠管假憩室样扩张[20]、肠黏膜假息肉样增生[21]。病变肠段周围肠系膜的常规MRE参数包括:肠系膜爬行脂肪指数(mesenteric creeping fat index,MCFI)、肠系膜脂肪增生[12,22]、淋巴结肿大[23]、梳状征[24]、腹盆腔积液和穿透性病变(如脓肿/炎性包块)。
1.2.5 肠道病灶及肠周脂肪的功能MRE序列分析此外,我们还在功能MRE上分析了病变肠道及其周围脂肪的特征。使用MATLAB(MathWorks,Natick,MA)后处理软件绘制感兴趣区域(region of interest,ROI),分别测量DWI、DKI、IVIM和MTI的定量参数。首先选择病变最严重的肠壁勾画3个ROIs获得相应参数值,ROI需覆盖肠壁全层。另有3个ROI放在离切除肠壁约1 cm的肠系膜上,避开血管和淋巴结。3个ROI的平均值作为最终结果。测量DWI上的表观扩散系数(apparent diffusion coefficient,ADC),DKI上的非高斯分布的表观扩散系数(apparent diffusion for non-Gaussian distribution,Dapp)和表观扩散峰度(apparent diffusional kurtosis,Kapp),IVIM上的扩散系数(diffusion coefficient,D)、假性扩散系数(pseudodiffusion coefficient,D*)和灌注分数(perfusion fraction,f),以及病变肠壁的磁化传递率(magnetization transfer ratio,MTR)、病变肠壁的标准化MTR1=MTR病变肠壁/MTR肌肉和标准化MTR2=(MTR病变肠壁-MTR正常肠壁)/(MTR肌肉-MTR正常肠壁)。
1.3 手术或术中资料收集从患者手术病历中收集手术或术中相关信息,包括手术指征、术式、切除肠段范围。
1.4 术后资料收集
1.4.1 术后标本病理分析由一名肠道病理医生选取肠道病变最严重处的病理玻片[13]并使用半定量评分系统(0 ~ 4分),在苏木精-伊红染色上行炎症评分和在马松三色染色上行纤维化评分[25]。
1.4.2 术后药物治疗信息收集患者术后早期的药物预防策略。术后早期药物预防定义为术后给予免疫抑制剂(如硫唑嘌呤和6-巯基嘌呤等),或抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)药物(如英夫利昔单抗等治疗);无术后早期药物预防定义为术后未予CD相关的药物治疗,或只予常规抗生素或美沙拉嗪治疗[6]。
1.5 术后吻合口复发标准由1名消化内科医师对吻合口区域(即吻合口和吻合口以近约10 cm的肠段[8])复发进行评估。吻合口复发定义为内镜复发或手术复发[7]。术后12个月内吻合口区域内镜Rutgeerts评分≥ I2或需要再切除吻合口的患者定义为EAR。术后12个月内吻合区内镜Rutgeerts评分为I0或I1且不需再切除吻合口的患者定义为无EAR。
1.6 统计学方法使用SPSS 20.0版(IBM Corp.,Armonk,NY,USA)和R 3.6.1版(http://www.rproject.org)进行统计学分析。P< 0.05认为差异有统计学意义。
连续变量用均数±标准差或中位数(四分位数间距)表示,采用Mann-WhitneyU检验比较组间差异。分类变量用频数和百分比表示,有序分类变量采用Mann-WhitneyU检验,无序分类变量采用Fisher精确检验比较组间差异。采用Spearman相关分析评估EAR情况与术前中后资料之间的相关性。
先使用R的glmnet软件包进行最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)回归实现数据降维和变量选择。对LASSO回归筛选出的变量进一步行多因素二分类logistic回归分析,并采用似然比检验、赤池信息量准则(Akaike′s information criterion,AIC)及向后逐步选择法筛选出可以预测EAR的独立危险因素。基于筛选出的独立危险因素,使用R的rms软件包建立预测EAR风险的列线图预测模型。模型预测能力是通过其区分和校准能力来评估的;其区分能力通过计算Harrell一致性指数(Harrell′s concordance index)和自举验证(1 000个自举重采样)校正的一致性指数来量化评估,一致性指数> 0.70认为区分能力中等,> 0.80认为区分能力较高[26];其校准能力通过绘制具有1 000个自举重采样的校准曲线以及Hosmer-Lemeshow拟合优度检验(P> 0.05认为模型拟合优度较高)来评估。建立列线图预测模型后,每个患者均可计算出总分,与实际复发情况相比较,应用受试者工作特征(receiver operating characteristic,ROC)曲线分析,根据约登指数(Youden index,YI)最大值可以确定EAR风险分层的阈值。
2 结果
2.1 临床资料53例CD手术患者中,排除无术前3个月内MRE资料5例,合并其他肠道病变2例(肠结核1例,组织胞浆菌病1例),既往肠管切除病史7例,图像质量不佳3例,术后肠镜复查超过12个月6例;其余30例患者纳入本研究[男18例,女12例;年龄(28.07 ± 9.34)岁]。这30例患者中,复发组18例(60%) (内镜复发,n= 17;手术复发,n= 1),无复发组12例(40%)。两组患者的临床资料差异均无统计学意义(P> 0.05)。见表1。是否发生EAR与临床、实验室检查、病理等资料均无相关性(P> 0.05),见图1A。
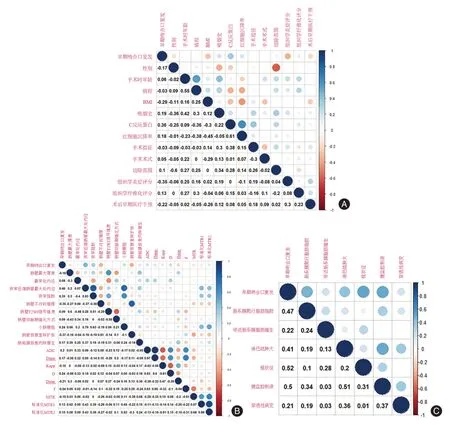
图1 早期吻合口复发与临床病理特征(A)、病变肠段MRE征象(B)、肠周肠系膜MRE征象(C)的相关性Fig.1 Correlations between the early anastomotic recurrence with clinicopathologic characteristics(A),preoperative MRE findings of the resected intestines(B),preoperative MRE findings of the perienteric mesentery(C) in the study

表1 无早期吻合口复发组与复发组CD患者的术前病变肠段周围肠系膜传统MRE参数差异Tab.1 Differences in preoperative MRE findings of the perienteric mesentery between the non-EAR and EAR groups 例(%)
2.2 术前MRE结果在无复发组与复发组之间的差异EAR与病变肠段术前MRE参数的单因素分析如图1B所示。仅狭窄近端肠管最大处内径有统计学意义(P= 0.014),其他影像学参数无统计学意义。复发组狭窄近端肠管最大处内径明显高于无复发组,复发组与狭窄近端肠管最大处内径也有显著相关(r= 0.456,P= 0.011)。
EAR与病变肠段周围肠系膜MRE参数的单因素分析结果如图1C所示。以下3个MRE参数的组间差异有统计学意义:MCFI(P= 0.012)、梳状征(P= 0.008)、腹盆腔积液(P= 0.013)(表1)。复发组与MCFI(r= 0.469,P= 0.009)、梳状征(r= 0.522,P= 0.003)、腹盆腔积液(r= 0.505,P= 0.004)也有显著相关。
2.3 EAR预测模型的构建和性能评估LASSO回归分析从38个临床特征和MRE参数中筛选出3个非零系数的潜在风险预测因子(图2):MCFI、梳状征和腹盆腔积液。对这3个参数进一步行多因素二分类logistic回归分析,筛选出2个可预测EAR的独立危险因素:梳状征(回归系数β = 3.366;优势比 = 28.963;95%CI:1.867 ~ 449.252,P= 0.016),MCFI(回归系数β = 1.124;优势比 = 3.078;95%CI:1.074 ~ 8.822;P= 0.036)。
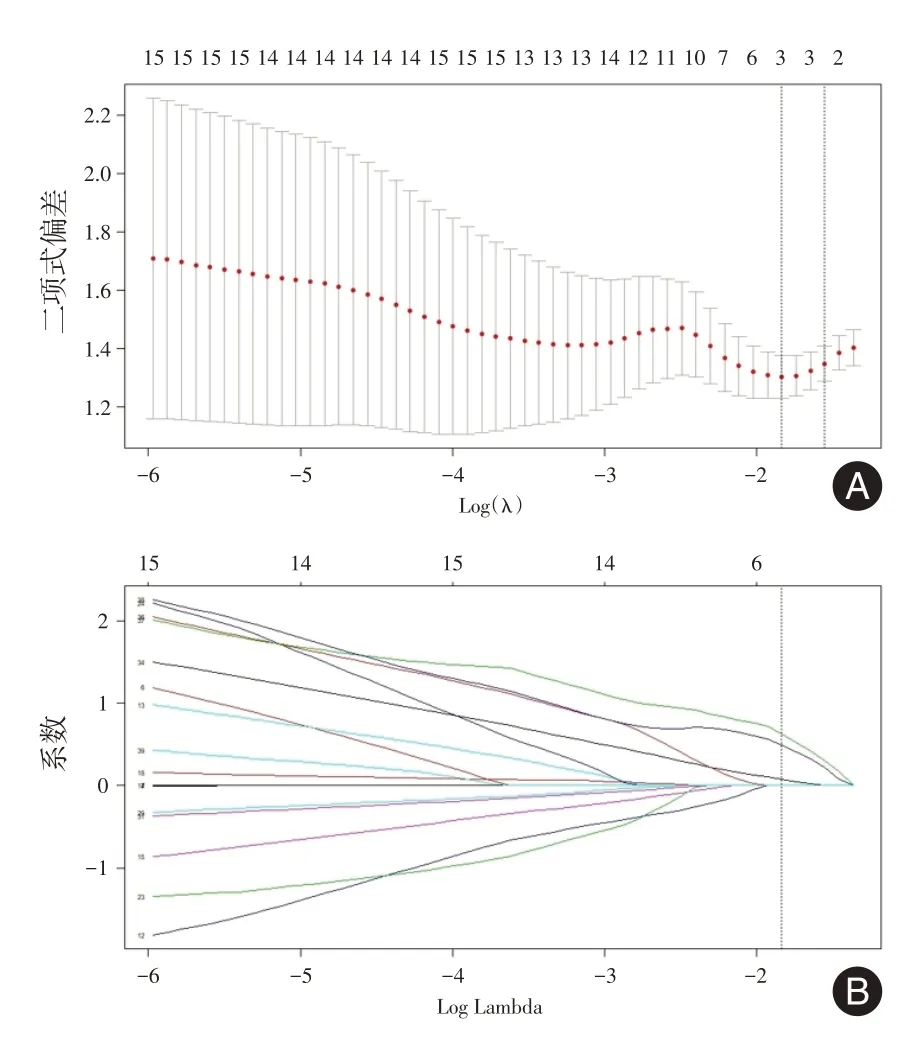
图2 基于LASSO回归模型的变量选择Fig.2 Feature selection using the LASSO binary logistic regression model
纳入上述筛选出的独立危险因素构建预测EAR风险的列线图预测模型。模型的Harrell一致性指数和经偏差校正的一致性指数分别为0.882(95%CI:0.764 ~ 1)和0.860,表明模型区分是否发生EAR的能力较高。校准曲线显示通过模型估算的EAR预测概率与实际概率之间有较好的一致性。Hosmer-Lemeshow拟合优度检验表明拟合良好(P= 0.640)。
该基于术前MRE的列线图预测模型预测CD手术患者为EAR低风险还是高风险的阈值约为64分,将患者分为EAR低风险组和高风险组(图3),灵敏度为66.67%,特异度为91.67%,阳性预测值为92.31%,阴性预测值为64.71%。

图3 基于术前MRE的列线图预测CD患者为早期吻合口复发高风险Fig.3 Identify of high-risk CD patient for EAR based on preoperative MRE nomogram
3 讨 论
本研究开发并验证了术前预测EAR的列线图预测模型,从38个临床特征、实验室指标、组织学分析和MRE参数中,筛选出了2个能预测首次行肠切除术CD患者术后EAR的独立危险因素:MCFI和梳状征。基于这2个术前MRE参数的列线图预测性能良好,Harrell一致性指数为0.882,模型总分≥ 64分的CD患者在首次肠切除术后的EAR风险高,建议术后早期药物干预。
肠切除术后12个月内,超过50%的CD患者出现内镜复发,只有约25%的患者在复发早期出现临床症状[5]。术后早期的药物干预有利于预防CD的复发和进展,但考虑到药物副作用和经济因素,并不建议所有患者在术后早期接受药物预防。因此,在术前对术后EAR发生风险进行评估,可为CD患者提供个体化治疗策略。
MRE已成为CD患者术前评估的常规成像方式[19],在评价深部小肠及肠周改变方面优于内镜。本研究开发的列线图模型包含了两个常见的术前MRE参数,预测的EAR结果与实际观测之间具有较强的一致性。为临床医生设计完整的术前个体化治疗策略、术后早期医疗预防提供参考;以降低CD患者EAR发生率、减少不可逆肠道损伤和再次肠道手术的风险。根据本研究的结果,列线图评分≥64的CD患者往往是EAR的高危人群。建议预测EAR高风险的患者接受早期药物预防,如硫唑嘌呤或抗TNF-α药物治疗;而低风险组的患者可不接受药物辅助,或仅接受抗生素或美沙拉嗪治疗,根据术后6 ~ 12个月内镜复查的结果调整治疗策略[6]。
值得注意的是,相比于病变肠段的MRE参数,病变肠段周围的肠系膜异常改变在术前预测EAR方面可能发挥了更重要的作用。在本研究中,病变肠段的术前MRE参数与是否发生EAR无相关性,而病变肠段周围肠系膜的MRE参数(梳状征、MCFI)却被选为可预测EAR的独立危险因素并纳入模型中。梳状征是CD的一种特征性影像表现,常提示存在活动性疾病,需要更积极地治疗[27-28]。我们的结果显示与其他研究[23,29]一致,术前MRE显示病变肠管周围存在梳状征的患者,术后吻合口复发的风险较高。MCFI是一种新近报道的非侵入性表征CD爬行脂肪的半定量影像学指标,它描述了肠周肠系膜小血管包裹肠道的程度,间接提示了爬行脂肪包裹病变肠管的程度。爬行脂肪是CD的特有表现,并与疾病进展相关[17,30]。HOLT等[31]报道内脏脂肪过多是CD术后内镜复发的独立危险因素。同样,本研究结果显示随着术前MRE中手术切除肠段的MCFI评分增高,患者在术后发生EAR的风险增加[31]。
相对于术前肠壁改变,肠系膜异常改变在预测EAR中起着更重要的作用。可能是因为本研究中的患者均行传统的CD肠切除术,即在切除病变肠管时,与肠缘平齐分离并保留病变肠管周围的肠系膜,这也是目前多数医院所采用的手术方式,以减少出血等手术并发症。因此,残存的肠周肠系膜组织的慢性炎性病变仍可能对吻合口产生影响,从而导致吻合口复发。COFFEY等[17]的研究间接证实了这一假设:在切除CD病变肠管的同时切除病变周围肠系膜可降低术后手术复发率。另一个影像学预测CD患者EAR的研究结果[32]也支持了我们的结论。在该研究中,肠系膜CT影像组学的预测价值稍高于肠道CT影像组学(风险比:2.19vs.2.17),提示肠系膜在EAR中可能扮演更重要的角色。此外,虽然该研究采用影像组学联合临床影像等多维度信息构建模型预测EAR可指导CD术后个性化治疗策略[32]。但影像组学分析需要专业的代码或软件操作,限制了其临床推广性。而本研究基于常规MRE影像即可评估EAR风险,具有更好的临床实用性。
本研究尚有一定局限性。(1)本研究的纳入和排除标准要求严格,而只有30例患者符合分析条件,且未进行外部验证。预测模型的效能值得在后续研究中进行外部验证。(2)本研究对CD患者肠切除术后早期用药类型进行了分析,组间无明显差异;但是没有分析具体的方案和药物治疗过程,这可能会影响CD患者吻合口预后情况。
综上所述,本研究基于术前MRE的列线图预测模型可用于CD首次肠切除术后EAR高风险患者的筛选,为其术后早期个体化药物辅助治疗方案的制定提供参考。
