L-酪氨酸连续发酵工艺研究
2024-03-25王锐麒刘韪玮赵春光徐庆阳
王锐麒 刘韪玮 赵春光 徐庆阳

摘要:當前工业上用微生物发酵法生产L-酪氨酸的工艺中,基本都是前期向发酵罐内加入基础培养基,中后期再流加各类营养物质,虽然整个发酵过程中减少了取料和放料的操作,保证发酵中物料不被浪费,但是,随着流加物质的不断增加,发酵液体系不断扩大,该过程在发酵后期需要不断地人为调控发酵参数,而人为调控中,难以避免调控参数波动,并最终影响发酵结果。因此,实验采用高效连续发酵,该工艺可以大大提高菌体活力,并且有效延长产酸高峰期,为了优化L-酪氨酸的高密度连续发酵生产工艺,通过对大肠杆菌TYR-05发酵培养,考察了L-酪氨酸发酵过程并且分析了菌体量、产酸量、产酸效率、糖酸转化率的情况,确定L-酪氨酸高密度连续发酵过程中接种量、糖速率、糖耗量、底糖浓度等关键条件,以达到高密度连续发酵工艺控制条件优化。实验结果表明在5 L发酵罐中,选择30%的种子接种量,发酵起始时,底物氯化胆碱浓度为1 g/L并每4 h向罐内流加0.2 g/L的氯化胆碱,发酵至12 h时,底糖耗尽,开始以12 g/(L·h)的补糖速率向罐内提供葡萄糖,并在此时开始放液,放液速率为0.13 L/h,使得装液量恒定在20%左右,发酵25 h时开始流加复合营养液,发酵35 h时最高菌体OD600达到65,产酸量为55.8 g/L,糖酸转化率为25.4%,为L-酪氨酸连续发酵工业化生产提供了重要参考。
关键词:L-酪氨酸;连续发酵工艺;大肠杆菌;糖酸转化率;补糖速率
中图分类号:TS201.1文献标志码:A 文章编号:1000-9973(2024)01-0107-06
Study on Continuous Fermentation Technology of L-Tyrosine
WANG Rui-qiLIU Wei-weiZHAO Chun-guangXU Qing-yang1,3,4*
Abstract: In the current industrial process of producing L-tyrosine by microbial fermentation method, the basic culture medium is generally added into the fermentation tank in the early stage, and then various nutrients are fed in the middle and later stages. Although in the entire fermentation process, the operations of taking and releasing materials are reduced, ensuring that materials are not wasted during the fermentation, with the continuous increase of fed-in materials, the fermentation liquid system continues to expand. The fermentation parameters need to be continuously regulated and controlled artificially in the later stage of fermentation.However, it is difficult to avoid the fluctuation of the regulation parameters in the artificial regulation and control, and eventually affecting the fermentation results. Therefore, efficient continuous fermentation is adopted in this experiment, which can greatly improve the cell vitality and effectively prolong the peak period of acid production. In order to optimize the high-density continuous fermentation production process of L-tyrosine, the fermentation process of L-tyrosine is investigated through the fermentation culture of E. coli TYR-05, and the biomass, acid productionamount, acid production efficiency and sugar-acid conversion rate are analyzed. Key conditions such as inoculation amount, sugar rate, sugar consumption amount and base sugar concentration are determined during the high-density continuous fermentation process of L-tyrosine, in order to achieve the optimization of the control conditions for the high-density continuous fermentation process. The experimental results show that in a 5 L fermentation tank, 30% seed inoculation amount is selected. At the beginning of fermentation, the substrate choline chloride concentration is 1 g/L, and 0.2 g/L choline chloride is fed into the tank every 4 h. After 12 h of fermentation, the base sugar is depleted, and glucose is supplied into the tank at a sugar supplement rate of 12 g/(L·h). At this time, the liquid is released at a rate of 0.13 L/h to make the liquid volume constant at about 20%. After 25 h of fermentation, compound nutrient liquid is fed in. After 35 h of fermentation, the highest cell OD600 reaches 65, the acid production amount is 55.8 g/L, and the sugar-acid conversion rate is 25.4%, which has provided important references for the industrial production of L-tyrosine continuous fermentation.
Key words: L-tyrosine; continuous fermentation process; Escherichia coli; sugar-acid conversion rate; sugar supplement rate
L-酪氨酸是一种芳香族氨基酸,在人体中起着重要作用[1],其在食品、饲料、医药和化工行业中有着广泛的应用。酪氨酸在调节情绪、刺激神经系统的同时,还可以加速新陈代谢、缓解疲劳[2]。因此,人体需要其产生许多关键的物质,以便于帮助调节食欲和人体对压力的反应。酪氨酸也是重要的食品添加劑之一,已在乳类、肉类、饲料等食品方面得到广泛的应用[3]。
L-酪氨酸的生产方法目前有4种,分别是蛋白质水解物提取法、化学合成法、酶法和微生物发酵法[4]。蛋白质水解物提取法是比较传统的生产方法,该方法在工业中存在原料成本高、工艺复杂、周期漫长、收取率低等问题,并且对环境污染较大[5]。化学合成法生产酪氨酸主要得到的是DL-酪氨酸,从DL-酪氨酸到L-酪氨酸需要进一步拆分,工艺繁琐、能耗大,不适用于工业化生产。酶法生产酪氨酸虽然方法简单、反应温和、收取率高,但是其生产中酶的活性不易控制,会受到前体物质的抑制[6]。而微生物发酵法生产酪氨酸是目前主要的生产方法,该方法原材料廉价,在合适的发酵条件下,菌株经过发酵可直接获得L-酪氨酸,且发酵成本低,原料易获得,反应所需能耗小,对环境没有很大的污染[7]。
微生物发酵法生产L-酪氨酸根据生产菌种、原料、装置特征、技术可行性等方面可以选择不同的发酵方式[8],常见的发酵方式有好氧/厌氧发酵、液体/固体发酵、分批发酵、补料发酵、连续发酵。本文根据L-酪氨酸的特性,选择菌种的高效连续发酵,该方法菌种活力好、产酸效率高。
大肠杆菌因为生长速率快、易于培养且生产L-酪氨酸有优势,成为发酵法生产L-酪氨酸的主要微生物,是目前工业生产中理想的菌株之一[9]。虽然众多科研人员开展了微生物发酵法生产L-酪氨酸的研究,但发酵技术仍然不成熟。针对发酵过程中生物量低、生产速率低、糖酸转化率低等问题,本文通过对大肠杆菌连续发酵生产L-酪氨酸各参数条件进行实验分析,达到提高L-酪氨酸的产量和糖酸转化率的目的,以期为L-酪氨酸的工业化生产提供理论基础。
1 材料与方法
1.1 菌种
L-酪氨酸生产菌:大肠杆菌TYR-05(PT7-aroGfbr+PT7-tyrAfbrtyrB+PxylF-T7RNAP+ApheLA),天津科技大学代谢工程研究室保藏。
1.2 培养基
1.2.1 种子培养基
葡萄糖25 g/L;酵母粉4 g/L;柠檬酸盐2 g/L;(NH4)2SO4·7H2O 2.5 g/L;KH2PO4·3H2O 3 g/L;MgSO4·7H2O 2 g/L;FeSO4·7H2O 5 mg/L;MnSO4·7H2O 1 mg/L;VH 0.5 mg/L;VB混0.5 mg/L;微量元素混合液1 mL/L。
1.2.2 发酵培养基
葡萄糖20 g/L;酵母粉4 g/L;(NH4)2SO4 3 g/L;KH2PO4·3H2O 3 g/L,柠檬酸盐1.8 g/L;蛋氨酸1 g/L;苯丙氨酸0.8 g/L;FeSO4·7H2O 30 mg/L;MnSO4·H2O 10 mg/L;VH 1 mg/L;VB混0.5 mg/L;微量元素混合液1.5 mL/L。
1.3 主要仪器
Biotech-100KBS发酵罐 上海保兴生物设备工程有限公司;SBA-40ES生物传感仪 济南延和生物科技有限公司;BT-4电子天平 深圳博途电子科技有限公司;75UV分光光度计 上海菁华科技仪器有限公司;Olympus生物显微镜 日本Olympus株式会社;LDZH-100KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;Agilent 1200高效液相色谱仪 安捷伦科技有限公司;氨基酸专用C18色谱柱(250 mm×4.6 mm,5 μm,No.20200031) 大连依利特分析仪器有限公司。
1.4 培养方法
1.4.1 菌种活化
从-80 ℃冰箱中取出菌株,在超净台中于酒精灯火焰旁用接种环取3环于试管斜面上,于32 ℃培养箱中培养12~14 h。
1.4.2 一级种子培养
待菌种活化好后,在超净台中于酒精灯火焰旁用接种环取3环于茄形瓶斜面培养基上,于32 ℃培养箱中过夜培养。
1.4.3 二级种子培养
待一级种子活化好后,用灭过菌的洗菌水在超净台清洗菌体,将洗好的菌液在发酵罐补料口于火焰旁倒入发酵罐中,控制罐内发酵温度为36 ℃,在pH 7.0环境下培养。
1.4.4 发酵培养
当菌体量OD600达到要求时,按相应要求的接种量放液,同时加入发酵培养基于发酵罐中,加入底糖,流加调控氨水来调节pH,使pH维持在7.0~7.2,调节搅拌轴控制罐内溶氧,调节通风控制罐压,使罐压维持在0.0 发酵温度36 ℃,发酵周期35 h。
1.5 实验方法
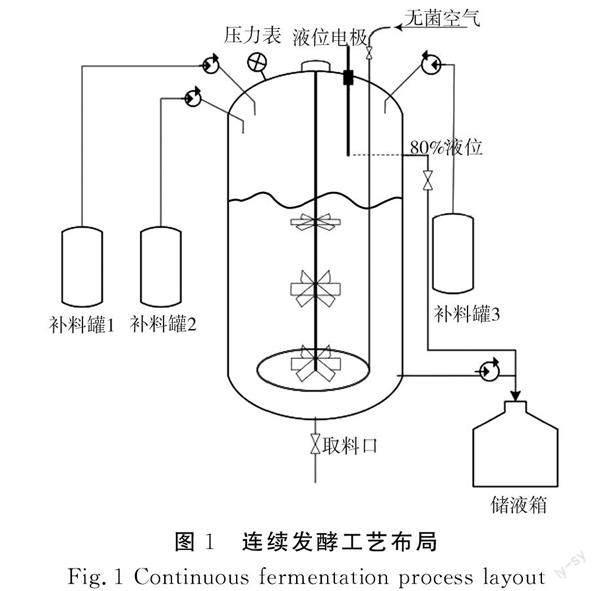
在发酵培养基中加入底糖,接种完后将发酵液体系定容到发酵罐体积的20%左右开始发酵,当罐内残糖耗尽或其含量为0.1 g/L时对其进行流加补糖,控制流加速率,维持罐内残糖浓度,使其浓度≤0.1 g/L,同时控制泵出速率与补糖速率的动态平衡,使得泵出体积与补料体积一样,以保持罐内体积稳定。连续发酵工艺布局图见图1。
1.5.1 L-酪氨酸高效连续发酵接种量的确定
为了确定连续发酵最适生物接种量,对不同接种量下菌体量OD600的生长情况和产酸量的关系进行测定。分别采用接种量15%、20%、25%、30%进行发酵,分析不同接种比例对菌体OD和L-酪氨酸产量的影响,并确定最适接种量。
1.5.2 L-酪氨酸高效连续发酵底糖浓度和补糖浓度的确定
为了确定连续发酵最适发酵底糖浓度和补糖浓度,在最适接种量的条件下发酵,每4 h记录每升发酵液所消耗糖量,经计算得出最适底糖浓度,依据平均耗糖速率计算得出补糖浓度。
1.5.3 L-酪氨酸高效连续发酵底物氯化胆碱浓度和添加时间的确定
为了确定高效连续发酵底物中氯化胆碱的最适添加量,分别向底物中添加0,0.5,1.0,1.5,2.0,2.5 g/L的氯化胆碱,于三角瓶中进行摇瓶发酵,并分析不同浓度对产量和转化率的影响。为了确定流加氯化胆碱的添加浓度和添加时间,选择在0, 8,12,16,20 h分别流加0,0.1,0.2,0.3,0. 0.5 g/L的氯化胆碱,确定最佳的流加工艺。
1.5.4 L-酪氨酸高效连续发酵流加补料的确定
为了确定连续高效发酵流加补料的效果,在初步确定好连续发酵L-酪氨酸的各个成分浓度后,在发酵菌体衰退期加入复合营养液,分析流加营养液后菌体OD、耗糖量、产量的变化,确定流加复合营养液对连续高效发酵的时间。
1.6 发酵检测方法
1.6.1 发酵过程中pH的测定
发酵罐内的pH用罐自带的pH电极测定,精密pH试纸辅助测定。
1.6.2 发酵过程中残糖的测定
罐中取样,用离心机离心留上清液,将上清液稀释100倍,用SBA-40ES生物传感仪测定残糖含量。
1.6.3 发酵过程中菌体量的测定
每2 h从发酵罐中取样,吸取原样稀释相应倍数,用75UV分光光度计测定菌体量,菌体量可用吸光度OD600表示,其计算方式为菌体量=OD600×稀释倍数。
1.6.4 发酵过程中L-酪氨酸的测定
发酵开始,每2 h取样,用离心机离心留上清液,取上清液稀释100,200,300等相应倍数,再用SBA-40ES生物传感分析仪测定酪氨酸产量。
2 结果与讨论
2.1 L-酪氨酸高效连续发酵接种量的确定
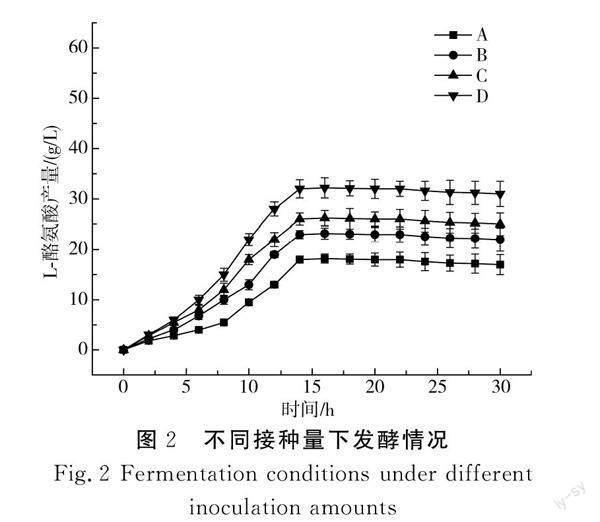
由于不同接种量会影响菌体生长情况,进而很大程度影响L-酪氨酸的产量,且接种量与发酵前期生长速度和开始产酸高峰期的时间息息相关[10],因此,本实验为了确定最适接种量,设计不同接种量进行发酵,并测定在不同接种量下菌体量OD600和产酸的情况。实验组分别为A(15%)、B(20%)、C(25%)、D(30%)。
由图2可知,在接种量为30%时,菌体生长快,产酸速率高,最大OD600为35,较其他实验组分别提高了18.1%、33.2%、41.3%,最大产酸量为42.4 g/L,较其他实验组分别提高了13.8%、19.6%、32.2%。在发酵25 h后,所有实验组菌体量都有所下降,产酸速率也变得缓慢,在最适接种量的前提下,发酵后期对其他方式进行优化,以达到增强菌体活力、提高产物生成速率的目的[11]。因此,本实验为了在发酵前期获得较高的菌体量和菌体活力,选择接种量为30%的实验组进行连续发酵工艺的研究。
2.2 L-酪氨酸高效连续发酵底糖浓度和补糖浓度的确定
在确定好合适的接种量的条件下,选择合适的底糖浓度和补糖浓度以及补糖时间,对发酵产物产量和产酸速率有着重要影响[12]。底糖浓度决定着发酵在哪个阶段才能开始补糖,由于本实验要求在补料的同时放出相同体积的发酵液以维持罐内发酵体系的稳定,并且使罐内残糖维持在一定的浓度水平,因此,需选择一个最适补糖速率,才能使得罐内残糖处于稳定水平。在接种量30%的水平上研究发现,当发酵进行到12 h时,L-酪氨酸合成速率开始缓慢下降,因此选择在12 h进行补料并且开始放液。
由图3可知,每2 h测定每升发酵液的耗糖量,经计算得知,发酵12 h时总消耗糖量为24 g/L,因此罐内底糖浓度为24 g/L。在发酵8~12 h的时间段,发酵平均耗糖速率为12 g/(L·h),因此,想要维持L-酪氨酸的高产酸率,必须向罐内提供的底糖浓度为24 g/L,补糖速率至少维持在12 g/L。在5 L发酵罐中,由于罐内发酵体系体积为罐的30%,即1.5 L的发酵液,若要使发酵体系维持在恒定的水平,防止发酵液体系变大对产量的影响,经计算,需保持0.13 L/h的发酵液放液速率。
2.3 L-酪氨酸高效连续发酵底物氯化胆碱浓度和添加时间的确定
在L-酪氨酸的发酵过程中,生长因子作为必不可少的营养物质,其在微生物体内的主要作用为促进细胞生长、增强酶活及产物代谢等。而在L-酪氨酸连续发酵实验中,最关键的生长因子之一为氯化胆碱,氯化胆碱可以促进细胞膜的合成。蛋氨酸、叶酸等可以在细胞内提供不稳定的甲基,促进菌体生长代谢,氯化胆碱也可以提供不稳定的甲基。微生物利用维生素B12和叶酸作为辅酶,通过丝氨酸和蛋氨酸合成胆碱,故在底物中流加氯化胆碱可以提供活性甲基,促进菌体生长,从而提高L-酪氨酸的产量和糖酸转化率。
为了明确底物氯化胆碱的最适添加量,分别向底物中添加0,0.5,1.0,1.5,2.0,2.5 g/L的氯化胆碱,于三角瓶中进行摇瓶发酵,期间用氨水调节pH至7.0~7.2,发酵35 h,结果见图4。
由图4可知,当底物中氯化胆碱添加量不同时,其对L-酪氨酸产量的促进作用差别较大。当底物中氯化胆碱浓度为0~2.5 g/L时,L-酪氨酸的产量随着底物添加量的增加而提高。当底物浓度为2.0 g/L时,L-酪氨酸的产量最高,达到15 g/L。當底物浓度超过1.0 g/L时,糖酸转化率达到峰值,随着氯化胆碱浓度的增加,L-酪氨酸的产量不再增加,但糖酸转化率降低,可能是摇瓶内溶氧不够导致的,从而影响了L-酪氨酸的产量。因而,从节省成本、综合产酸和转化率等方面考虑,发酵底物中氯化胆碱最适添加浓度为1.0 g/L。
由于在底物培养基中不同添加量的氯化胆碱对L-酪氨酸产量的促进作用有着明显的差异,因此考察了不同发酵时间流加氯化胆碱对L-酪氨酸发酵的影响。在摇瓶发酵实验中,通过10%氨水调节pH至7.0~7.2,发酵35 h时结束。根据经验,选择发酵前期和中期进行流加,故本实验选择在0, 8,12,16,20 h分别流加0,0.1,0.2,0.3,0. 0.5 g/L的氯化胆碱,发酵过程中L-酪氨酸产量和糖酸转化率结果见图5。
由图5可知,在不同的发酵时间段,底物中流加氯化胆碱的量不同,对L-酪氨酸产量的促进作用有一定差异。在发酵过程中流加0.2 g/L的氯化胆碱,L-酪氨酸产量和糖酸转化率达到最大值,随着流加氯化胆碱浓度的增加,摇瓶内溶氧不足,产量保持不变。因而,选择在发酵过程中0, 8,12,16,20 h分别流加0.2 g/L氯化胆碱,效果最好。
2.4 L-酪氨酸高效连续发酵流加补料的确定
前期实验中,初步得出高效连续发酵工艺发酵所需基本条件:发酵底糖浓度24 g/L,发酵12 h后开始补加糖,其补加速率至少维持在12 g/(L·h),底物氯化胆碱添加量为1 g/L,发酵过程中0, 8,12,16,20 h分别流加0.2 g/L氯化胆碱,发酵放液速率为0.13 L/h左右。根据上述参数进行控制实验,结果见图6。在12 h后开始补糖,菌体的活力依旧很高,菌体OD值小幅度增长,罐内体积维持在稳定水平,但发酵25 h后,菌体活力开始下降,产酸和糖耗量开始降低,发酵28 h时,测得罐内L-酪氨酸的浓度为48.1 g/L,说明菌体活力明显下降。
由图6可知,通过连续发酵,可使L-酪氨酸产酸高峰期从16 h延长至25 h,如果在发酵25 h后添加培养基相似成分的复合营养液,可有效延长菌体的活力以及产酸高峰期[13-14]。
由圖7可知,在补加复合营养液发酵25 h后,菌体量、产酸速率依旧维持在较高水平,直到发酵35 h后,菌体OD值和产酸量开始缓慢下降,发酵35 h时测得L-酪氨酸产量降至52.4 g/L,由此停止发酵。可见在高效连续发酵工艺中,发酵后期补与加培养基相似的复合营养液,有利于缓解菌体衰退,维持菌体生长代谢的活力[15-16]。
2.5 高效连续发酵生产工艺中L-酪氨酸产量及糖酸转化率
本实验中,核算各个数据,见表1。发酵35 h时,连续发酵的L-酪氨酸产量约为55.8 g/L,累计耗糖量为990 g,糖酸转化率约为25.5%,相对于普通发酵的糖酸转化率提高了28.1%。单批次发酵L-酪氨酸的产量达到247.5 g,相较于普通发酵产量126.4 g,总产量提高了49.1%;整个发酵工艺中,L-酪氨酸的平均产酸量为7.1 g/h,相较于普通发酵的3.6 g/h,产酸量提高了约49.2%。由此可知,该工艺中,菌体活力好、生长旺盛、耗糖快、产酸多,因而导致糖酸转化率高于一般发酵法[17-18]。因此,高效连续发酵工艺可以有效地提高L-酪氨酸的产量和糖酸转化率[19]。
3 结论
L-酪氨酸是重要的食品添加剂,具有治疗抑郁症、舒缓压力等功能,因此受到广泛的关注和应用,微生物连续发酵法生产L-酪氨酸具有广阔的研究前景。
在L-酪氨酸高效连续发酵工艺研究中,其产酸量和糖酸转化率是发酵控制的基本指标,本研究通过单因素实验确定最适接种量为30%,底糖浓度为12 g/L,补糖速率为12 g/(L·h),放料速率为0.13 L/h,底物氯化胆碱添加量为1 g/L,并在发酵过程中0, 8,12,16,20 h分别流加0.2 g/L氯化胆碱。实验表明,在高接种量的前提下,该发酵方法使得菌体能快速进入产酸期,由于在补加糖和营养物的同时以相同放料速率放出发酵液,使得罐内体系维持平衡,且菌体活力很好,使得产酸周期延长至35 h,较普通发酵提高了30.3%,单批次发酵L-酪氨酸产量为247.5 g,较普通发酵提高了49.1%,糖酸转率提高了49.2%,可见连续发酵能够有效提高L-酪氨酸发酵的产量及糖酸转化率,具有很大的工业生产研究潜力。
参考文献:
[1]李国华.L-酪氨酸的发酵过程控制和提取工艺研究[D].天津:天津科技大学,2021.
[2]李国华,熊海波,陈宁,等.木糖对L-酪氨酸发酵的影响[J].中国调味品,2020,45(8):6-9,15.
[3]高晗.多酶偶联生物合成丙酮酸和L-酪氨酸研究[D].南京:南京大学,2014.
[4]肖国安,王先兵,焦庆才,等.L-酪氨酸酶法转化制备方法:中国,CN103224972A[P].2013-07-31.
[5]冯莹莹,刘均忠,张宏娟,等.双酶偶联生物合成L-酪氨酸[J].精细化工,201 31(5):570-57 606.
[6]尚新达.L-酪氨酸微生物转化及代谢产物分析鉴定[D].郑州:郑州大学,2014.
[7]常俊俊,刘均忠,刘茜,等.重组酪氨酸酚裂解酶全细胞催化合成L-酪氨酸[J].精细化工,2013,30(10):1112-1116,1137.
[9]姚元锋,赵广荣.L-酪氨酸代谢工程研究进展[J].食品与发酵工业,2013,39(5):132-137.
[9]陈亚红,田丰收,周盼.酶催化分光光度法测定L-酪氨酸[J].中国酿造,2012,31(2):180-182.
[10]鲁伟,刘世桃,周守智,等.L-酪氨酸纯化工艺的优化[J].氨基酸和生物资源,2010,32(3):80-82.
[11]李秀华,王自瑛,王后方.L-酪氨酸的合成研究[J].科技信息(科学教研),2007(33):343,397.
[12]LTKE-EVERSLOH T, STEPHANOPOULOS G. L-tyrosine production by deregulated strains of Escherichia coli[J].Applied Microbiology and Biotechnology,2007,75(1):103-110.
[13]LTKE-EVERSLOH T, SANTOS C N S, STEPHANOPOULOS G. Perspectives of biotechnological production of L-tyrosine and its applications[J].Applied Microbiology and Biotechnology,2007,77(4):751-762.
[14]KIM B. Metabolic engineering of Escherichia coli for the enhanced production of L-tyrosine[J].Biotechnology and Bioengineering,2018,115(10):2554-2564.
[15]涂佳,艾文胜,刘翔博,等.麻竹笋干提取L-酪氨酸实验[J].湖南林业科技,2013,40(5):48-50.
[16]徐勉懿,潘祖亭,王润涛,等.β-环糊精与L-丙氨酸、L-酪氨酸包络物的荧光光谱研究[J].云南大学学报(自然科学版),1993(S1):56-57.
[17]STUDIER F W. T7 expression systems for inducible production of proteins from cloned genes in E. coli[J].Current Protocols in Molecular Biology,2018,124(1):63.
[18]REIDER A A. Evolved hexose transporter enhances xylose uptake and glucose/xylose co-utilization in Saccharomyces cerevisiae[J].Scientific Reports,2016,6(1):19512.
[19]VARMA A, PALSSON B O. Stoichiometric flux balance models quantitatively predict growth and metabolic by-product secretion in wild-type Escherichia coli W3110[J].Applied and Environmental Microbiology,199 60(10):3724-3731.
收稿日期:2023-08-16
基金項目:宁夏回族自治区重点研发计划(2021BDE92007);山东省重点研发计划(2021ZDSYS10)
作者简介:王锐麒(1998-),男,硕士研究生,研究方向:代谢工程及发酵过程控制。
*通信作者:徐庆阳(1980-),男,副研究员,博士,研究方向:代谢工程及发酵过程控制。
