舌苔形成的调控机制及研究新思路
2024-03-14张军峰詹瑧
张军峰,詹瑧
(南京中医药大学医学院,江苏 南京 210023)
人类很久以前就关注到口腔症状是全身系统性疾病的先兆[1],舌是口腔最大的器官,也是人体唯一外露的内脏器官,中医舌诊即源于舌苔观察[2]。舌象是观察人体的窗口,现代胚胎学研究认为舌和胃肠同属消化道器官,舌背和胃肠的黏膜上皮组织都由内胚层发育而来,故舌象能够反映胃肠功能变化[3]。中医认为,舌苔乃胃蒸脾湿上潮而生,病理性舌苔形成的物质基础是“脾湿”“湿热”“食物腐化之浊气”。舌苔是舌背黏膜表面的一层苔状物,其颜色和性质变化是中医舌诊的重要内容。作为客观存在的物质,舌苔包括舌背黏膜上皮细胞、微生物、白细胞和食物残渣等。近年来,大量证据显示,舌苔菌群可为临床病-证结合诊断、中医药疗效评价、重大消化系统肿瘤(肝癌、胰腺癌、胃癌、肠癌等)诊断提供无创性的潜在生物标志[4]。因此,在中医舌诊理论指导下,舌苔可为重大疾病诊断提供新的生物标志,揭示舌苔形成的细胞与分子生物学机制,可为临床应用与推广中医舌诊提供科学证据。
近年来,随着蛋白组、代谢组、微生物组、转录组、单细胞转录组等多组学技术的广泛应用,舌苔形成的生物学机制取得了极大进展,为揭示舌苔科学原理提供了新的思路和方法。因此,本文综述了舌苔形成的细胞与分子生物学研究进展,探讨新技术在舌苔形成的生物学机制研究中的潜在价值,推动中医舌诊的现代科学内涵研究。
1 舌苔形成的细胞生物学基础
舌苔由舌背黏膜组织分化发育形成,舌背黏膜上皮细胞的增殖、分化、凋亡和脱落的平衡调节是舌苔形成的细胞生物学基础,凋亡相关基因的差异表达是调控舌苔形成的关键分子机制[5]。舌背黏膜组织是特殊复层鳞状上皮及纤维结缔组织构成,表面粗糙,表面分布大量舌乳头(丝状乳头、蕈状乳头、过渡型乳头、轮廓乳头和叶状乳头),乳头之间上皮未角化,以适应舌的伸展运动[6]。其中,丝状乳头最多,被覆复层鳞状上皮,适应口腔中的温度、机械剪切、感染等复杂微环境,丝状乳头的角化树、外形、排列、增生或萎缩,决定苔质、苔色变化[2]。因此,口腔微环境是决定舌苔形成与变化的关键条件。
舌背黏膜组织是口腔的重要黏膜屏障,保护舌体免受外界复杂环境的伤害、感染、脱水和热损失等。数量最多的丝状乳头遍布舌背,丝状乳头是典型复层鳞状上皮,主要由角质形成细胞构成,角质形成细胞在分化、角化过程中,由最初的基底层细胞逐渐演变为最外的角质层,形成了独特的复层结构,其产生角蛋白、黏多糖等对维持黏膜的正常渗透和物质交换具有重要作用。在上皮组织中,上皮细胞在精密调控的角化过程中形成角质层,去核并扁平化、垂直堆积,细胞膜被角质化包膜替代。角质层结构类似于砖块和灰浆,角质细胞为砖块,细胞间脂质层为灰浆,保护角质层下的黏膜组织,免受外界环境的有害刺激和水分蒸发[7]。因此,舌苔形成是适应食物搅拌、语音等功能的表现,舌苔变化与舌功能密切相关。
舌的血液供应极为丰富,细胞代谢十分旺盛,对微环境反应灵敏,故口腔卫生(吸烟、牙齿和生活习惯等)是影响舌苔形成的最重要因素[8]。体内的激素、免疫分子、神经递质、代谢产物、毒素等也通过唾液分泌影响口腔生理病理状态,进而影响舌苔形成。近年来,研究发现舌苔类型与舌苔代谢物、菌群等相关,舌苔标志代谢物[3-酮基乳糖、2-脱氧-D-核糖、UDP-D-半乳糖、变视紫红(质)、抗坏血酸盐、吡啶甲酸、组氨酸]与慢性胃炎患者腻苔形成相关,提示能量代谢特别是糖代谢是腻苔形成的关键机制[9];还有研究发现舌苔菌属(Alloprevotella,Solobacterium,Rothia,Eikenella,Aggregatibacter)与舌苔代谢物(脂质和类脂分子、有机氮化合物、有机氧化合物、苯丙烷类和聚酮类化合物、有机杂环化合物)显著相关,可以作为胃癌前病变的潜在诊断标志物[10];本项目组发现胃癌患者4种常见舌苔(薄白苔、白厚苔、黄薄苔、黄厚苔)具有特征性的舌苔菌群[11],并对应独特的肠道菌群[12]。这些研究表明舌苔物质成分具有潜在临床诊断价值[13],但舌苔形成的影响因素及其作用机制依然缺乏深入研究。
在舌苔形成过程中,舌背黏膜上皮干细胞具有体外重建组织的能力,上皮干细胞培养系统为探索舌背黏膜上皮的分化调控机制提供了体外平台。有学者采用活体成像技术跟踪原代人表皮角质形成细胞克隆培养的数千次分裂,观察到两种扩散模式:①平衡模式,通过产生相似比例的增殖和分化细胞,实现表皮稳态的“群体不对称”;②扩张模式,产生过多的循环增殖细胞,产生大量扩张的克隆,一旦达到局部汇合,处于扩张模式的细胞将其行为转换为平衡模式,划痕试验导致汇合区受损时,划痕附近的细胞切换回扩张模式,直到缺陷闭合[14]。因此,建立合适的体外口腔黏膜上皮细胞培养体系,为探索环境因素调控舌苔形成的细胞生物学机制提供思路。
2 免疫-神经-内分泌对舌苔形成的系统调节
上皮细胞可分泌多种应激信号分子,角质形成细胞和成纤维细胞表达多种激素受体、神经递质(如肾上腺素、多巴胺、乙酰胆碱等)受体、神经营养素和神经肽(如P物质、神经生长因子)受体、细胞因子受体等[15],提示舌背黏膜组织受到免疫-神经-内分泌的复杂调控作用(图1),阐明舌苔形成的免疫-神经-内分泌调节机制,能够为理解“舌是人体脏腑气血津液功能状态的晴雨表”的临床价值提供科学依据。
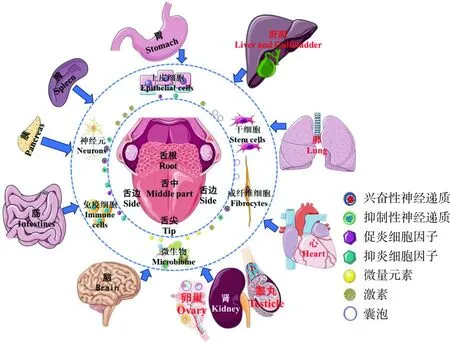
图1 舌苔反映脏腑气血津液功能状态Fig.1 Tongue coating reflects the functional status of viscera, qi, blood, and body fluids
2.1 免疫调节
口腔免疫屏障主要包括黏膜屏障和唾液。早期研究发现病理性舌苔患者唾液SIgA、IgG水平显著升高,唾液溶菌酶水平显著降低[16];厚苔肿瘤患者唾液表皮生长因子(Epidermal growth factor,EGF)水平显著高于薄苔患者[17];胃癌患者血清EGF显著升高,而薄苔患者血清EGF显著下降[18];黄苔胃癌患者血清IL-17α显著高于白苔患者[19]。这些临床证据提示,病理性舌苔形成与口腔免疫、系统免疫状态密切相关,为察舌苔“司外揣内”辨识脏腑气血功能状态提供了科学依据。
通过体外建立舌背黏膜上皮细胞培养系统,发现大鼠舌背黏膜上皮细胞的凋亡与细胞周期分布与人类相似[20],EGF、TGF-α能够影响舌背黏膜上皮细胞周期分布和凋亡,EGFR信号通路可能是舌苔形成的关键调控机制[21]。然而,舌背黏膜天然携带丰富的微生物,原代舌背上皮细胞培养的污染风险和贴壁生长难以传代,限制了更深入的分子机制研究。研究发现舌鳞癌细胞Tca-8113与舌背鳞状上皮细胞同源,生物学性状也比较接近,血清饥饿可以模拟舌背黏膜上皮细胞增殖环境,发现血清饥饿下调Bcl-2/Bax诱导舌鳞癌细胞Tca-8113凋亡[22],氧化应激活化相关蛋白(Caspase-7, HSP-27, Annexin A1)高表达、过氧化物酶体-6和HSP-70低表达是血清饥饿诱导Tca-8113凋亡的关键特征[23]。体外实验显示,炎症因子(IL-1β、IL-6、TNF-α、IFN-γ)能诱导Tca-8113细胞PD-L1的表达[24];蛋白质芯片研究显示,与人正常口腔黏膜上皮细胞相比,人舌鳞癌细胞株(UM-1、CAL-27、Tca-8113)高表达6种炎性细胞因子,如干扰素诱导蛋白-10、IL-1β等[25]。作为黏膜组织的主要细胞,角质上皮细胞(KC)表达多种模式识别受体,譬如,Toll样受体(TLR1、2、3、4、5、6、9、10)识别相应的病原相关分子模式后,经MyD88信号通路活化后分泌多种细胞因子(IL-1、4、5、33,TNF-α等),诱导自身及其他固有免疫细胞参与免疫应答和损伤修复[26]。单细胞转录组研究发现,小鼠舌背黏膜上皮细胞动态表达多种病毒感染相关分子,如新冠病毒感染相关的血管紧张素酶2(ACE2)和跨膜蛋白酶丝氨酸2(TMPRSS2),流感病毒感染相关的唾液酸转移酶(St3gal4和St6gal1)[27]。这些结果提示,舌背黏膜上皮细胞参与感染免疫,舌苔形成可能是舌背黏膜与病原生物相互作用的结果。
众所周知,舌苔和消化道黏膜都存在大量微生物及其代谢产物,对微生物的免疫耐受是维持皮肤黏膜稳定的关键机制。吲哚胺2,3-双加氧酶(IDO)是肝脏外唯一能催化色氨酸沿犬尿酸途径分解代谢的关键酶,研究发现IFN-γ可以上调皮肤KC的IDO基因表达,抑制T细胞功能,诱导免疫耐受[28]。IDO诱导免疫耐受的机制有3种:①色氨酸耗竭途径。IDO高表达耗竭局部色氨酸,导致色氨酸转运RNA(tRNA)处于游离状态,而一般性调控阻遏蛋白激酶2(GCN2)因含有一个感应游离tRNA的变构调节位点而被激活,活化的GCN2激酶使下游真核细胞翻译起始因子2α(eIF2α)磷酸化,抑制eIF2α的促转录功能,抑制周期素D3和周期素依赖蛋白激酶4的合成,导致T细胞周期阻滞,抑制浸润性T细胞活化[29]。色氨酸的耗竭抑制氨基酸感应激酶1,进而抑制mTOR表达,诱导T细胞无能和自噬[30]。②代谢产物途径。由IDO有道德色氨酸代谢产物中,犬尿氨酸、喹啉酸等能显著抑制T细胞和NK细胞的增殖[31]。③调节性T细胞(Treg)途径。犬尿氨酸作为芳香烃受体的内源性配体,可以诱导未成熟CD4+T细胞分化为Foxp3+Treg细胞[32]。研究发现KC丢失单核细胞趋化蛋白-1诱导蛋白1(MCPIP1)后,活化IL-23/Th17和Stat3信号通路,诱导强烈的皮肤炎症反应[33]。前期发现革兰阴性菌的内毒素(LPS)在体外可以诱导血清饥饿的舌鳞癌细胞Tca-8113凋亡,与抑制COX-2相关信号通路相关[34]。因此,感染免疫是探索舌苔形成相关细胞-微生物互作机制的重要切入点。
2.2 内分泌调节
类似于舌背黏膜上皮,阴道上皮同样是鳞状上皮细胞,生长与成熟受卵巢激素的影响,阴道上皮的脱落与性激素水平的周期性变化密切相关。譬如,围绝经期综合征患者舌苔脱落细胞成熟价值(MV)显著低于健康对照组,舌苔脱落细胞MV与血清雌二醇、卵泡刺激素水平显著负相关,而与血清黄体生成激素水平显著正相关,特别是舌苔与生殖道脱落细胞MV显著正相关[35];舌鳞癌Tca-8113细胞表达雌激素受体,雌二醇可剂量依赖性促进Tca-8113细胞增殖[36]。中医认为,“肾主生殖”“舌根映肾”,雌激素能够调控舌苔变化,舌苔变化反映体内雌激素状态,提示舌根的黏膜分化状态最可能反映体内激素分泌状态。
下丘脑-垂体-卵巢轴(HPA轴)是调控激素分泌的重要器官,也是中医肾功能的现代体现。肾为先天之本,HPA轴广泛地参与内分泌、生殖、消化、免疫等功能。研究发现,体外培养的角质形成细胞,能够表达促肾上腺皮质激素释放因子和分泌促肾上腺皮质素释放激素[37]。而且,生长激素参与上皮、真皮的伤口愈合[38]。另外,皮肤创伤愈合过程中,雌激素受体-β信号通路活化,上调锌指转录因子Slug促进角质细胞迁移[39]。结果提示,上皮角质细胞与HPA轴具有类似的平衡功能,可以快速响应多种应激(紫外线、化学物质、微生物等)刺激,通过调控激素分泌维持舌背黏膜上皮组织的稳态。
研究发现,围绝经期综合征中医肝郁病理分级与舌苔脱落细胞凋亡指数呈显著正相关[40]。动物实验发现肝郁模型雌、雄大鼠均存在HPA轴的亢进,雌性还存在外周单胺类递质的代谢亢进,血清甲状腺素T3、T4显著升高[41]。甲状腺激素(THs)是维持细胞代谢平衡的关键调节因子,皮肤上皮细胞表达TH灭活酶-癌胚蛋白3型脱碘酶(D3),表皮特异性D3敲除显著延长表皮伤口愈合时间[42];体外实验证实,高浓度甲状旁腺激素显著抑制角质形成细胞增殖,可能通过Hedgehog信号通路诱导细胞周期G1期阻滞[43]。可以推测,肝郁气滞证发生时,甲状腺激素水平升高,活化Hedgehog信号通路,促进上皮细胞增殖,导致舌苔变厚。
2.3 神经调节
皮肤黏膜是人体最大的可塑性组织,发挥屏障作用,抵御环境刺激和伤害。皮肤损伤修复过程中,伤口愈合是替换失活细胞和组织结构的关键过程。在伤口愈合过程中,上皮组织内的神经细胞分泌神经肽作用临近的上皮细胞、血管内皮细胞、结缔组织细胞等,促进角质形成细胞、免疫细胞和神经细胞的增殖[44]。譬如,内源性阿片类物质β-新内啡肽(β-NEP)激活人角质形成细胞中的丝裂原活化蛋白激酶(MAPK)/Erk1/2信号通路,加速伤口愈合;β-NEP促进角质形成细胞迁移,而不影响细胞增殖[45]。这些结果为研究神经系统疾病相关舌苔形成机制提供了新思路。
3 生物毒素调节舌苔形成
口腔是消化道的入口,聚集着大量微生物,唾液溶菌酶裂解细菌释放多种毒素,特别是革兰阴性菌释放的脂多糖(LPS)是口腔最常见生物毒素。研究发现,牙龈卟啉单胞菌脂多糖(Pg-LPS)与大肠杆菌脂多糖(E-LPS)刺激人角化细胞、牙龈成纤维细胞和单核-巨噬样细胞后,牙龈成纤维细胞和单核-巨噬样细胞分泌IL-6、IL-8等炎性因子,但角化细胞不分泌IL-6、IL-8[46];另外的研究显示,LPS能够促进角质形成细胞干扰素-γ(IFN-γ)和白细胞介素-1β(IL-1β)表达,依赖于缺氧诱导因子-1α(HIF-1α)[47]。结果提示,口腔上皮细胞对不同细菌来源的LPS响应机制不同,这可能是舌苔类型对应独特的菌群结构的关键机制。另外,Pg-LPS可以刺激牙龈角质形成细胞表现出自噬的诱导作用,促进细胞凋亡相关LPS结合蛋白和TLRs的表达,角质形成细胞的自噬依赖于AMPK信号通路,与胞内活性氧(ROS)增加、TLR4信号激活有关[48];还有研究发现LPS可抑制角质形成细胞的维生素D受体(VDR)表达,依赖TNF-α/miR-346途径,维生素D可以拮抗LPS诱导的角质形成细胞凋亡[49]。因此,生物毒素可能是诱导舌背黏膜细胞凋亡的关键因素,与固有免疫、氧化应激、自噬相关,详细机制有待深入研究。
4 物理因素调节舌苔形成
口腔是厌氧性环境,舌感知味觉、调节声音、协助咀嚼,因此,缺氧、机械拉伸、摩擦、温度等是舌苔形成的物理环境。机械拉伸是皮肤感受的最常见物理信号,舌运动使得舌背黏膜受到长期机械拉伸的刺激,然而,舌苔形成的生物力学及响应机制尚不清楚。目前,皮肤响应机械负荷的分子机制有两种模型:可逆弹性模型、不可逆生长皮肤的连续生长模型,为探索舌苔响应机械拉伸的病理生理学机制提供借鉴[50]。研究发现,角质形成细胞受到连续机械拉伸24 h后,角质形成细胞增殖和皮肤屏障相关基因表达显著增加;将扩张器植入BALB/c小鼠背部建立皮肤扩张模型,小鼠表皮过度增生、皮肤屏障功能受损[51];利用组织扩张程序对小型猪背部皮肤进行机械刺激,基底层角质形成细胞增殖,基底层伸长、细胞密度增加,细胞过度增殖伴随细胞网嵴数量增加;β1整合素是机械刺激关键响应蛋白,能够动态地重新定位以调节基底细胞抵抗外力[52]。结果提示,舌苔增厚与脱落可能是舌背黏膜响应机械拉伸刺激的结果。
从生物进化角度看,机械拉伸控制上皮组织生长,如哺乳动物皮肤表面积与身体大小精确协调。皮肤角质形成细胞黏附蛋白整合素和细胞骨架肌动蛋白的作用力可诱导YAP/TAZ核移位,促进细胞增殖;单层柱状上皮具有分化良好的顶端膜结构域,而复层鳞状上皮缺乏顶端结构域,主要依靠基底整合素黏附[53],这可能是厚苔钙黏蛋白表达水平显著高于薄苔[54]的原因。机械负荷和沉默E-钙黏蛋白基因均能诱导角质形成细胞脱分化,促进细胞增殖,抑制细胞凋亡[55]。角质形成细胞是舌苔丝状乳头的主要细胞,人永生化角质形成细胞HaCaT细胞与聚二甲基硅氧烷薄膜上的皮肤成纤维细胞共培养,静态拉伸模拟皮肤表面张力处理6 d后,β1整合素识别其Ⅰ型胶原配体,参与HaCaT细胞迁移;外缘细胞的黏着斑蛋白(Vinculin)表达低于内缘细胞,而细胞分裂周期蛋白42(Cdc42)表达高于内缘细胞,提示角质形成细胞的迁移能力与黏着斑复合物的形成呈负相关[56]。将角质形成细胞在柔性硅胶支架上贴壁培养,持续机械拉伸+20%,15~30 min即可诱导Akt磷酸化和活化,促进细胞增殖、抵抗细胞凋亡[57]。然而,长期机械拉伸导致上皮细胞生长停滞,表皮干细胞H3K27me3及其组蛋白甲基转移酶EZH2的水平显著升高[58]。这些结果提示,表观遗传调控是上皮细胞响应机械拉伸诱导的皮肤细胞再生、增殖的关键机制,细胞黏附蛋白是响应机械拉伸的关键分子。
温度是口腔的另一物理因素,研究发现,温度梯度变化导致角质形成细胞HaCaT细胞骨架排列不均匀,细胞体积增大、形状变圆、硬度增加,细胞周期G2/M期积累、增殖率降低、脂肪生成延迟,提示温度变化是调控角质形成细胞增殖的重要因素[59]。人群调查显示,低湿度和低温导致皮肤屏障功能普遍降低,增加对机械应力的敏感性,外源刺激更易诱导角质形成细胞释放促炎细胞因子和皮质醇[60]。人类不仅有视觉、听觉、嗅觉、味觉、触觉,还有温觉(热觉和冷觉)、痛觉等,2021年诺贝尔生理学或医学奖授予感知觉研究领域,以表彰David Julius和Ardem Patapoutian在感知温度与触觉受体的发现工作,David Julius对温度觉受体TRPV1的鉴定及分子转导机制的研究,打开了人们理解温度感觉的微观世界大门[61]。因此,研究感知觉受体特别是温度敏感受体在舌背黏膜上皮的表达模式与舌苔类型的相关性,可能为探索“白苔主寒证,黄苔主热证”的科学内涵提供新思路。
5 其他因素调节舌苔形成
在舌苔形成过程中,多种细胞间必然存在复杂的通讯机制,调控舌背黏膜的损伤修复和舌苔形成演变。细胞间的通讯机制包括自分泌、旁分泌和内分泌,主要的物质基础包括细胞因子、神经递质、激素等。近年来的研究认为,由细胞特异性分泌的外泌体(Exosome)是一种新的细胞间通讯介质。外泌体是一类直径在40~100 nm的盘状囊泡,包含复杂 RNA和蛋白质。除了细胞产生外泌体,血液、唾液、尿液、脑脊液和乳汁等天然体液中也存在外泌体。多能干细胞来源的间充质干细胞(iMSC)的外泌体显著促进角质形成细胞HaCaT增殖,促进胶原蛋白的分泌和纤连蛋白表达,与活化ERK1/2信号通路相关[62]。MSC广泛存在于各种组织器官,系统性疾病发生时,MSC来源的外泌体可能调控舌背黏膜组织的分化发育,参与舌苔的形成。角质形成细胞的外泌体被中性粒细胞内吞后,诱导中性粒细胞分泌IL-6、IL-8和TNF-α,提示外泌体是角质形成细胞-免疫细胞通讯的重要形式[63];研究发现,角质形成细胞和成纤维细胞的外泌体中有168种差异表达的微小RNA,主要富集在丝裂原活化蛋白激酶信号通路、Ras信号通路、cAMP信号通路和Wnt信号通路;在共培养系统中,角质形成细胞的外泌体可以被黑色素细胞吸收,促进黑色素细胞的增殖、酪氨酸酶活性和黑色素合成[64],这可能是舌苔变黑的生物学机制。在舌苔形成过程中,舌背黏膜下的间充质细胞、免疫细胞等可能通过外泌体调控角质形成细胞的生物学行为,参与舌苔的苔质变化,换言之,外泌体是研究舌苔形成相关细胞间通讯机制的新切入点。
吸烟可导致舌苔发黄,在察舌苔中需要仔细甄别。在牙周健康的成年人中,吸烟者和非吸烟者的唾液和舌苔菌群显著不同,舌苔可能是吸烟者口腔疾病相关病原体的重要集散地[65]。烟草主要成分尼古丁的受体广泛表达上皮细胞、角质形成细胞、成纤维细胞和血管内皮细胞,尼古丁可以促进局部充血相关的血管收缩,通过直接或间接作用神经系统和免疫细胞抑制炎症,延缓伤口愈合,加速皮肤老化[66],这可能是临床吸烟者多见老舌的原因。
早期研究发现,病理性舌苔锌、铜、铁的含量显著降低,锰含量显著升高;而且,病理性黄苔锌、铜、铁的含量显著高于白苔[67]。锌是人体必需的微量元素,体外实验发现,氯化锌(ZnCl2)促进角质形成细胞HaCaT增殖,并促进Notch1、IL-8和环氧合酶-2的mRNA表达;锌可以诱导角质形成细胞超氧化物生成,抵抗紫外线(UVB)暴露诱导的细胞死亡[68]。角质形成细胞HaCaT受到UVB照射后,细胞内铜、锌超氧化物歧化酶和锰超氧化物歧化酶表达增加,抵抗UVB诱导的活性氧介导的角质形成细胞损伤[69]。可以推测,病理性舌苔锌、铜、铁的含量降低,可能与细胞氧化应激损伤消耗了较多的锌、铜、铁相关,特别是随着铁死亡、铜死亡、细胞焦亡、自噬等细胞死亡机制的研究进展,为深入研究微量元素调节舌苔形成的细胞生物学机制提供了新思路。
6 总结与展望
传统中医观察人体源于“象”,舌象是古今医家辨证最倚重的象,舌诊是开启中医学习、实践大门的钥匙。根据生物全息律理论,舌是观察人体的一个全息元,舌象能够反映脏腑、气血津液的功能状态,是中医药辨证论治的重要依据[3]。伸舌可见舌苔,简便易行,舌苔已成为舌象的最重要内容,过去几十年,国内外学者运用细胞生物学、分子生物学、微生物组学、蛋白组学、代谢组学、转录组学等技术开展舌苔形成与疾病诊断、证候规范化等相关性研究,极大地增进了人们对中医察舌苔辅助疾病诊断的科学理解。
随着多学科交叉的快速发展,计算机图像、荧光光谱成像、三维定量成像等可视化技术联合舌苔生物指标、临床参数建立人工智能深度学习模型,必然提高舌诊的准确性和规范化,提升舌诊的临床应用价值。譬如,最新报道利用舌苔菌群、肿瘤标志物、舌像、临床参数建立了人工智能深度学习模型,在研究队列和验证队列中证实舌图像可以作为稳定的胃癌诊断方法,显著优于传统的血液生物标志,基于舌图像的人工智能深度学习模型可显著区分胃癌和非胃癌人群,甚至可以识别早期胃癌和癌前病变(如萎缩性胃炎)[70]。越来越多的高质量证据显示,以舌苔为代表的舌象对临床疾病防治具有重要的参考价值,然而,舌苔形成的生物学机制依然缺乏深入研究。舌苔形成是一个高度复杂的、遗传调控的、有序的细胞生物学过程,涉及分子遗传学、表观遗传学、基因表达和蛋白修饰等多层次信号转导通路。近年来,单细胞测序技术、类器官培养技术的发展和普及,为舌苔研究提供了理想的技术支持,本文据此提出了新的研究思路(图2),拟通过揭示舌背黏膜组织的分化发育机制,为中医舌诊的未来研究提供新的见解。
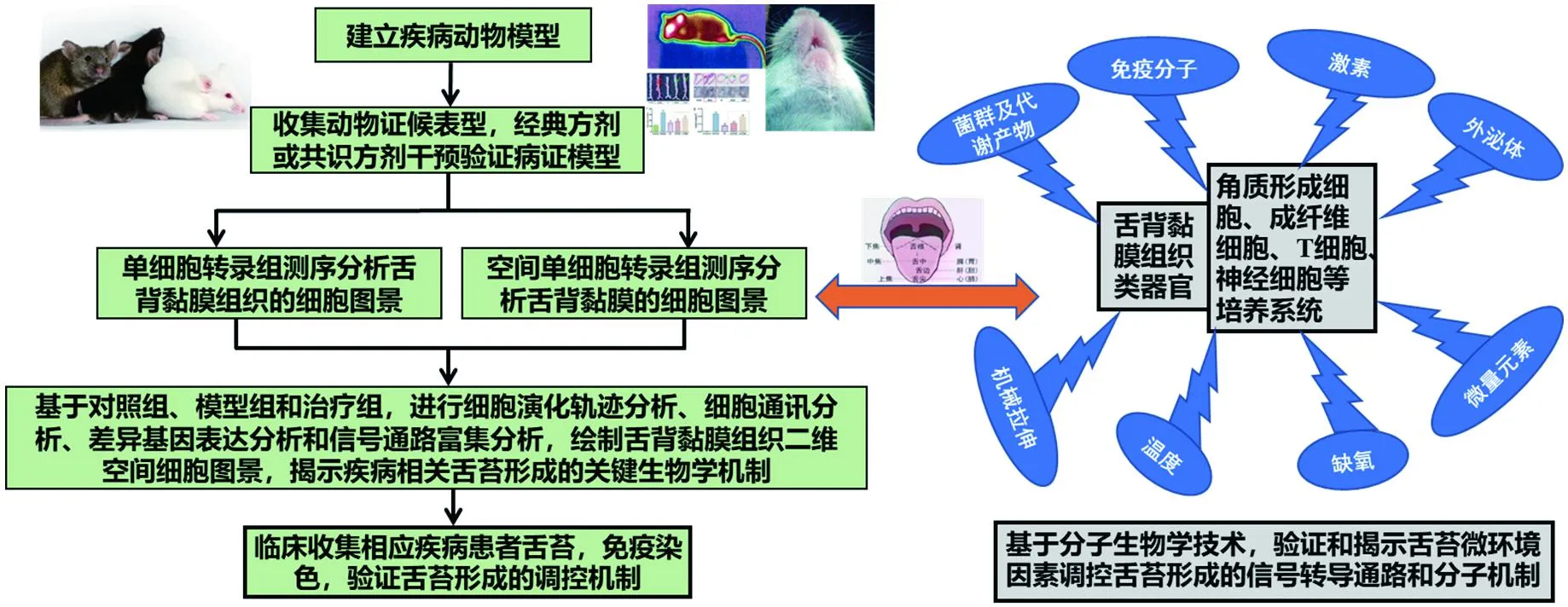
图2 舌苔形成的调控机制研究思路Fig.2 Research ideas on the regulatory mechanism of tongue coating formation
