补肾助孕方对黄体功能不全性不孕症大鼠Treg、Th17及其相关因子的影响
2024-03-14阮芳周惠芳
阮芳,周惠芳
(1.南京中医药大学第一临床医学院,江苏 南京 210023;2.南京中医药大学附属医院,江苏 南京 210029)
黄体功能不全(Luteal phase defect,LPD)指排卵后黄体发育不全或过早退化,引起孕激素分泌不足、子宫内膜分泌反应不良,导致胚胎着床失败和发育障碍,与不孕、早期流产、月经不调等密切相关。LPD占不孕症病因的5%~10%[1],在辅助生殖技术(Assisted reproductive technology,ART)的过程中,LPD的发生率可达100%[2]。研究表明,子宫内膜容受性受损是LPD性不孕症患者的关键特征[3]。免疫反应是子宫容受性的重要介质[4],具有调节上皮-胚胎附着、蜕膜转化、滋养层侵袭、子宫血管适应、炎症激活和消退以及免疫耐受作用。调节性T细胞(Treg)和辅助性T细胞17(Th17)是CD4+T细胞的2个显著不同的亚群,在自身免疫、炎症和对外来抗原的免疫排斥方面具有相反的功能[5-6]。Treg细胞对植入成功至关重要,发挥着建立妊娠所必需的强大抗炎、免疫抑制和血管调节功能[7-8]。FOXP3是叉头样转录因子家族的成员之一,是Treg细胞发育和发挥免疫抑制功能所需的特异转录因子,FOXP3持续表达是Treg谱系稳定的先决条件[9]。FOXP3下降与不孕症相关[10],调节FOXP3可以减少Treg细胞向Th17细胞分化[11]。Th17细胞在TGF-β、IL-6、IL-23等多种细胞因子参与下发生活化,分泌白介素(IL)-17以及由RAR相关孤儿受体C(RORC)编码的“主调节因子”RORγT,参与炎症反应和自身免疫疾病的发生与发展。研究发现,IL-17的异常表达或Th17细胞正常百分比的改变可能是妊娠失败的潜在原因[12]。
中医认为LPD性不孕症发病以肾为本,涉及肝郁、脾虚、气虚、血虚、阴虚和阳虚[13-15],治疗上以补肾为主。队列研究的荟萃分析显示,补肾类中药可在体外受精的基础上,进一步提高妊娠率至60%,较单纯体外受精的妊娠率显著提高[16]。补肾助孕方是由周惠芳教授数十年的临床经验凝练而成,具有补肾宁心,交通心肾之功。课题组前期研究证明补肾助孕方主要通过改善子宫内膜容受性,起到调经助孕的作用[17]。补肾助孕方广泛应用于不孕症、高泌乳素血症、多囊卵巢综合征等妇科疾病[18-20]。因此,本实验通过分析补肾助孕方对Treg/Th17细胞平衡的调控作用,为临床上治疗LPD型不孕症提供新策略和方向。
1 材料
1.1 实验动物
SPF级SD大鼠:雌性60只,8周龄,体质量180~230 g;雄性10只,10周龄,体质量280~320 g。大鼠均购于北京维通利华实验动物技术有限公司,实验许可证号:SCXK(京)2021-0011。统一分笼饲养于南京中医药大学实验动物中心,自由饮食,保持环境清洁,室内温度控制在22~25 ℃,相对湿度40%~70%,自由饮食。本实验通过南京中医药大学实验动物福利与伦理审查(伦理编号:202103A043)。
1.2 药物
地屈孕酮(荷兰Abbott Biologicals B.V,10 mg·片-1,批号:362941)、米非司酮(上海新华联制药有限公司,25 mg·片-1,批号:0019221102)。以上2种药物充分研磨后,分别利用生理盐水配置成浓度为0.2、1 mg·mL-1均一混悬液;补肾助孕方由鹿角片10 g,菟丝子15 g,炒白芍10 g,淮山药15 g,山萸肉10 g,醋柴胡5 g,紫石英10 g和丹参10 g组成,购自江苏省中医院。取总药量8倍量水浸泡药物30 min,先将鹿角片、紫石英煎煮30 min,加入其他6味中药,再煎30 min,过滤回收水煎液;再取6倍量水再煎30 min,滤过;最后取4倍量水煎煮30 min。混合3次水煎液,在62 ℃下通过旋转蒸发仪进行真空蒸发,得到浓缩成含生药2 g·mL-1补肾助孕方溶液,-20 ℃密封保存备用。
1.3 主要试剂
抗大鼠CD4 BB700流式抗体、抗大鼠CD25 BV421流式抗体(BD公司,批号:742157、565608),抗大鼠FOXP3 PE流式抗体、抗大鼠IL-17A APC流式抗体、抗大鼠CD3 FITC流式抗体、兔抗鼠RORγT单克隆抗体、固定/破膜液(Thermo Fisher科技有限公司,批号:12-5773-80、17-7177-81、1-0030-82、PA5-86733、00-5523);FIX&PERM KIT试剂盒(南京福麦斯生物技术有限公司,批号:FMS-FP0050);兔抗鼠FOXP3单克隆抗体(武汉三鹰生物技术有限公司,批号:22228-1-AP);大鼠白介素(IL)-10、IL-17A ELISA试剂盒(上海酶免生物科技有限公司,批号:MM-0195R1、MM-70049R1);BCA蛋白质测定试剂盒(上海翊圣生物科技股份有限公司,批号:2021ES86);RIPA裂解缓冲液、蛋白酶抑制剂混合物(上海碧云天生物技术有限公司,批号:P0013B、P1045);HRP标记的二抗(武汉三鹰生物技术有限公司,批号:SA00001-2);SYBR®Green Universal PCR Master Mix、TRIzol试剂(南京诺唯赞生物科技股份有限公司,批号:Q311-01、RC101-01)。
1.4 主要仪器
多色分析流式细胞仪(美国BD公司,型号:GaliosTMFlow Cytometer);多功能酶标仪(瑞士TECAN公司,型号:M200-Pro);高速冷冻离心机(德国Eppendorf公司,型号:5810R);恒温振荡仪(杭州奥盛仪器有限公司,型号:MB100-4P);旋转蒸发仪(上海Eyela公司,型号:N-1200B);混合球磨仪(德国Retsch公司,型号:MM400);高速冷冻离心机(德国Eppendorf公司,型号:5810R);光学显微镜(日本Olympus公司,型号:BX43F);Power Pac Basic垂直电泳仪、Chemi DOCMP多功能蛋白印迹成像系统(美国Bio-Rad公司,型号:041BR123579、731BR02543)。
1.5 动物分组、造模及给药
开始实验之前,动物的体质量没有显著差异。每天检查大鼠阴道涂片观察发情周期的规律性,呈现出规律的4 d发情活动后,以随机数字法将雌鼠分为6组(n=10):空白组(生理盐水),模型组(米非司酮),阳性对照组(地屈孕酮),补肾助孕低、中、高剂量组。
LPD性不孕症模型大鼠的构建与给药,参考课题组前期方法[21]。每日8:00发现大鼠进入动情期后空白组灌服生理盐水(10 mL·kg-1),其他组灌服米非司酮混悬液(10 mL·kg-1)。于15:00以及次日8:00空白组与模型组灌服等量生理盐水,其余各组灌服相应药物,药物剂量根据人与动物体表面积折算,补肾助孕中剂量组对应临床等效剂量:地屈孕酮组(0.02 g·kg-1),补肾助孕低剂量组(4.5 g·kg-1),补肾助孕中剂量组(9 g·kg-1),补肾助孕高剂量组(18 g·kg-1),此为第1动情周期。连续用药2个周期后,进入第3周期,于8:00确认大鼠进入动情期后,各组均灌服生理盐水,当日15:00各组按剂量给予相应药物(空白组与模型组灌服生理盐水),18:30开始雌、雄大鼠按2∶1的比例合笼,次日7:30检测雌鼠阴道涂片见精子为妊娠D1(PD1);除空白组外,其余各组于PD2 9:00给予米非司酮灌胃;于PD2—PD4 14:00地屈孕酮组及补肾助孕方各组按原剂量给药。PD5处死大鼠,腹主动脉取血分为2部分,一部分肝素钠抗凝管取血立即用于流式细胞检测,另一部分促凝管取血用于分离血清,将样品在4 ℃下以1 000×g离心10 min, -80 ℃保存备用。立即剪取子宫组织,每组随机选取6个样本进行病理检测,余下子宫组织冻存备用。见图1。
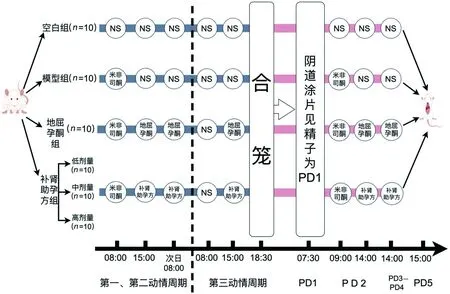
图1 黄体功能不全性不孕症大鼠造模方法Fig.1 The modeling method for infertile rats with luteal phase defect
1.6 观察指标和方法
1.6.1 HE染色观察子宫组织病理状态 取子宫组织,经常规透明、打蜡、包埋后切成厚度为5 μm的切片。每组取3片进行HE染色,脱水后密封。采用Olympus显微镜拍照,选取10~15个视野观察子宫组织形态变化。
1.6.2 大鼠外周血Treg与Th17的细胞数量检测 取2 mL全血于肝素钠抗凝管中,加入红细胞裂解液进行裂解,15 min后重悬细胞。取100 μL细胞液加入2.5 μL CD4抗体和CD25抗体进行表面染色,室温避光孵育20 min,加入1 mL预冷的Staining buffer溶液离心(常温400 r·min-1离心10 min,离心半径6 cm),弃上清,加入固定/破膜工作液,室温避光孵育40 min,充分清洗后加入破膜液,同时加入2.5 μL FOXP3抗体进行核染。
取100 μL细胞液加0.5 μL CD3抗体、2.5 μL CD4抗体,室温避光孵育15 min;加1 mL Staining buffer溶液清洗(常温400 r·min-1离心10 min,离心半径6 cm),弃上清;再加入固定破膜剂100 μL FIX&PERM A工作液,震荡混匀,室温避光孵育15 min;充分清洗后加入100 μL FIX&PERM B工作液和0.1 μL IL-17抗体染色。最后清洗,细胞重悬上机检测,运用FlowJo V10软件分析Treg和Th17细胞占CD4+T细胞的比例。
1.6.3 大鼠子宫组织相关蛋白的表达检测 使用含有蛋白酶抑制剂混合物的RIPA裂解缓冲液从冷冻的子宫组织中提取总蛋白。按照说明书,使用BCA蛋白质测定试剂盒测定蛋白质浓度。将5×十二烷基硫酸钠(SDS)加样缓冲液添加到样品中,然后将其在100 ℃下煮沸15 min备用。将等量蛋白质(36 μg)在10%凝胶上进行SDS-PAGE,然后将蛋白质电泳转移到PVDF膜上。用5%脱脂牛奶室温封闭30 min,按目标蛋白分子量分段剪切PVDF膜,与抗FOXP3(1∶2000),抗RORγT(1∶1 000),4 ℃过夜;洗膜,加入HRP标记的二抗(1∶5 000),室温孵育1 h,洗膜,避光条件下加入显影液进行曝光,以GAPDH为内参进行矫正,用Image J软件计算条带灰度值。
1.6.4 大鼠子宫组织相关基因表达检测 使用TRIzol试剂从冷冻子宫组织中分离总RNA。分光光度法测定RNA浓度,取等量(1 μg)RNA,用反转录试剂盒合成cDNA。用SYBR®Green Universal PCR Master Mix和每个基因的特异性引物共扩增2 μL cDNA。用于检测FOXP3、RORγT和GAPDH mRNA的引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.6.5 大鼠血清IL-10、IL-17A水平测定 取大鼠血清,按照说明书稀释后备用,配置标本稀释液、标准品及洗涤液,依次进行布孔、加样、洗板、孵育一抗、洗板、加入酶标抗体工作液、洗板、加入底物工作液、终止反应,最后用酶标仪检测各孔在450 nm波长处的吸光度(A)值。

2 结果
2.1 各组大鼠子宫组织病理形态结果
HE染色结果如图2所示:模型组子宫内膜厚度较空白组明显变薄(P<0.01),管壁子宫腺体数量减少,腺体小而直。与模型组比较,地屈孕酮组内膜增厚(P<0.05),内膜上皮排列整齐,间质比较致密,腺体增加,腺腔扩张,补肾助孕中、高剂量组中见多量子宫腺体,间质血管丰富,内膜厚度显著增加(P<0.01),腺体与间质发育同步,与空白组相似。综上,补肾助孕方可以增加着床期大鼠子宫内膜厚度,促进腺体分泌。各组大鼠子宫内膜厚度比较见表2。

表2 子宫内膜厚度比较Table 2 Endometrial thickness comparison μm, n=6)

注:红色箭头指示血管;黑色箭头指示腺体。
2.2 各组大鼠外周血Treg、Th17细胞占CD4+T细胞百分比及相关因子表达特征比较
流式细胞术分析Treg和Th17细胞占CD4+T细胞百分比。结果显示,模型组外周血中Treg细胞百分比及IL-10含量较空白组相比下降明显(P<0.01),Th17细胞百分比及IL-17A含量显著高于空白组(P<0.01);与模型组比较,地屈孕酮组,补肾助孕中、高剂量组Treg细胞百分比和IL-10水平升高(P<0.01,P<0.001),同时,补肾助孕中、高剂量组Th17细胞百分比和IL-17A明显降低(P<0.01,P<0.001),说明补肾助孕方可以调节Treg和Th17细胞的平衡,而且这种调节可能呈剂量依赖性。地屈孕酮组IL-17A虽有下降,但无明显统计学意义。见图3~4。
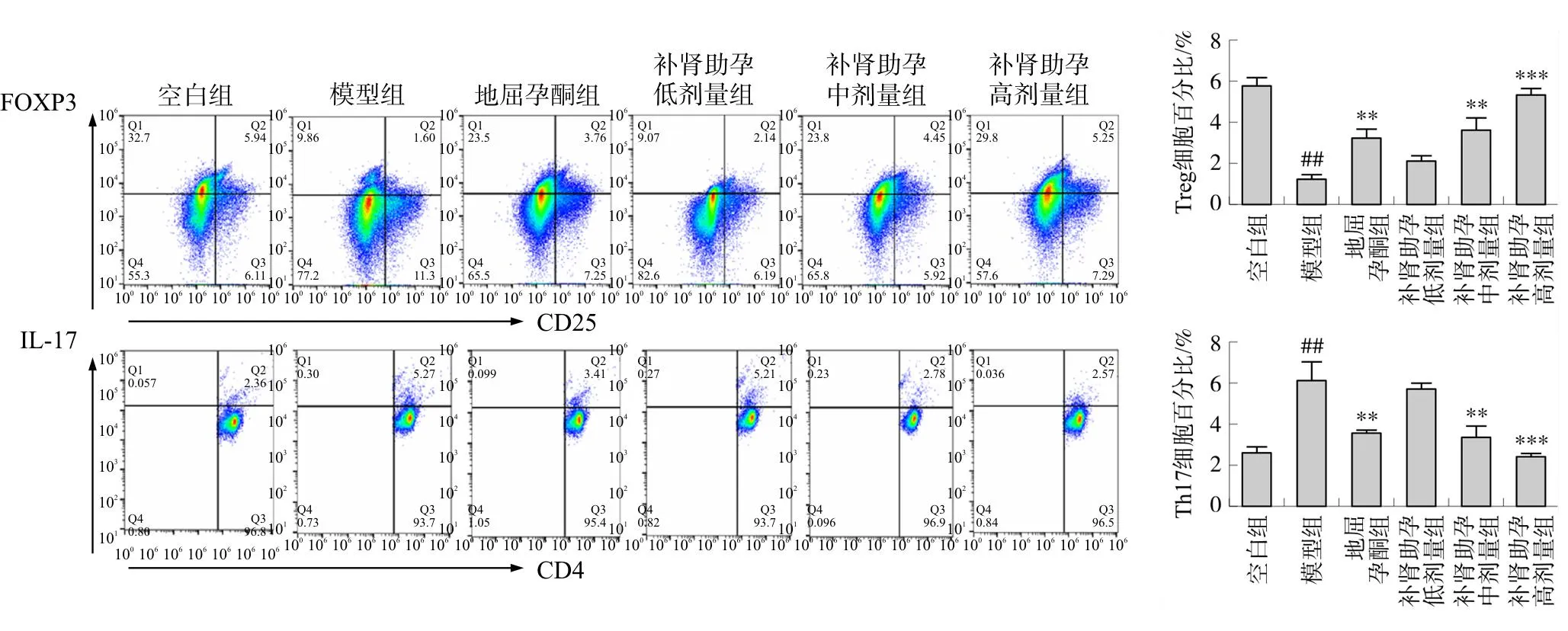
注:与空白组比较,##P<0.01,###P<0.001;与模型组相比,

注:与空白组比较,##P<0.01;与模型组相比,
2.3 各组大鼠FOXP3、RORγT蛋白相对表达量比较
为了进一步验证补肾助孕方对子宫免疫微环境的影响,采用Western blot检测Treg和Th17细胞核转录因子(FOXP3和RORγT)的蛋白表达,结果如图5所示。与空白组相比,模型组FOXP3蛋白表达下降(P<0.001),RORγT蛋白表达上升(P<0.01);与模型组比较,地屈孕酮组和补肾助孕中剂量组FOXP3蛋白表达上升(P<0.01),补肾助孕高剂量组上升程度更加显著(P<0.001),而补肾助孕中、高量组RORγT蛋白表达明显下降(P<0.05),地屈孕酮组RORγT蛋白水平表达虽有下降,但无统计学意义。

注:A.空白组;B.模型组;C.地屈孕酮组;D.补肾助孕低剂量组;E.补肾助孕中剂量组;F.补肾助孕高剂量组;与空白组比较,##P<0.01,###P<0.001;与模型组相比,
2.4 各组大鼠FOXP3、RORγT mRNA相对表达量比较
与Western blot结果比较,FOXP3、RORγT mRNA出现了微小变化。如图6所示,与空白组相比,模型组FOXP3 mRNA表达下降(P<0.05),RORγT mRNA表达明显上升(P<0.001);与模型组比较,补肾助孕高剂量组FOXP3 mRNA表达上调(P<0.01),RORγT mRNA表达显著降低(P<0.001),地屈孕酮组更是显著增加了FOXP3 mRNA表达(P<0.001),降低了RORγT mRNA水平(P<0.001)。虽然补肾助孕中剂量组FOXP3 mRNA表达上升,RORγT mRNA表达下降,但无明显统计学意义。

注:与空白组比较,#P<0.05,###P<0.001;与模型组相比,
3 讨论
中医古籍并未记载LPD性不孕症的病名,根据LPD性不孕的临床症状,将其归为中医学“胎漏”“胎动不安”“不孕”等范畴。临床以国医大师夏桂成教授提出的“心-肾-子宫轴”的中医生殖轴理论为指导,主张LPD性不孕症以补肾助阳为治疗大法,肾主生殖理论贯彻治疗的始末[22]。肾中元气,是生命的原动力、人体的先天之本,对五脏六腑起着至关重要的温煦、濡养、激发等作用。肾阴滋盛,涵养卵子,助长胞宫;肾阳充旺,鼓卵促排,暖煦胞宫。先天之精充养后天之气,滋养肝血,运化脾气,气血充盈,则胞宫得养,经孕如常。补肾助孕方以鹿角片为君,温肾助阳,益血生精;菟丝子、炒白芍、怀山药、山萸肉共为臣药,以补肝肾之精阴,佐以柴胡疏肝解郁、鼓舞阳气,紫石英宁心安神,全方共奏补肾助阳,调经助孕之功。
米非司酮作为孕激素的经典拮抗剂,可破坏子宫内膜容受性并抑制囊胚着床。本实验采用米非司酮成功构建LPD性不孕症模型,造模后大鼠子宫内膜腺体分泌延迟,蜕膜化被破坏,补肾助孕方干预后,大鼠子宫内膜上皮细胞结构发生改变,子宫内膜厚度增加,促进了子宫内膜上皮细胞腺体间质同步发育,这与前期课题组研究结果相一致[21],表明补肾助孕方改善了子宫内膜容受性,为胚胎植入提供了良好的环境。基于这些前提,我们探讨补肾助孕方促进着床作用的潜在机制。
胚胎植入是一个复杂的生理过程,包含囊胚侵入子宫内膜,胚胎的持续生长发育、妊娠的建立与维持等[23],受多种因素影响,子宫内膜蜕膜化的发生发展和维持是胚胎植入、胎盘形成及妊娠维持的必要条件[24]。炎症样过程对蜕膜的组织生长、重塑和分化至关重要。胚胎植入过程中,炎症反应必须被控制并逆转为抗炎状态。在众多免疫细胞中,Th17细胞是辅助性T细胞的重要谱系,通过分泌IL-17参与胚胎植入的炎症反应。在IL-17家族中,IL-17A对妊娠免疫最为重要,IL-17A通过与受体结合来引导多种自身免疫性疾病的发生,IL-17A的变化提示Th17水平的改变及疾病的发生。研究表明,IL-17的过表达不利于胚胎着床及妊娠的维持[25]。Treg细胞具有抑制抗原特异性免疫的作用,主要分泌IL-10和TGF-β并表达CD25、CTLA4和PD-L。Treg细胞可以通过细胞与细胞之间的直接接触抑制Th17过度活化并减少IL-17的分泌。Th17与Treg来源相同,但功能上相互拮抗,在胚胎植入和妊娠期间需要两者维持精细的免疫平衡,尤其是胚胎着床部位[26]。当Treg/Th17细胞失衡向Th17细胞方向偏移时,小鼠和人类就会发生植入失败和流产[27-28]。FOXP3、RORyT分别是Treg、Th17细胞的特异性核转录因子,在这2种免疫细胞的发育和功能中发挥重要作用,检测子宫组织FOXP3和RORγT的表达可以间接反应Treg细胞和Th17细胞的水平。
基于上述理论,我们探讨了补肾助孕方对LPD性不孕模型大鼠Treg/Th17细胞平衡的作用,结果发现LPD性不孕模型大鼠外周血Th17细胞百分比和相关因子的表达明显上升,而Treg细胞百分比及相关因子呈现不同程度的下降趋势,表明LPD性不孕大鼠处于Treg/Th17免疫失衡的炎症状态,补肾助孕方的干预逆转了上述趋势,证明补肾助孕方可以调节LPD性不孕模型大鼠Treg/Th17免疫平衡,有利于Treg偏倚。孕酮可抑制T细胞分化为Th17细胞,同时抑制IL-17及RORγT的表达[29-30]。本研究亦发现,地屈孕酮同样具有调节Treg/Th17细胞平衡的作用。流式细胞和血清ELISA结果均显示地屈孕酮可增加Treg细胞百分比及相关因子表达,降低Th17细胞百分比,但地屈孕酮组IL-17A下降无明显统计学意义,提示补肾助孕方较地屈孕酮而言,对Treg/Th17平衡的靶向性可能更强。综上所述,补肾助孕方可能通过纠正Treg/Th17细胞失衡,调节子宫内膜的免疫状态,改善子宫内膜容受性,促进胚胎植入。
然而,本研究有一定的局限性,没有继续追踪或记录妊娠后大鼠的命运。我们只观察了着床期补肾助孕方对局部免疫的影响,而没有探讨它们对妊娠中晚期外周和局部免疫平衡的影响。此外,补肾助孕方如何改善的深入机制尚不完全清楚,将在未来做进一步研究。
