冷应激反应加重大鼠多囊卵巢综合征生殖功能障碍
2024-03-14高雪康媛滕月
高雪 康媛 滕月
多囊卵巢综合征(polycystic ovary syndrome,PCOS)发病率为4%~10%,主要特征为月经滞后、月经过多和崩漏等[1-2]。PCOS发病机制与信号通路的异常有关。热休克蛋白90(heat shock protein 90,HSP90)在机体受到应激后迅速增加,参与蛋白运输,保护细胞免受刺激[3],同时还参与细胞的凋亡及抗氧化等作用,在抵抗冷应激早期反应时,HSP90是由应激细胞分泌[4],HSP90还是促炎因子,其可通过调控相关信号通路的细胞因子,从而调控炎性反应水平并影响细胞凋亡[5]。炎性反应参与PCOS的全过程[6]。己证实PCOS的主要病理为皮质纤维化及卵巢间质增生等,均是慢性炎性反应体现[7]。当机体受到冷应激刺激时,核转录因子-κB(nuclear factor kappa-B,NF-κB)表达增加,同时胰岛素抵抗水平增加,雄激素水平升高,促进PCOS的产生及发展。但目前关于冷应激对于PCOS大鼠的报道较少,本实验研究冷应激反应对PCOS大鼠生殖功能的影响及其作用机制。
1 材料与方法
1.1 实验动物 50只SPF级SD雌性大鼠体质量200~300 g[上海凯学生物科技有限公司,生产许可证号:SCXK(沪)-2020-0126)],适应饲养1周后实验。本实验已通过我院动物伦理委员会批准,批号:20200120。
1.2 主要实验试剂 苏木素-伊红染色液(上海源叶生物科技公司),FSH、LH、T、SOD、MDA和GSHPx试剂盒(均上海仁捷生物科技公司),TUNEL工作液(杭州浩克生物科技公司),HSP90、NF-κB p65、IkB、TAK-1和RIP一抗(均武汉艾美捷生物科技公司),辣根过氧化物酶二抗(河北翰林生物科技公司)。
1.3 方法
1.3.1 大鼠的分组与处理:于50只大鼠中随机抽取10只作为对照组,剩余40只大鼠根据文献[8]建立PCOS模型。40只大鼠建模成功,随机分为模型组、冷应激组、抑制剂组、联合组,每组10只。冷应激组刺激温度为4℃,刺激时间为 3 h (11∶00~14∶00),干预3周;抑制剂组大鼠于腹腔注射格尔德霉素(50 mg/kg,HSP90抑制剂),持续5 d;联合组大鼠在冷应激组的前提下给予HSP90抑制剂干预。
1.3.2 ELISA检测血清性激素水平及氧化应激水平:取5组大鼠颈动脉血2 mL,1 250 r/min,离心5 min,后取血清。ELISA检测促卵泡激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinising hormone,LH)、睾酮(testosterone,T)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx),严格按照说明书操作。
1.3.3 HE染色观察卵巢组织病理形态:按常规操作,光镜下观察组织形态。
1.3.4 TUNEL染色检测卵巢组织细胞凋亡:按上述方法取组织并脱水后,放于载玻片上,加入蛋白酶K工作液孵育20 min后清洗,加入TUNEL工作液反应1 h后清洗,滴加50 μL convertr-POD,反应0.5 h后清洗,DAB显色液显色,光镜下观察并计数。
1.3.5 免疫印迹检测卵巢组织HSP90、NF-κB p65、核转录因子抑制蛋白(inhibitor of nuclear factor kappa-B,IKB)、转化生长因子β激活激酶1(relationship between transforming growth factor β kinase 1,TAK-1)、受体相互作用蛋白(receptor interacting protein,RIP)蛋白表达:取卵巢组织剪碎后,3 000 r/min,离心5 min,离心半径为12 cm,取上清液,测蛋白浓度。蛋白变性后进行电泳,电泳后的蛋白溶液置于PVDF膜上,脱脂奶粉封闭,2 h后将PVDF取出,加入NF-κB p65、IkB、TAK-1、RIP、HSP90一抗(1∶500)4℃过夜孵育过夜,取出PVDF膜,加辣根过氧化物酶二抗(1∶500),孵育2 h进行清洗、显色、拍照并分析条带吸光度值absorbance,计算各指标相对水平。
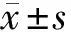
2 结果
2.1 冷应激对PCOS大鼠性激素水平的影响 与对照组比较,模型组FSH降低、LH与T升高(P<0.05),与模型组比较,冷应激组和抑制剂组FSH降低、LHT升高(P<0.05),与抑制剂组比较,冷应激组FSH降低、LH与T升高(P<0.05)。见表1。
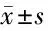
表1 冷应激对PCOS大鼠性激素水平的影响 n=10,
2.2 冷应激对PCOS大鼠氧化应激水平的影响 与对照组比较,模型组SOD和GSH-Px水平降低,MDA水平升高(P<0.05),与模型组比较,冷应激组与抑制剂组SOD和GSH-Px水平升高,MDA水平降低(P<0.05),与抑制剂组比较,冷应激组SOD和GSH-Px水平降低,MDA水平升高(P<0.05)。见表2。
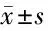
表2 冷应激对PCOS大鼠氧化应激水平的影响 n=10,
2.3 冷应激对PCOS大鼠卵巢形态的影响 对照组大鼠卵巢组织结构正常;模型组与联合组卵巢皮质黄体及卵泡减少,卵泡囊性扩张并有闭锁产生;冷应激组与抑制剂组大鼠的卵巢主要表现为大量的小窦卵泡、囊性卵泡和增大的卵泡膜细胞层,且以冷应激组更为严重。见图1。

图1 冷应激对PCOS大鼠卵巢病理形态(HE×100)
2.4 冷应激对PCOS大鼠卵巢组织细胞凋亡的影响 对照组、模型组、抑制剂组、冷应激组与联合组的细胞凋亡率分别为(5.62±0.58)%、(41.38±3.92)%、(52.67±4.22)%、(63.48±5.71)%和(40.62±4.28)%,对照组卵巢组织中细胞凋亡率低于模型组、联合组(F=168.200,P<0.001),抑制剂组卵巢组织中细胞凋亡率较模型组高(P<0.001),冷应激组细胞凋亡率较抑制剂组高(P<0.001)。见图2。

图2 冷应激对PCOS大鼠卵巢组织细胞凋亡的影响(TUNEL×200)
2.5 冷应激对5组PCOS大鼠HSP90、NF-κB p65、IkB、TAK-1、RIP蛋白表达的影响 与对照组比较,模型组大鼠卵巢组织中HSP90、NF-κB p65、IkB、TAK-1、RIP升高(P<0.05),与模型组比较,冷应激组与对照组大鼠卵巢组织中HSP90、NF-κB p65、IkB、TAK-1、RIP升高(P<0.05)。见表3,图3。

图3 5组大鼠HSP90、NF-κB p65、IkB、TAK-1和RIP水平比较
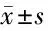
表3 5组大鼠HSP90、NF-κB p65、IkB、TAK-1、RIP水平比较 n=10,
2.6 HSP90与NF-κB p65在冷应激刺激后的相关性分析 大鼠卵巢组织中HSP90与PI3K在冷应激刺激后的表达呈正相关关系(r=0.581,P<0.001)。见图4。

图4 HSP90与NF-κB p65相关分析
3 讨论
HSP90 是应激反应上调的分子伴侣蛋白,过度激活的HSP90参与PCOS的产生及发展。此外HSP90还是促炎因子的一种。HSP90靶蛋白RIP激酶、TAK-1激酶和IκB 激酶均属于NF-κB通路相关因子,当细胞受到刺激后,IKB磷酸化后将NF-κB释放至胞核并发生磷酸化,通过调控下游相关因子,促进炎性反应发展[9]。HSP90在PCOS大鼠中显著降低,抑制其水平后会加重PCOS发展[10]。但HSP90在经过冷应激刺激后表达会升高,因此本实验运用HSP90抑制剂作为对照,进一步证实冷应激可加重PCOS大鼠病情。在本实验中经过冷应激刺激后NF-κB p65、IkB、TAK-1、RIP、HSP90水平升高,且HSP90与NF-κB在冷应激刺激下具有正相关关系。提示冷应激可能是通过抑制HSP90表达加重炎性反应,从而加重PCOS大鼠病情。二甲双胍通过抑制HSP水平抑制NF-κB通路,减少炎性反应,改善PCOS病情[11]。证实了本研究上述结论。此外,NF-κB信号通路还可调控细胞生物学行为。本研究发现PCOS大鼠卵巢组织细胞在经过冷应激干预后会加速凋亡。研究提出,通过抑制NF-κB 信号通路,减少卵巢颗粒细胞凋亡,改善PCOS病情[12]。证实了本研究的上述结论。基于此,本实验认为冷应激干预后导致HSP90异常升高从而激活了NF-κB通路后,加重了炎性反应及卵巢组织细胞凋亡,从而促进PCOS恶化。
PCOS病理特点之一是高雄激素、高促黄体生成素,同时也是导致生殖功能产生障碍的重要原因[13]。研究认为应激状态可能通过激活卵巢HSP90的表达,降低FSH水平,阻碍颗粒细胞增殖分化,从而降低芳香化酶活性,使雌激素减少,卵泡发育受阻,促进大鼠形成多囊卵巢状态[14]。常壮鹏等[15]研究提示,通过抑制NF-κB炎性反应信号通路,可改善卵巢组织病理形态,并调节卵巢激素微环境。本研究与上述结论相似。这提示冷应激通过增加HSP90反应介导NF-κB通路,进而调控性激素水平,加重PCOS生殖功能障碍。此外,本研究HE染色及氧化应激结果也可证实上述结论。
综上所述,冷应激可通过增加HSP90水平后,促进NF-κB通路激活,从而加重PCOS生殖功能障碍。
