miR-429对烧伤小鼠肺组织炎性反应和氧化应激的影响
2024-03-14张珂珂黄国宝
张珂珂 黄国宝
严重烧伤是一个复杂的病理生理过程,可导致多种器官功能障碍[1-3]。美国的一项流行病学调查表明,在全身面积>30%的严重烧伤患者中,急性肺损伤(ALI)是最常见的并发症,其发病率为26.7%~45%,死亡率为40%~60%[4-5]。ALI通常发生在烧伤后24~48 h内,主要表现为肺泡-毛细血管屏障受损、组织水肿、炎性细胞浸润和氧化应激损伤[6-7]。其中,炎症反应和氧化应激在ALI中扮演了重要的角色[8]。研究证明,miRNA作为炎性反应和氧化应激相关基因的关键调节因子,被认为是改善ALI的潜在治疗靶点[9]。例如,miR-135a-5p通过靶向TBK1进而调控ALI相关的炎性反应和氧化应激反应[10]。研究证明, miRNA-429降低与肺组织损伤密切相关,抑制miRNA-429表达能够明显降低炎性细胞因子的分泌,对肺损伤具有一定的保护作用[11]。另外,Fan等[12]证实,过表达miRNA-429能够提高氧化应激相关分子SOD和CAT含量。以上结果显示,miRNA-429在炎性反应、氧化应激等方面发挥重要作用。本研究旨在明确miR-429在烧伤模型小鼠中的表达情况,并进一步探讨miR-429对烧伤小鼠ALI的影响及分子机制。
1 材料与方法
1.1 实验动物 30只6~8周龄C57BL/6小鼠均购买于上海南方模式生物科技有限公司,许可证号为KYXK(沪)2023-0005,体重为200~250 g,购入后于SPF级动物饲养中心饲养,饲养湿度约55%~60%,温度23~25℃,12 h昼夜光照循环,正常进食和自由饮水。待C57BL/6小鼠适应性饲养1周后再进行实验。实验均遵循动物实验指导原则。该实验经过潍坊医学院附属医院动物伦理与福利委员会批准。
1.2 主要试剂 MDA检测试剂盒、SOD检测试剂盒、CAT检测试剂盒、 GSH检测试剂盒均购自上海碧云天生物技术有限公司;TNF-α ELISA试剂盒、IL-1β ELISA试剂盒、IL-6 ELISA试剂盒以及IL-8 ELISA试剂盒均购自武汉艾美捷科技有限公司;EASYspin Plus 快速RNA提取试剂盒购自杭州昊鑫生物公司;Hifair®Ⅲ One Step RT-qPCR SYBR Green试剂盒购自上海翊圣生物科技有限公司;苏木素伊红(HE)染色试剂盒、RIPI组织裂解液、BCA蛋白浓度测定试剂盒、TUNEL试剂盒均购自北京索莱宝生物技术有限公司;Nrf2抗体、HO-1抗体、GAPDH抗体以及HRP标记的二抗均购自美国Abcam公司;miR-429 antagomir及其阴性对照由广州锐博生物技术有限公司提供。荧光定量PCR仪购自美国Roche公司;低温高速离心机、化学发光酶标仪均购自美国Thermo Fisher公司;荧光显微镜观察购自日本奥林普斯公司。
1.3 方法
1.3.1 构建小鼠烧伤模型:根据杨星等[13]报道,采用热水烫伤法构建小鼠烧伤模型。用30 mg/kg的戊巴比妥钠对小鼠进行腹膜内麻醉,将小鼠背部毛发剃除后,然后将其固定在自制的模板装置上。随后将热水(100℃)倒在小鼠皮肤的背表面上10 s造成深Ⅱ度烧伤创面。其中,全层皮肤烧伤平均占全身表面积的30%。
1.3.2 动物分组与处理:24只C57BL/6小鼠随机数表法分为对照组、模型组、阴性对照组和miR-429 抑制剂组,每组6只。其中,模型组、阴性对照组和miR-429 抑制剂组小鼠通过热水烫伤法构建小鼠烧伤模型。另外,根据殷佳娜等[14]的给药方式,在术前3 d,miR-429 抑制剂组和阴性对照组按20 μg/只的剂量分别通过尾静脉注射miR-429 antagomir慢病毒和阴性对照miR-NC,1次/d,持续3 d;对照组和模型组小鼠给予等体积0.9%氯化钠溶液。实验动物于造模成功12 h后处死,取右肺下叶组织,以备待用。
1.3.3 qRT-PCR实验检测小鼠肺组织中miR-429表达 根据Trizol裂解液说明书,提取肺组织中的总RNA。采用紫外吸收法测定RNA的纯度和浓度,使用EASYspin Plus 快速RNA提取试剂盒按照说明书反转录生成cDNA。随后,按照Hifair®III one step RT-qPCR SYBR green 试剂盒说明书进行RT-qPCR反应。其中以miR-429 (正向:5’-AGTGCAGGGTCCGAGGTA
TT-3’,反向: 5’-CGCGCGTAATACTGTCTGGTAA-3’)和U6 (正向: 5’-CTCGCTTCGGCAGCACATATACT-3’,反向: 5’-ACGCTTCACGAATTTGCGTGTC-3’)为引物,扩增miR-429。RT-qPCR反应条件如下:逆转录:预变性:95℃,5 min;扩增:95℃,10 s;60℃,30 s,共40个循环。最后采用2-ΔΔCt法计算miR-429的相对表达量。
1.3.4 ELISA法检测小鼠肺组织中TNF-α、IL-1β、IL-6、MDA、SOD、CAT和GSH表达:收集各组小鼠100 mg肺组织,按照试剂盒说明书测定各组小鼠肺组织中TNF-α、IL-1β、IL-6、MDA、SOD、CAT和GSH含量。
1.3.5 HE染色观察小鼠肺损伤情况:将肺组织切割成3 mm3大小的组织块,用4%的多聚甲醛固定组织样本48 h后,石蜡包埋,切片(厚度为5 μm)。随后,将切片浸入到二甲苯和乙醇中。待切片脱水后,用苏木精和伊红染色液染色,树胶封片。最后使用光学显微镜观察肺组织病理结构变化。其中,细胞核呈蓝色,而细胞浆呈粉红色或红色。
1.3.6 TUNEL法检测小鼠肺组织细胞凋亡情况:将制备的石蜡切片经梯度乙醇水合后,用无DNase的蛋白酶K孵育10 min。3% H2O2溶液中室温孵育20 min,然后与TUNEL反应液在37℃孵育1 h。最后,用PBS清洗切片并通过荧光显微镜观察TUNEL阳性细胞。使用Image J软件对TUNEL阳性细胞进行计数。
1.3.7 Western blotting检测Nrf2和HO-1蛋白表达:用RIPA组织裂解液(含1% PMSF)于冰上充分裂解肺组织,用4℃预冷的离心机以12 000 r/min离心20 min,取上清并使用BCA蛋白定量试剂盒测定总蛋白浓度。随后,加入5×loading buffer,100℃煮沸10 min,使蛋白变性。将等量总蛋白用10%的SDS-PAGE凝胶电泳分离,随后将凝胶转移至经活化的PVDF膜上进行电转。转膜结束后,3%的BSA溶液室温封闭1 h。然后将蛋白膜与一抗4℃孵育过夜。其中一抗的稀释比均为1∶1 000。TBST清洗后用HRP标记的二抗(1∶2 000)室温孵育1 h。PBS洗涤3次后,使用ECL显影液曝光蛋白,Image J软件分析条带,检测各组小鼠肺组织中Nrf2、HO-1和GAPDH蛋白表达。
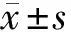
2 结果
2.1 4组小鼠肺组织中miR-429表达比较 与对照组比较,miR-429在模型组小鼠肺组织中高表达(P< 0.05);与模型组比较,miR-429在阴性对照组中的表达差异无统计学意义(P>0.05);与阴性对照组比较,miR-429在抑制剂组中的表达明显下降(P< 0.05)。见表1。
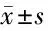
表1 4组小鼠肺组织中miR-429和炎症因子TNF-α、IL-1β、IL-6表达比较 n=6,
2.2 4组小鼠肺组织中炎性细胞因子TNF-α、IL-1β和IL-6表达比较 与对照组相比,模型组小鼠肺组织中炎性因子TNF-α、IL-1β和IL-6表达均显著升高 (均P< 0.05)。与模型组相比,阴性对照组小鼠肺组织中炎性因子TNF-α、IL-1β和IL-6表达均无明显差异(均P> 0.05)。与阴性对照组比较,miR-429抑制剂组小鼠肺组织中炎性因子TNF-α、IL-1β和IL-6表达均显著降低 (P< 0.05)。见表1。
2.3 4组小鼠肺组织中MDA、SOD、CAT和GSH含量比较 与对照组比较,模型组小鼠肺组织中MDA含量显著升高,而SOD、CAT和GSH含量均明显下降(P<0.05)。与模型组相比,阴性对照组小鼠肺组织中MDA、SOD、CAT和GSH含量均无明显差异(P>0.05)。与阴性对照组比较,miR-429抑制剂组小鼠肺组织中MDA含量显著降低,而SOD、CAT和GSH含量均明显升高(P<0.05)。见表2。
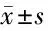
表2 4组小鼠肺组织中MDA、SOD、CAT和GSH表达比较 n=6,nmol/mg,
2.4 4组小鼠肺组织病理学变化比较 在对照组中,小鼠肺组织结构清晰,无炎症细胞浸润。与对照组比较,模型组小鼠的肺泡壁变宽,出现水肿和明显的炎症细胞浸润。与阴性对照组比较,模型组小鼠肺组织的病理结构无明显变化。与阴性对照组比较,miR-429抑制剂组小鼠肺组织中的炎症和水肿情况得到明显缓解,且肺泡壁变窄。见图1。

图1 4组小鼠肺组织HE染色(HE×100)
2.5 4组小鼠肺组织细胞凋亡情况比较 与对照组比较,模型组小鼠肺组织中TUNEL阳性细胞数显著升高 (P< 0.05)。与模型组比较,阴性对照组小鼠肺组织中TUNEL阳性细胞数无明显差异(P> 0.05)。与阴性对照组比较,miR-429抑制剂组小鼠肺组织中TUNEL阳性细胞数显著降低(P< 0.05)。见图2,表3。

图2 4组小鼠肺组织中TUNEL阳性细胞数比较;绿色为TUNEL阳性细胞,蓝色细胞核;标尺=40 μm
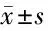
表3 4组小鼠肺组织中TUNEL阳性细胞数以及Nrf2和HO-1蛋白表达比较n=6,
2.6 4组小鼠肺组织中Nrf2和HO-1蛋白表达 与对照组相比,模型组小鼠肺组织中Nrf2和HO-1蛋白表达显著降低 (P< 0.05)。与模型组相比,阴性对照组小鼠肺组织中Nrf2和HO-1蛋白表达无明显差异(P> 0.05)。与阴性对照组比较,miR-429抑制剂组小鼠肺组织中Nrf2和HO-1蛋白表达显著升高(P<0.05)。见图3,表3。
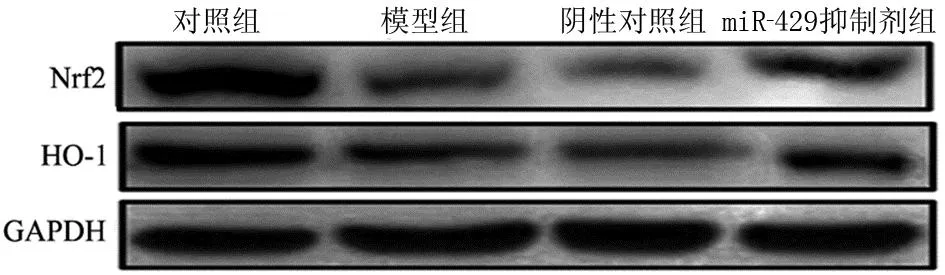
图3 4组小鼠肺组织中Nrf2和HO-1蛋白表达表达
3 讨论
ALI是一种常见的呼吸系统疾病,其症状包括肺微血管通透性增加,以及炎症细胞浸润引起的弥漫性肺间质和肺泡腔水肿。ALI是大面积深度烧伤患者最常见的并发症,特别是在合并吸入性损伤、休克和延迟复苏时[15]。因此,如何防治ALI对烧伤患者的治疗具有重要的临床意义。
文献显示,miR-429在脂多糖(LPS)诱导的小鼠ALI模型和LPS刺激的细胞损伤模型中表达上调,而抑制miR-429表达可改善LPS小鼠的肺损伤[16-17]。与上述研究一致,我们在烧伤诱导的ALI小鼠的肺组织中观察到高表达的miR-429。提示miR-429或许对烧伤诱导的ALI发挥重要的调节功能,抑制miR-429表达能够减轻烧伤小鼠肺组织损伤。因此,为了验证这一假设,我们利用慢病毒载体miR-429 antagomir通过尾静脉注射的方式降低小鼠体内miR-429表达。本结果显示,烧伤小鼠给予miR-429 antagomir干预后,其肺组织中miR-429 表达显著下调。烧伤后,微血管通透性的升高会导致液体渗漏和微循环灌注异常,进而引起炎症级联反应。炎性介质升高会引诱内皮细胞产生过量的ROS,从而导致内皮细胞损伤。受损的内皮细胞反过来增加血管通透性,促进炎性细胞浸润,从而恶化并引发额外的肺损伤[18]。因此,炎性反应和氧化应激在烧伤诱导的ALI中起着核心作用。本研究中,烧伤小鼠肺组织中促炎细胞因子TNF-α、IL-1 β和IL-6水平明显升高,TUNEL阳性细胞数量增加。同时,氧化应激相关分子发生明显改变,即MDA含量明显升高,而SOD、CAT和GSH酶活力显著降低。然而,当烧伤小鼠下调miR-429表达后能够逆转上述结果。提示miR-429对烧伤小鼠的肺损伤具有一定的保护作用。miR-429对烧伤小鼠肺组织的保护作用也在肺相关的病理学观察中得到进一步验证。HE染色显示,烧伤小鼠肺泡壁变宽,出现水肿和明显的炎症细胞浸润,而抑制miR-429表达后肺组织病变明显减轻。总之,抑制miR-429表达能够减少烧伤诱导的ALI中促炎细胞因子的产生、抑制细胞凋亡和降低氧化应激反应。
NRF2/HO-1信号参与抗氧化和抗炎过程,能够减少线粒体损伤,调节钙离子内流和细胞死亡,在多种疾病的进程中发挥了重要作用,如肺部疾病、心血管疾病和神经疾病等[19]。先前的研究表明,Nrf2/HO-1轴通过下调炎性因子,降低MDA含量,提高SOD和GSH-Px水平,参与了白藜芦醇诱导的心肌缺血再灌注损伤小鼠的炎症和氧化应激[20]。上述研究表明,Nrf2/HO-1轴具有抗炎和抗氧化活性。在本研究中,我们发现在烧伤小鼠肺组织中Nrf2/HO-1信号通路被明显激活,而降低miR-429表达能够明显抑制Nrf2/HO-1信号通路的活性。提示miR-429对烧伤小鼠肺组织的保护作用可能与Nrf2/HO-1信号通路密切相关。因此,在接下来的实验中我们将通过Nrf2/HO-1信号通路抑制剂Nrf2/HO-1-IN-1,来进一步验证miR-429对Nrf2/HO-1通路的调控作用。
综上所述,miR-429低表达能够明显提高烧伤小鼠肺组织SOD、CAT和GSH活性并降低 MDA 含量,降低 TNF-α、IL-1β、IL-6 水平,同时提高 Nrf2、HO-1蛋白表达量,提示抑制miR-429表达具有抑制烧伤小鼠肺组织炎性反应和氧化应激的作用,其机制可能与激活 Nrf2/HO-1 通路有关。
