杜仲叶水提取物对植物乳杆菌体外益生特性影响
2024-03-13张丽华冯路瑶唐培鑫李昌文赵光远
张丽华,冯路瑶,唐培鑫,李昌文,赵光远,纵 伟
(郑州轻工业大学 食品与生物工程学院,郑州 450002)
0 引言
杜仲(Eucommia ulmoides Oliv.)是中国特有的名贵药用树种。现代药理研究表明,杜仲叶与杜仲皮化学成分相似,都含有环烯醚萜类、多糖类和杜仲胶等物质,具有降血压、抗炎和神经保护等生物活性[1]。在比较杜仲皮提取物(Eucommia ulmoides bark extract,EBE)和杜仲叶提取物(Eucommia ulmoides leaf extract,ELE)的降脂研究中发现,EBE和ELE能够显著改善脂质代谢紊乱和血糖水平,且ELE和EBE的抗高脂血症效果没有差异,可能是通过调节肠道微生物群的结构来控制高脂血症[2]。WANG等[3]研究发现,ELE的降压效果优于EBE。综合评价ELE的安全性的研究表明,经ELE处理后,大鼠生长性能增强,没有检测到氧化损伤、炎症反应和组织病理学损伤。因此,ELE作为中国传统保健食品食用是安全的[4]。
杜仲叶量大易获取,对其进行研究有利于杜仲种植业和食品加工业的可持续发展。近年来关于杜仲叶在食品加工方面的研究逐渐增多。然而,关于杜仲叶水提取物(Eucommia ulmoides leaf water extract,ELWE)在益生菌领域的研究鲜有报道。刘梦培等[5]研究表明,经乳酸菌发酵后的杜仲叶提取液产生了独特花香的二氢-α-紫罗兰酮。ZHAO等[6]报道了ELWE可以促进保加利亚乳杆菌的生长,增加衰老小鼠肠道中的细菌多样性和厚壁菌门/拟杆菌门的比例。益生菌在生产、加工和消化等过程中,会面临环境或人类消化的各种压力。因此,提高益生菌应对环境胁迫的能力,对其益生功能的发挥和工业应用具有重要意义。通过研究ELWE对植物乳杆菌产酸和不同胁迫环境下活性的影响,可为杜仲叶作为新型食品资源在益生菌产品开发方面提供参考。
1 材料和方法
1.1 材料与试剂
杜仲叶,品种为华仲1号,2021年6月采自国家林业局泡桐研究开发中心的杜仲种植基地;植物乳杆菌(Lactobacillus plantarum CICC 20022),中国工业微生物菌种保藏中心;MRS肉汤、MRS琼脂培养基,北京奥博星生物技术有限责任公司;乙醚,天津市富宇精细化工有限公司;乳酸(分析标准品,HPLC≥98%)、胃蛋白酶(30 000 U/g)、胰蛋白酶(250 U/mg)、胆酸钠(猪),上海源叶生物科技有限公司;甲酸、乙酸、2-羟基丁酸(分析标准品,HPLC≥98%)、偏磷酸(分析纯),上海阿拉丁生化科技股份有限公司;2.5%戊二醛,上海麦克林生化科技有限公司。
1.2 仪器与设备
YXQ-50A型高压蒸汽灭菌锅(上海博顺医用生物仪器有限公司);PSH-3C型pH计(上海易电科学仪器有限公司);Agilent 7820A型气相色谱仪(美国安捷伦公司);Regulus 8100型高分辨场发射扫描电镜(日本日立公司);RE-52AA型旋转蒸发仪(上海亚龙生化仪器厂);ST-LS01型水分测定仪(山东三体仪器有限公司)。
1.3 方法
1.3.1 ELWE的制备和成分测定
杜仲叶经50 ℃烘干,粉碎后过60目筛得到杜仲叶粉。称取杜仲叶粉5 g和去离子水100 mL,在锥形瓶中混匀后,280 W超声提取30 min,5 000 r/min离心作用20 min,上清液在50 ℃旋转蒸发浓缩后冷冻干燥,得到ELWE。密封后在-20 ℃的冰箱中储存备用。
灰分含量参照GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》;蛋白质含量参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》;脂肪含量参照GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》;水分含量采用水分测定仪测定;多糖含量采用苯酚硫酸法测定[7];总酚含量采用福林酚法测定[8];黄酮含量采用NaNO2-Al(NO3)3法测定[9]。
1.3.2 植物乳杆菌培养
将保存在甘油中的植物乳杆菌转移到100 mL新鲜MRS肉汤培养基中,并在(37±1) ℃的恒温培养箱中培养48 h。之后取1 mL该培养基再次转移到新的100 mL MRS肉汤中。同样方法,获得2次活化的植物乳杆菌悬浮液备用。将培养基离心作用(4 ℃,7 000 r/min,10 min),用无菌水洗涤2次,收获细菌细胞;然后向细菌细胞加入无菌水,制成质量体积比1:10的细菌悬浮液备用,细菌计数为6.00 lg CFU/mL。
1.3.3 活菌数、pH值和乳酸测定
将制备的ELWE直接添加到MRS肉汤培养基中,以制备20,80,320 mg/mL改良培养基。改良后的培养基在高压蒸汽灭菌锅中灭菌(121 ℃,15 min);然后将植物乳杆菌细胞悬浮液按照1%接种量依次接种到不同浓度提取物的改良液体培养基中,在37 ℃下培养0,12,24,36,48,60,72 h后分别取样,进行活菌数、pH值和乳酸含量测定。
菌落计数参考GB 4789.35-2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》;pH值采用pH计直接测定;乳酸含量参考RVIZ等[10]的方法,采用气相色谱测定。
1.3.4 扫描电子显微镜观察
参照WANG等[11]的描述。将植物乳杆菌在改良培养基中培养24 h,经离心作用(9 000 r/min,4 min)和重悬2次获得细胞,将细胞于4 ℃在体积比为2.5%的戊二醛中固定4 h。随后用磷酸缓冲盐溶液(pH=7.2)洗涤细胞3次,依次用30%,50%,70%,80%,90%乙醇脱水1次,再用无水乙醇脱水3次。最后用乙酸异戊酯置换2次。将菌液滴在硅片上经烘箱(40 ℃,12 h)烘干固定,喷金上样观察。
1.3.5 模拟胃肠环境中的存活率
参考ZOU等[12]描述的方法。将添加胃蛋白酶的改良MRS肉汤培养基的pH值用0.1 mol/L HCl调节至2;然后通过0.22 µm膜对培养基进行过滤除菌,得到模拟胃液。向改良的MRS肉汤培养基中添加胰蛋白酶和胆盐,用0.1 mol/L NaOH调节pH值至8后,通过0.22 µm膜制备成模拟肠液。将50 µL细菌悬浮液添加到模拟胃液(5 mL)和肠液(5 mL)中,并在培养箱(37 ℃,3 h)中培养。存活率(N)通过下式计算:
式中 N1——培养3 h后的细胞计数,CFU/mL;
N0——开始培养时的细胞计数,CFU/mL。
1.3.6 不同胁迫环境下的耐受性
根据MA等[13]的方法,分别测定添加ELWE对植物乳杆菌在热胁迫环境(0,1,2,3 h,50 ℃)、NaCl胁迫环境(100 g/L,0,12,24 h,37 ℃)、胆盐胁迫环境(9 g/L)和冷冻干燥胁迫环境(60 Pa,-50 ℃,22 h)耐受性的影响,以活菌数表示。
1.4 统计分析
结果表示为3次重复测定的平均值±标准差(SD)。使用SPSS 26.0软件进行方差分析(ANOVA),P<0.05。
2 结果与分析
2.1 ELWE的基本成分
成分测定表明,ELWE的粗灰分含量最高,为(36.22±0.29) g/(100 g),蛋白质和脂肪含量分别为(2.58±0.36),(2.72±0.21) g/(100 g),与王翔等[14]采用相同方法测得的结果相比,蛋白质和脂肪含量较低。这可能是由于杜仲叶经水提取后,其含有的水不溶性蛋白质和脂肪成分发生损失。粗多糖、总多酚和总黄酮的含量显著高于王翔等[14]报道的结果,主要是由于经水提取后,水溶性的粗多糖、总多酚和总黄酮类物质得到富集,分别达到(11.27±0.80),(12.06±2.26),(4.87±0.91) g/(100 g)。ELWE既保留了杜仲叶原有的营养成分,也使得粗多糖、总多酚和总黄酮含量显著增加,因此其有作为食品功能因子补充剂的潜力。
2.2 对植物乳杆菌活菌数、pH值和乳酸含量的影响
添加20,80,320 mg/mL ELWE的培养基中植物乳杆菌的生长曲线如图1(a)所示。对照组在24 h后进入稳定期,36 h后进入衰亡期,60 h后活菌数迅速下降。ELWE中含有多糖类、蛋白质和矿物质等营养成分,可以为菌体提供必要的生长因子[15]。在发酵前36 h,与其他组相比,320 mg/mL组的活菌数没有显著增加,这可能是由于ELWE中含有的大量酚酸类物质(如绿原酸等)[16],抑制了植物乳杆菌的生长。在发酵36 h后,酚酸类物质有可能被植物乳杆菌水解利用,或植物乳杆菌适应了酚酸胁迫环境,因此活菌数高于其他组。SANTOS等[17]报道了绿原酸可被乳酸菌水解,以产生肉桂酰酯酶,且当绿原酸的浓度下降到足够低时,植物乳杆菌能够迅速增殖。因此在发酵36 h后,320 mg/mL组的活菌数显著高于对照组。
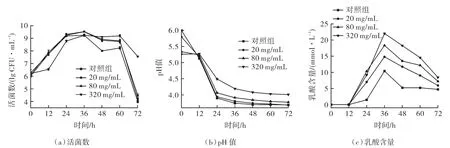
图1 不同浓度ELWE对植物乳杆菌活菌数、pH值和乳酸含量的影响Fig.1 Effects of different concentrations of ELWE on viable count, pH and lactic acid content of Lactobacillus plantarum
改良培养基的pH值的变化如图1(b)所示。在0~24 h内,对照组的pH值迅速下降,表明伴随植物乳杆菌的增殖产生大量有机酸。在36 h时,由于植物乳杆菌生长环境中的酸度增加,可能抑制了植物乳杆菌的生长和代谢,导致发酵后期pH值缓慢下降。与对照组相比,20 mg/mL ELWE对植物乳杆菌生长过程中pH值的变化没有显著影响。然而,在培养过程中,改良培养基(320 mg/mL)的pH值较其他组下降更缓慢,且pH值随着添加提取物浓度的增加而升高,这可能是由于ELWE中含有的一些缓冲盐物质(如钙盐和钾盐)所致[18]。
不同浓度ELWE对植物乳杆菌产乳酸的影响如图1(c)所示。在发酵前12 h,植物乳杆菌不产生乳酸,之后乳酸含量显著升高。在36 h时,改良培养基中乳酸含量达到最高,20,80,320 mg/mL组分别较对照组(10.41 mmol/L)提高(42.06±0.05)%,(76.01±0.03)%,(111.64±0.07)%。在发酵中期,植物乳杆菌通过同型乳酸发酵,经糖酵解途径产生乳酸,导致培养基中积累大量的乳酸。对照组和试验组的乳酸含量均在36 h达到最大值,随后呈下降趋势,这和田亚冉[19]的研究结果一致,且其产乳酸的能力和ELWE浓度呈正相关。
2.3 对植物乳杆菌形态影响
添加不同浓度ELWE对植物乳杆菌形态的影响如图2所示。对照组中,植物乳杆菌菌体呈杆状,普遍偏短,其细胞表面部分产生轻微褶皱。添加20 mg/mL ELWE对植物乳杆菌的形态没有影响。添加80 mg/mL ELWE后,植物乳杆菌菌体更加饱满,表面褶皱消失,菌体略微变长。添加320 mg/mL ELWE后,植物乳杆菌的菌体仍呈杆状,但菌体发生聚集,这可能是由于水提取物浓度过高,导致菌体形态发生改变。马佳歌等[20]研究发现,在吐温80胁迫下,植物乳杆菌菌体呈现出细长的棒状,而在葡萄糖胁迫下得到的菌体呈短棒状或卵圆形。这是因为在不同的营养胁迫环境中,植物乳杆菌菌体可以通过改变菌体形态来保证其营养物质的摄入。添加不同浓度ELWE后,植物乳杆菌的形态变化并不显著,但添加高浓度ELWE会促使菌体发生聚集,因此可进一步推测,菌体聚集对植物乳杆菌在不同胁迫环境下的活性可能会有一定的影响。

图2 不同浓度ELWE对植物乳杆菌形态影响的扫描电镜图Fig.2 Effects of different concentrations of ELWE on SEM image of Lactobacillus plantarum
2.4 对植物乳杆菌在模拟胃肠道耐受性的影响
如表1所示,在模拟胃液环境中发酵3 h后,对照组和20 mg/mL ELWE组均未检测到植物乳杆菌活菌数,表明该菌对胃液中胃蛋白酶消化和酸性条件的抵抗力较差,添加低浓度ELWE不能对处于胃液环境中的植物乳杆菌起到保护作用。当ELWE浓度达到80,320 mg/mL时,植物乳杆菌存活率分别达到87.77%和82.93%,表明提高ELWE浓度能够改善植物乳杆菌的胃液耐受性。通过观察在模拟肠液环境下发酵3 h的活菌数变化,发现植物乳杆菌在肠液中的存活率较高。当ELWE浓度为20 mg/mL时,活菌数增长到6.09 lg CFU/mL,与对照组相比提高7.06%。且随着ELWE浓度的增加,活菌数没有显著差异。

表1 ELWE对植物乳杆菌胃肠道模拟耐受性的影响Tab.1 Effect of ELWE on gastrointestinal analog tolerance of Lactobacillus plantarum in vitro
相关研究表明,ELWE通过影响肠道菌群结构和胆汁酸组成,来保护结肠上皮细胞的完整性,这种治疗作用可能涉及到益生菌在胃肠道中的定植和存活[21]。植物乳杆菌已经被证明需要利用不同的糖(如葡萄糖、乳糖、蔗糖和半乳糖)合成胞外多糖[22]。杜仲叶多糖是由高浓度的葡萄糖、半乳糖和甘露糖组成[23],这可能刺激植物乳杆菌产生胞外多糖,从而解释ELWE对植物乳杆菌的保护作用,即植物乳杆菌在胃肠道中的存活率可能与细胞外有类似胞外多糖作用的多糖浓度有关,这些多糖可以充当“盾牌”,减少细胞与胃肠液环境的接触,促进植物乳杆菌在不利环境中的存活。由图2(d)可以看出,高浓度ELWE培养时,植物乳杆菌发生了菌体聚集,且聚集后的菌体周围附着一层类似多糖的黏液,和以上分析结果一致。
2.5 对植物乳杆菌在不同环境胁迫下耐受性的影响
如图3(a)所示,随着热处理时间的延长,植物乳杆菌的存活率下降,但在热胁迫1~2 h时,各组植物乳杆菌的活菌数下降幅度较小,这可能是因为其发生了热应激反应,菌体通过产生热休克蛋白和调节细胞膜组成成分,短时间内提高了植物乳杆菌的耐热性[24]。在50 ℃热胁迫3 h后,各组的活菌数显著下降,其中80 mg/mL组的活菌数显著高于其他组(P<0.05)。
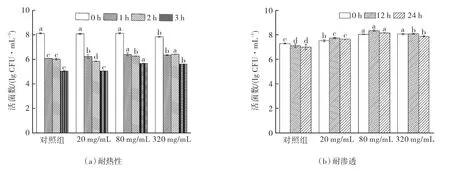
图3 ELWE对植物乳杆菌耐热性、耐渗透、耐胆盐和耐冷冻干燥的影响Fig.3 Effects of different concentrations of ELWE on heat,salt,bile salt and freeze-drying resistance of Lactobacillus plantarum
植物乳杆菌的耐渗透性通常以NaCl胁迫表示,植物乳杆菌在10% NaCl胁迫12,24 h环境中的活菌数如图3(b)所示。添加ELWE的各组的活菌数均显著高于对照组(P<0.05),表明ELWE对植物乳杆菌耐受NaCl胁迫环境具有保护效果。然而,随着ELWE浓度的增加,活菌数没有呈现持续增加的趋势,反而在高浓度(320 mg/mL)时略微下降。研究表明,在生长培养基中添加NaCl能使植物乳杆菌产生滞后生长,而添加ELWE能够抵消这种滞后效应,具体原因可能是植物乳杆菌从ELWE中摄取了某些氨基酸,用以维持系统的渗透压平衡[25-27]。
益生菌在通过肠道时主要面临的是释放到十二指肠中的胆盐,采用9 g/L胆酸钠胁迫12,24 h后的植物乳杆菌活菌数如图3(c)所示。在改良培养基(20 mg/mL)中培养12,24 h后,其存活率均能达到90%以上。这可能是因为杜仲叶中含有铁、钙等微量元素,从而降低胆盐螯合金属离子对细胞造成的伤害;同时水提取物中还含有丰富的氨基酸,被植物乳杆菌代谢后能够调节其细胞膜脂肪酸组成,从而提高植物乳杆菌的胆盐耐受性。
不同浓度ELWE对植物乳杆菌耐受真空冷冻干燥(60 Pa,-50 ℃,22 h)结果如图3(d)所示。添加80 mg/mL ELWE时,植物乳杆菌的活菌数最高,与20,320 mg/mL组没有显著差异,但显著高于对照组。相关研究指出,天冬氨酸可显著提高某些植物乳杆菌真空冷冻干燥后的存活率,主要是由于天冬氨酸能够增加肽聚糖、长链脂肪酸、不饱和脂肪酸和环丙烷脂肪酸等含量,减少冷冻干燥过程对植物乳杆菌细胞壁和细胞膜的损伤[28-29]。由于天冬氨酸是杜仲叶中含量最多的游离氨基酸,因此也使得其成为ELWE中可能提高植物乳杆菌冻干存活率的原因之一。
3 结语
ELWE对植物乳杆菌的活菌数和产酸性能有积极影响。在改良培养基(20,80,320 mg/mL)中培养48 h时,植物乳杆菌的活菌数分别为(8.92±0.08),(8.84±0.11),(9.11±0.03) lg CFU/mL,显著高于对照组[(8.00±0.04) lg CFU/mL];在改良培养基中培养36 h时,乳酸含量分别提高(42.11±0.05)%,(76.05±0.03)%,(111.64±0.07)%。在改良培养基(80,320 mg/mL)中,植物乳杆菌的菌体更加饱满,且高浓度ELWE能够使菌体发生聚集,导致菌体形态发生改变。
不同浓度的ELWE对植物乳杆菌在胁迫环境中的保护作用存在一定差异。在胃液环境的胁迫下,80 mg/mL处理组的对数存活率能够达到87.77%(3 h)。在热胁迫(3 h,50 ℃)、NaCl胁迫(10%,24 h)、胆盐胁迫(0.9%,24 h)和真空冷冻干燥胁迫(60 Pa,-50 ℃,22 h)环境中,80 mg/mL ELWE对植物乳杆菌的保护效果最优,其活菌数可分别保持在(5.67±0.01),(8.16±0.01),(7.65±0.12),(7.78±0.03)lg CFU/mL。因此,不同胁迫环境中,植物乳杆菌益生特性的改善与ELWE的浓度有关。ELWE在不同胁迫环境中对菌体保护的最适浓度需要进一步研究。此外,目前杜仲叶功能成分分离和纯化仍有局限性,而其水提取物更易获得,这将有利于其在益生菌等保健食品领域中的应用。
