变异型高致病性鹅源禽呼肠孤病毒的分离和鉴定
2024-03-13钱金涵朱亭帆马陈淑秦爱建金文杰
钱金涵,朱亭帆,王 强,马陈淑,秦爱建,3,金文杰,3,4
(1. 扬州大学兽医学院,江苏 扬州 225009;2.扬州大学江苏省动物预防医学重点实验室,江苏 扬州 225009;3. 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;4.扬州大学动物疾病检测与技术服务中心,江苏 扬州 225009)
禽呼肠孤病毒(Avian reovirus,ARV)是一种分节段的双股RNA病毒,属于呼肠孤病毒科(Reoviridae)正呼肠孤病毒属(Orthoreovirus)[1]。ARV是引起全世界家禽疾病中最为重要的病原之一,能感染包括鸡、鸭、鹅在内的多种禽类[2],ARV感染在世界各地均有发生,我国自20世纪80年代中期以来已有多个省市发现本病,严重影响了养禽业的发展。ARV既能引起宿主产生疾病,又能引起宿主免疫抑制,加剧其他病原的感染,既可水平传播也能垂直传播[3,4],对全球家禽业造成重大经济损失。ARV与鸡的病毒性关节炎、发育迟缓综合征和腱鞘炎有关[2]。匈牙利的一项研究表明,鹅感染呼肠孤病毒表现为运动障碍和跛足,并伴有脾炎、肝炎、心外膜炎、关节炎和腱鞘炎[5]。综上所述,ARV感染引起的疾病发病率不断上升且出现了多样化的临床疾病形式,表明ARV的影响越来越大,给养禽业造成了严重的损失。
ARV基因组可按节段大小分为大(L1-L3)、中(M1-M3)和小(S1-S4)三类,它们至少编码8种结构蛋白和4种非结构蛋白[1]。其中S1基因编码的σC蛋白是最小的结构蛋白,为外衣壳的次要组成成分。σC蛋白具有病毒附着[6]和诱导细胞凋亡[7]的作用。ARV诱导的细胞融合已被证明是由σC蛋白介导的,细胞融合可能在病毒发病机制中起重要作用[8]。σC蛋白携带有特异性中和反应的抗原,可诱导细胞产生病毒型特异性的中和抗体[6,9]。ARV基因组中变异最大的基因是σC基因[10],可以利用σC基因对ARV进行分类[11]。同时,σC蛋白也是ARV亚单位疫苗的主要研究对象。
本试验从江苏省扬州市江都区某鹅场的病死鹅肝脏和脾脏中分离得到1株鹅源ARV,对该分离毒株进行遗传进化分析,了解ARV的变异趋势和流行情况,以期为该地区ARV的防控提供分子流行病学依据。
1 材料与方法
1.1 病料样品采集和处理 2020年9月,江苏省扬州市江都区某鹅场连续数日发生鹅死亡,对病死鹅进行剖检观察大体病变。采集病死鹅的肝脏和脾脏,将肝脏和脾脏组织与磷酸缓冲盐溶液(Phosphate buffered saline,PBS)按1∶3混合,研磨破碎,4 ℃、10 000 r/min离心10 min,吸取上清过0.22 μm滤器过滤除菌后备用。
1.2 主要试剂 GreenTaqMix、Phanta Max Super-Fidelity DNA Polymerase、RNA提取试剂盒和工程菌株DH5α,均购自南京诺唯赞生物科技股份有限公司;T4连接酶、载体pGEM-T Easy和PrimeScriptTMⅡ 1st Stard cDNA Synthesis Kit,均购自宝日医生物技术(北京)有限公司;QIAquick Gel Extraction Kit,购自QIAGEN公司;AxyPrep质粒DNA小量试剂盒,购自AXYGEN公司;DMEM培养基和胎牛血清,均购自Gibco公司。
1.3 主要仪器 超净操作工作台、涡旋混匀仪和高速冷冻离心机,Eppendorf公司产品;96孔PCR扩增仪,杭州博日科技股份有限公司产品;紫外凝胶成像系统,DNR成像系统公司产品。
1.4 实验动物 无特定病原体(Specific pathogen free,SPF)级鸡胚,10日龄,购自江苏勃林格殷格翰维通生物技术有限公司[生产许可证号:SCXK(苏)2022—0002]。雏鹅,11日龄,购自扬州佳丽鹅业。
1.5 反转录聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-PCR)检测 取500 μL组织研磨液上清按RNA提取试剂盒说明书提取RNA,反转录得到互补脱氧核糖核酸(Complementary deoxyribo nucleic acid,cDNA),参照GenBank中ARV保守序列设计1对引物(表1),由南京擎科生物科技有限公司合成。聚合酶链反应(Polymerase chain reaction,PCR)反应体系:GreenTaqMix 12.5 μL,上游引物1 μL,下游引物1 μL,模板cDNA 2 μL,ddH2O 8.5 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 1 min,30个循环;72 ℃ 5 min,4 ℃保存。用1%琼脂糖凝胶电泳检测RT-PCR产物,将阳性条带送南京擎科生物科技有限公司测序验证。
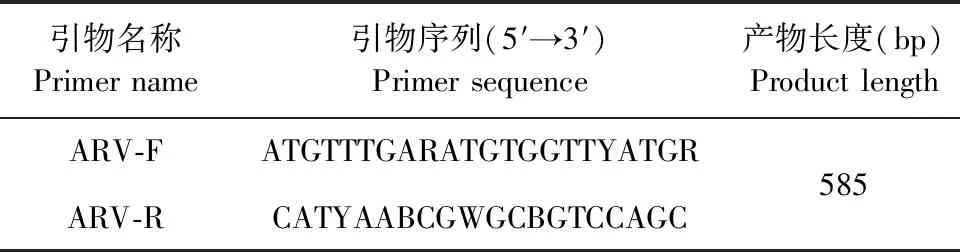
表1 ARV检测引物
1.6 病毒分离培养 将组织研磨液上清加入青霉素-链霉素混合液,于37 ℃孵育30 min,12 000 r/min离心10 min,取上清经0.22 μm滤器过滤。将无菌的滤液经尿囊腔途径接种10日龄SPF级鸡胚,每胚接种0.2 mL,弃去24 h内死亡胚,连续观察8 d。收获尿囊液经细菌检测后通过尿囊腔途径再接种10日龄SPF级鸡胚,连续传代3次。将收获的尿囊液作为种毒(命名为ARV-JSJD-2020株),分装保存于-80 ℃备用。
将种毒尿囊液接种至Vero细胞,在37 ℃、5%CO2培养箱中孵育2 h后弃去尿囊液,用含2%胎牛血清的DMEM培养基维持培养,待120 h后收集病毒,反复冻融5次,5 000 r/min离心10 min取上清,标记为第1代细胞病毒液。重复上述操作,将病毒在Vero细胞上盲传直至出现细胞病变。
1.7 病毒血凝活性测定 配置体积分数为1%的鸡红细胞悬液,在96孔板每孔均加入50 μL PBS,于左侧第1孔加入50 μL种毒尿囊液,依次倍比稀释至第11孔,吸出50 μL弃去,最后一孔作为对照。向每孔中均加入50 μL 1%鸡红细胞悬液,37 ℃静置15 min后观察结果。
1.8 病毒鸡胚半数致死量(Median embryo lethal dose,ELD50)测定 将ARV-JSJD-2020株病毒的种毒尿囊液用PBS缓冲液进行10倍梯度稀释,取10-1~10-8每个稀释度通过尿囊腔膜接种10日龄SPF级鸡胚3枚,接种量为每胚0.2 mL。每天照蛋观察,记录死亡情况并根据Karber法计算ELD50。
1.9 动物回归试验 选择11日龄的雏鹅,试验组颈部皮下注射种毒尿囊液0.2 mL,对照组颈部皮下注射无菌PBS 0.2 mL,每日观察雏鹅情况。若出现死亡,剖检观察发病情况,并用4%甲醛固定脏器制作病理切片,将肝脏和脾脏组织研磨液上清接种鸡胚。
1.10 病毒σC基因分析
1.10.1σC基因PCR扩增 参照GenBank上已发表的ARVσC基因序列,设计1对特异性引物(表2),由南京擎科生物科技有限公司合成。PCR反应体系:2×Phanta Max Buffer 25 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,dNTP Mix 1 μL,上游引物2 μL,下游引物2 μL,模板cDNA 1 ng,补足ddH2O至50 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 15 s,50 ℃ 15 s,72 ℃ 26 s,30个循环;72 ℃ 5 min,4 ℃保存。用1%琼脂糖凝胶电泳检测PCR产物,将PCR产物经胶回收试剂盒回收纯化后与载体pGEM-T Easy连接,转化至DH5α感受态细胞,提取质粒送至南京擎科生物科技有限公司进行测序分析。

表2 ARV σC基因检测引物
1.10.2σC基因序列分析 将ARV-JSJD-2020株的σC基因序列与NCBI上发表的ARVσC基因序列(表3)进行比较,运用MegAlign软件进行核苷酸序列和氨基酸序列分析,并使用MEGA 7软件绘制遗传进化树。
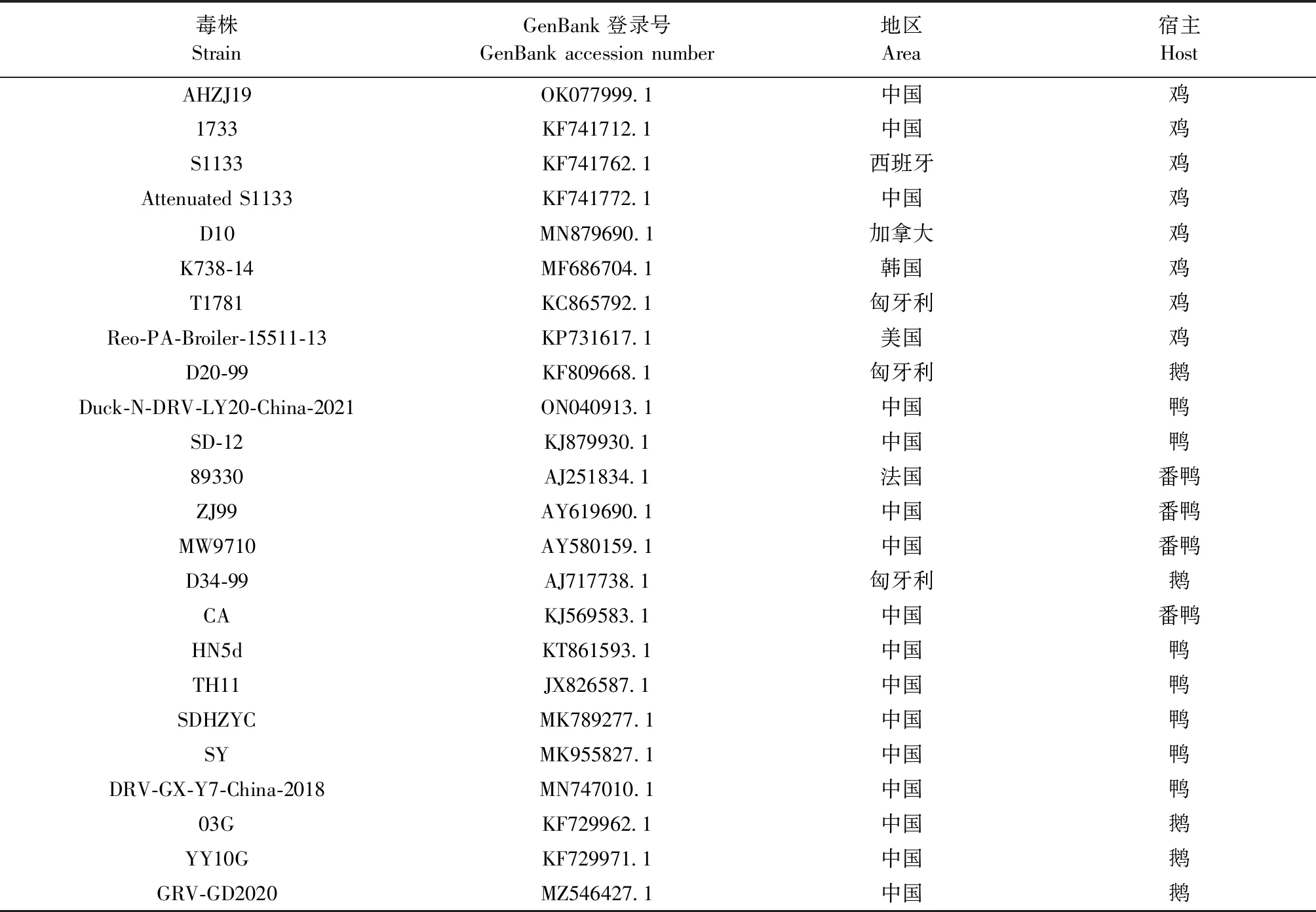
表3 ARV参考株信息
2 结果
2.1 病死鹅剖检观察 剖检可见病死鹅的肝脏和脾脏肿大出血,有心包积液,肠道出现粘连,胰腺出血,腺胃黏膜充血出血,喉头有黏液样渗出。
2.2 RT-PCR检测 如图1所示,疑似病料用RT-PCR可扩增出约585 bp的特异性条带,与预期大小相符。

图1 疑似病料的RT-PCR检测
2.3 病毒分离培养 接种病死鹅肝脏和脾脏研磨液上清的大多数鸡胚在24~96 h内死亡,死亡鸡胚尿囊液清澈,细菌检验结果为阴性,死亡鸡胚的胚体充血出血呈鲜红或紫红色,胚体发育不良,剖检肝脏红肿出血。将收获的种毒尿囊液接种Vero细胞,接种120 h后,未见细胞病变,收获细胞悬液,反复冻融后继续在Vero细胞上传代,至第5代时出现细胞病变,细胞界限模糊,皱缩死亡,出现拉丝现象,折光性改变(图2)。
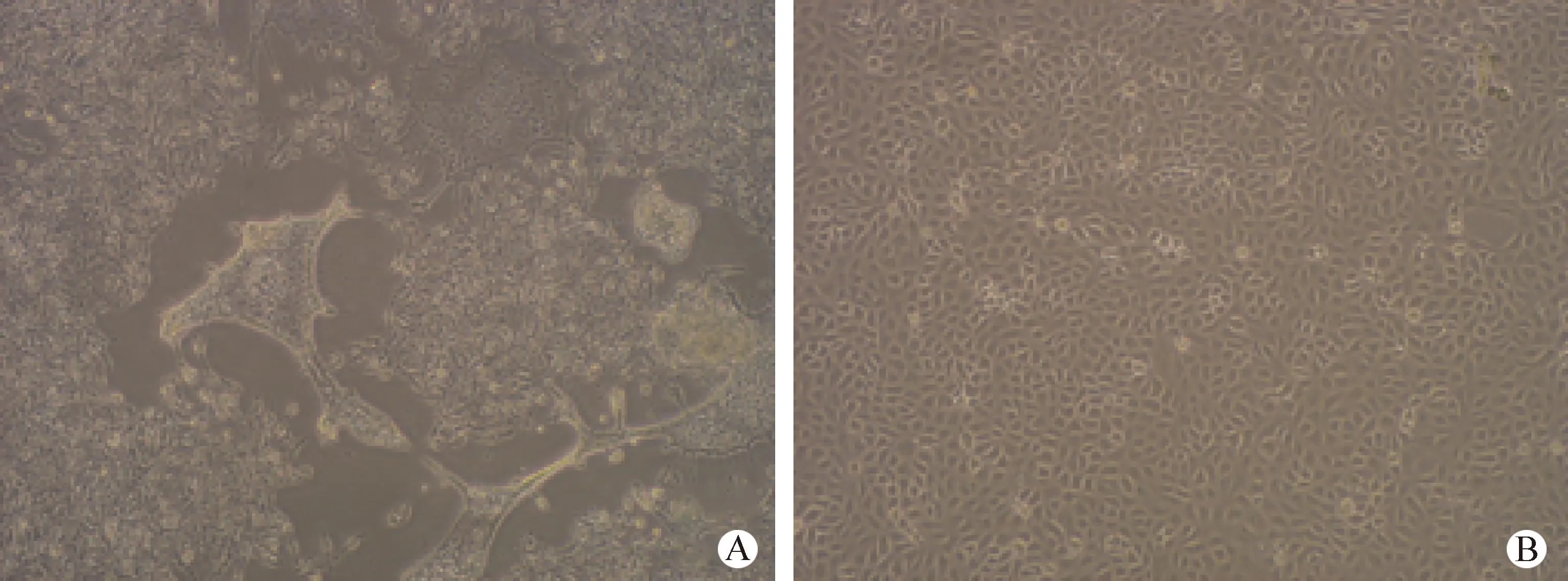
图2 病毒的分离培养(100×)
2.4 病毒血凝活性测定 ARV-JSJD-2020株病毒对1%鸡红细胞无肉眼可见的凝集作用。
2.5 病毒ELD50测定 尿囊液以10-1和10-2稀释度接种鸡胚各死亡3枚,10-3、10-4和10-6稀释度接种鸡胚各死亡1枚,10-5稀释度接种鸡胚死亡2枚,10-7和10-8稀释度接种鸡胚均未死亡。根据Karber法计算,病毒ELD50为10-4.166/0.2 mL。
2.6 动物回归试验 试验组接种种毒尿囊液的雏鹅24 h后即出现死亡现象,剖检可见其肝脏和脾脏出血。组织病理学观察显示,肝脏出现局灶性坏死,坏死灶内出现淋巴细胞浸润(图3)。将试验组肝脏和脾脏研磨液上清接种鸡胚,鸡胚在24~96 h内死亡。

图3 肝脏组织病理学观察(H.E.染色,100×)
2.7σC基因PCR扩增 如图4所示,σC部分基因扩增结果与预期大小相符,测序结果证实为ARVσC基因。
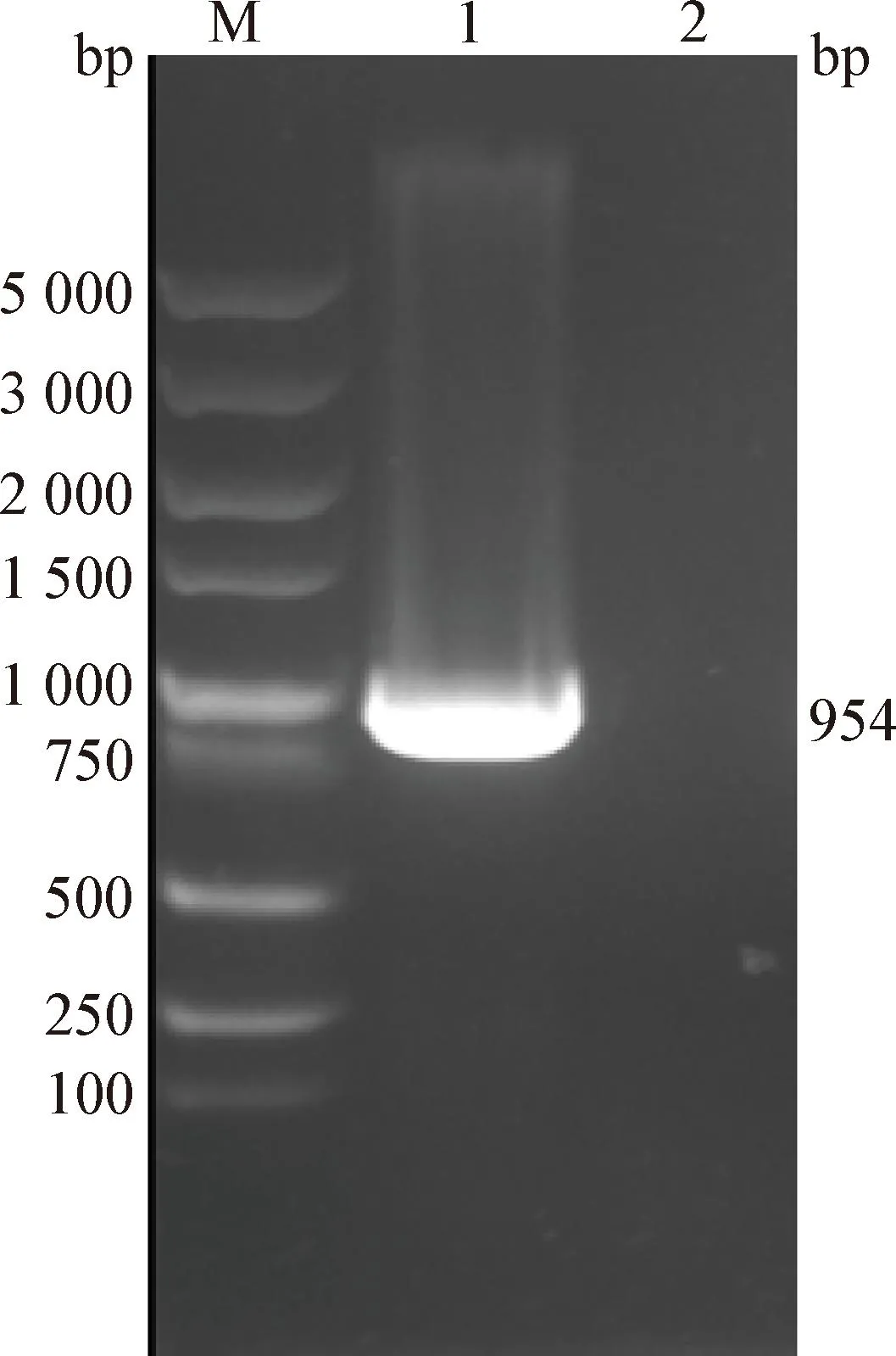
图4 ARV-JSJD-2020 σC基因片段的PCR扩增
2.8σC基因序列分析 将ARV-JSJD-2020与GenBank上参考毒株进行比对,分析σC基因遗传进化差异,结果如图5和图6所示,ARV-JSJD-2020与GenBank上参考毒株的核苷酸同源性为38.5%~98.7%,氨基酸同源性为28.0%~98.1%。ARV-JSJD-2020与水禽源ARV的核苷酸同源性为49.6%~98.7%,而与鸡源ARV的核苷酸同源性只有38.5%~41.6%。ARV-JSJD-2020与水禽源ARV的氨基酸同源性为38.2%~98.1%,而与鸡源ARV的氨基酸同源性仅为28.0%~31.1%。为了进一步分析ARV-JSJD-2020与其他毒株在遗传进化上的关系,建立遗传进化树,结果如图7所示,通过对σC基因进行基因分析,可将ARV划分成2个大群(GI和GII),GI群属于水禽源ARV,GII群属于鸡源ARV,分离得到的ARV-JSJD-2020属于GI群,即为水禽源ARV。其中S1133、减毒S1133和1733均为疫苗株,但它们均为鸡源ARV,与ARV-JSJD-2020属于不同分支,亲缘性较远。番鸭呼肠孤病毒CA是市售的弱毒活疫苗株,与ARV-JSJD-2020虽然同属水禽源ARV,但亲缘关系较远。GI群水禽源ARV又可以分为2个亚群,ARV-JSJD-2020、YY10G和03G这3株鹅源呼肠孤病毒与鸭源呼肠孤病毒属同一亚群,而在匈牙利分离得到的D34-99和D20-99、在法国分离得到的89330以及在我国分离得到的GRV-GD2020这4株鹅源呼肠孤病毒与番鸭源呼肠孤病毒属同一亚群。

图5 σC基因核苷酸序列同源性比对

图6 σC基因氨基酸序列同源性比对
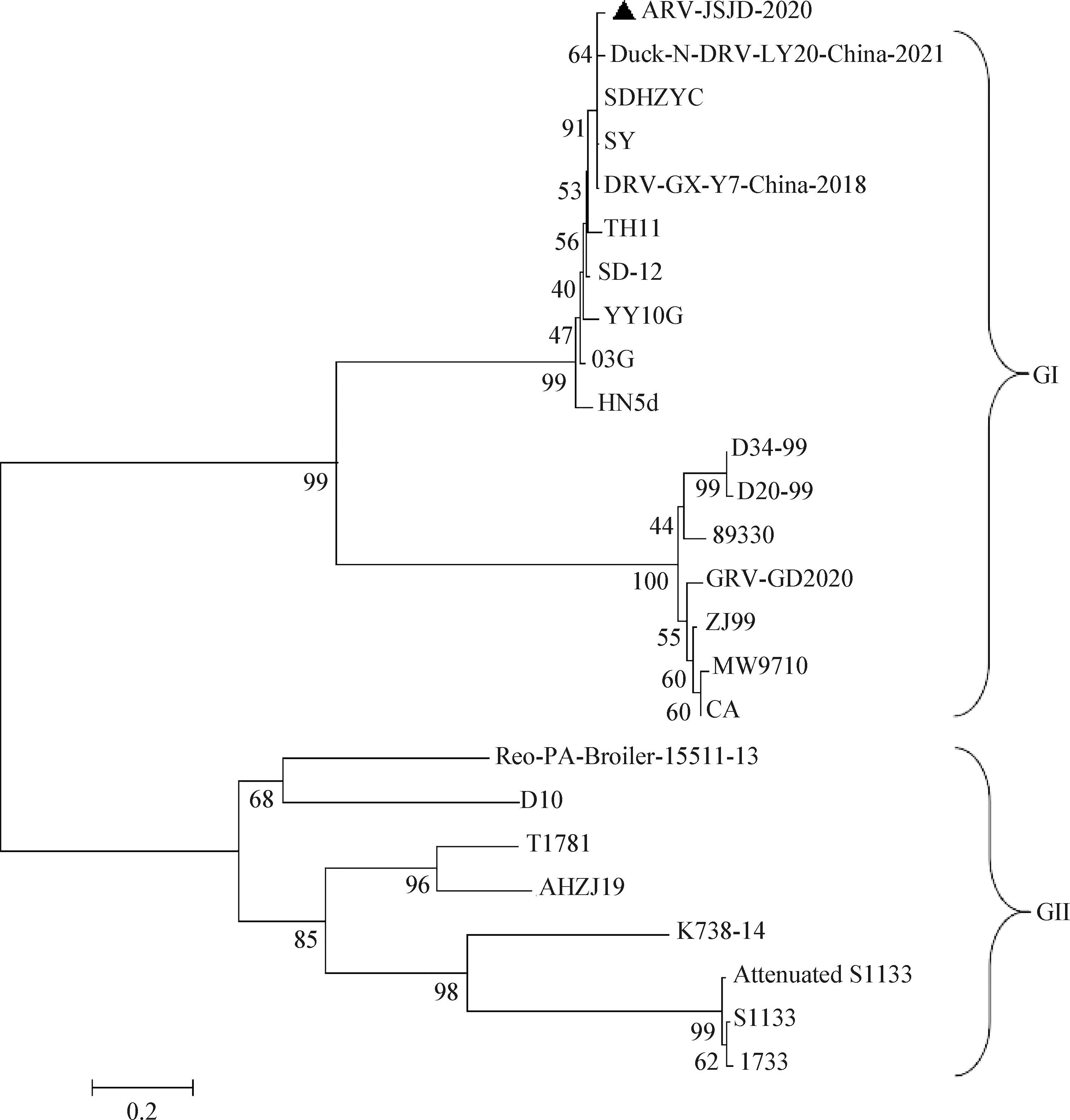
图7 σC基因的遗传进化树
3 讨论
ARV感染在世界各地均有发生,美洲[12]、欧洲[13]、亚洲[14]、非洲[15]和大洋洲[16]这五大洲无一例外,在肉鸡、蛋鸡、火鸡、鸭、鹅、鸽子、鹦鹉和野生鸟类等上均检测分离到ARV,ARV影响范围波及全世界的各种禽类物种。自20世纪80年代中期以来,我国已有多个省市发现本病,严重影响了养禽业的发展。1985年,王锡堃等[17]发现了我国第1例鸡病毒性关节炎病例;2001年,吴宝成等[18]从患病番鸭中分离出7株呼肠孤病毒株,是我国首次分离出的鸭呼肠孤病毒(Duck reovirus,DRV)毒株;2002年,王光锋等[19]首次从表现为出血性坏死的病鹅肝脏中分离得到鹅呼肠孤病毒(Goose reovirus,GRV)毒株。近年来,ARV表现出较高的遗传多样性且其致病性呈上升趋势[20],出现了不断多样化的临床疾病形式,表明ARV的影响越来越大,给养禽业造成了严重的损失。
本试验从江苏省扬州市江都区某鹅场进行采样,通过组织病料PCR检测、鸡胚分离、细胞培养等方法分离得到1株鹅源ARV,将该分离株命名为ARV-JSJD-2020。ARV-JSJD-2020造成的临床病变与其他毒株相似,肝脏组织病理学表现与波兰鹅群中分离得到的GRV类似[21],但其鸡胚致死率和雏鹅发病情况相对于其他毒株较高且致死时间较快,并且对成年鹅有致死性,有可能是1株变异型强毒株。
ARV感染造成的家禽饲养业的重大经济损失,强调了对新出现的ARV分离株进行患病率、遗传特征和致病性进化等研究的重要性[22]。王丹等[23]对ARV所有基因节段构建遗传进化树进行分析,发现除了M2基因外,鸡源毒株和水禽源毒株分别形成2个独立的分支。本试验对分离株ARV-JSJD-2020的σC基因进行测序分析,并与GenBank中其他ARV毒株进行同源性和遗传进化分析,结果显示,ARV-JSJD-2020属于水禽源分支。而目前广泛使用的灭活疫苗毒株S1133和1733以及减毒活疫苗毒株减毒S1133[24]均属于鸡源ARV,与水禽源ARV不属于同一分支。番鸭呼肠孤病毒毒株CA是已经市售的弱毒活疫苗,与ARV-JSJD-2020虽然同属水禽源ARV,但亲缘关系较远。根据基因进化树可以发现,从鹅源分离得到的ARV,部分与鸭呼肠孤病毒属同一亚群,而另一部分与番鸭呼肠孤同属另一亚群,2个亚群之间亲缘性不高,这给防治水禽ARV带来了巨大的挑战。本试验分离得到的ARV-JSJD-2020可以为后续鹅源ARV的防控和疫苗的研发提供参考依据。
