桦褐孔菌提取物对阿托伐他汀致小鼠肝损伤的保护作用
2024-03-13李建宽李青山
李 毅,李建宽,杨 红,李青山,
(1. 山西中医药大学中药与食品工程学院,基于炎性反应的重大疾病创新药物山西省重点实验室,山西 晋中 030619;2. 山西医科大学药学院,山西 晋中 030619)
肝脏作为人体最大的代谢器官,具有合成、解毒、代谢和免疫等功能,在发生损伤时可能会引起肝脏组织异常、代谢紊乱,甚至中毒。药物性肝损伤(Drug-induced liver injury,DILI)是指药物本身和/或其代谢产物导致的肝脏损伤,通常表现为肝细胞坏死、血清转氨酶升高、胆汁淤积以及各种类型的肝炎等[1],也是临床上最为常见的急性肝衰竭的主要诱因[2]。目前,药物性肝损伤产生的机制依旧不确切,可能与肝细胞线粒体受损、氧化应激水平失衡、内质网应激过强或代谢酶和转运蛋白功能异常等有关[3]。药物性肝损伤的产生机制不明确与药物自身因素也有联系[4],不同药物导致DILI的原因往往不同,作用机制和损伤类型也多种多样。他汀类药物是3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methyl-glutaryl coenzyme A,HMG-CoA)还原酶抑制剂,可以抑制人体内低密度脂蛋白(Low density lipoprotein,LDL)和胆固醇的产生,从而起到降低胆固醇的作用。阿托伐他汀(Atorvastatin,ATO)作为临床一线降脂药物,研究发现,长期或过量使用阿托伐他汀可能会引发肝毒性[5-6]、横纹肌溶解[7]和肌病[8]等。其中,阿托伐他汀引起的肝脏损伤[9-10]最为常见,主要与降低线粒体膜电位,造成线粒体损伤,影响机体氧化应激水平和细胞凋亡等有关[11]。临床中经常会发生患者由于担心发生肝损伤而停药或不规则用药导致的治疗失败,所以寻找能够有效拮抗他汀类药物所致肝损伤的药物具有重要临床意义。
桦褐孔菌[Inonotusobiquus(Fr.) Pilat]为多孔菌科褐卧孔菌属真菌桦褐孔菌的干燥子实体[12],有益气养阴、消痈散结和活血祛瘀之功效。桦褐孔菌具有抗炎[13]、抗肿瘤[14]、抗氧化[15-16]和提高机体免疫力[17]等活性。目前已有研究显示,桦褐孔菌能够通过加速自由基清除、减少脂质过氧化和增强机体抗氧化等特性,对抗结核药物导致的药物性肝损伤[18]、急性酒精性肝损伤[19]和非酒精性脂肪肝[20]等肝损伤产生保护作用。然而,桦褐孔菌是否能够对阿托伐他汀致小鼠药物性肝损伤发挥保护作用罕见报道。因此,本试验以阿托伐他汀所致的小鼠药物性肝损伤为模型,研究桦褐孔菌提取物(Inonotusobiquusextract,IOE)对其引起的药物性肝损伤的保护作用及机制,为临床预防和治疗DILI提供一定的参考价值。
1 材料与方法
1.1 试验材料
1.1.1 实验动物 SPF级雄性昆明系小鼠48只,体质量(20±2)g,购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019—0010。实验动物饲养于温度和湿度恒定,光照明暗各12 h的清洁级动物房内,自由进食和饮水。本试验操作过程严格遵守实验动物伦理标准,并经山西中医药大学动物实验伦理委员会批准(AWE20221205)。
1.1.2 药品 桦褐孔菌(批号:20210723),购自大兴安岭森源山产品有限公司,由山西医科大学李建宽副教授鉴定为担子菌亚门、多孔菌科桦褐孔菌;双环醇片(批号:211116),购自北京协和药厂;阿托伐他汀(批号:MB1021,纯度99%),购自大连美仑生物技术有限公司;羧甲基纤维素钠(Carboxymethylcellulose sodium,CMC-Na)(批号:20210302),购自天津市北辰方正试剂厂。试验时桦褐孔菌提取物、双环醇和ATO用0.5% CMC-Na水溶液配制成所需浓度药液。
1.1.3 主要试剂 谷草转氨酶(Aspartate aminotransferase,AST,C009-2-1)、谷丙转氨酶(Alanine aminotransferase,ALT,C009-2-1)、碱性磷酸酶(Alkaline phosphatase,ALP,A059-2)、过氧化氢酶(Catalase,CAT,A007-1-1)、超氧化物歧化酶(Superoxide dismutase,SOD,A001-3)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px,A005-1)和丙二醛(Malondialdehyde,MDA,A003-10)检测试剂盒,均购自南京建成生物工程研究所;肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α,F2132-A)、白细胞介素-1β(Interleukin-1β,IL-1β,F2040-A)和白细胞介素-6(Interleukin-6,IL-6,F2163-A)检测试剂盒,均购自上海泛柯实业有限公司;B细胞淋巴瘤因子相关蛋白X(B-cell lymphoma-2 associated protein X,Bax,#3498)、B细胞淋巴瘤因子(B-cell lymphoma-2,Bcl-2,#2772)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK,9252)、磷酸化c-Jun氨基末端激酶(Phosphorylated c-Jun N-terminal kinase,p-JNK,#4668)、丝裂原活化蛋白激酶(Mitogen-activated protein kinase,p38,#8690)和磷酸化丝裂原活化蛋白激酶(Phosphorylated mitogen-activated protein kinase,p-p38,#4511)抗体,均购自美国Cell Signaling Technology公司;其他试剂均为国产分析纯。
1.1.4 主要仪器 Scientz-N型真空冷冻干燥机,购自宁波新芝生物科技有限公司;RE-3000A型旋转蒸发仪,购自上海亚荣生化仪器厂;SpectraMax i3x多功能酶标仪,购自美谷分子仪器(上海)有限公司;JB-L5包埋机,购自武汉俊杰电子有限公司;Histocore BIOCUT切片机,购自上海徕卡仪器有限公司;Eclipse Ti2倒置荧光显微镜,购自尼康仪器(上海)有限公司;PowerPacTMBasic型电泳仪和Trans-Blot®SD Cell型蛋白转膜仪,均购自美国Bio-Rad公司;Imager600全自动化学发光成像系统,购自美国通用电气公司。
1.2 试验方法
1.2.1 桦褐孔菌提取物的制备 取桦褐孔菌干燥子实体的粗粉,按照料液比1∶4加入蒸馏水进行回流提取,共3次,每次1.5 h,合并3次提取液,过滤后使用旋转蒸发仪浓缩至原体积的1/4。加乙醇至含乙醇体积分数为80%,静置过夜,抽滤;收集沉淀物,用水溶解后过滤,滤液经真空冷冻干燥机冷冻干燥后得IOE。
1.2.2 动物分组、造模和给药 48只小鼠适应性喂养1周后,随机分为对照组、模型组[100 mg/(kg·bw) ATO]、IOE低剂量组[100 mg/(kg·bw)]、IOE中剂量组[200 mg/(kg·bw)]、IOE高剂量组[400 mg/(kg·bw)]和双环醇组[200 mg/(kg·bw)],每组8只。采用边造模边给药的方法,每日下午6:00除对照组外其余各组按照100 mg/(kg·bw)的剂量灌胃ATO建立DILI模型;于次日早晨7:30 IOE各剂量组和双环醇组灌胃相应药液,对照组和模型组灌胃等体积0.5% CMC-Na溶液。给药体积为10 mL/(kg·bw),连续给药2个月。以试验小鼠血清ALT、AST和ALP水平均显著性升高作为建模成功的标准。
1.2.3 标本采集 在最后1次灌胃给药结束后,各组小鼠禁食不禁水12 h后摘眼球取血,于4 ℃、3 000 r/min离心15 min,分离血清,用于肝功能指标(ALT、AST和ALP)和炎性指标(TNF-α、IL-1β和IL-6)检测。采血后颈椎脱臼处死小鼠,剖腹取出肝脏组织,用4 ℃生理盐水冲去血渍,用滤纸吸干表面水分后称量记录肝脏质量。将小鼠肝脏组织切割分为3份,1份置于4%多聚甲醛固定液中固定,用于小鼠肝脏组织的组织病理学观察;1份装入冻存管并置于液氮中,用于检测小鼠肝脏组织蛋白表达水平;1份装入冻存管并置于液氮中,用于检测肝脏组织氧化应激指标(MDA、SOD、CAT和GSH-Px)。
1.2.4 小鼠肝脏指数测定 根据公式(1)计算小鼠肝脏指数。

(1)
式中A1为小鼠肝脏质量(g),A2为小鼠体质量(g)。
1.2.5 小鼠肝功能指标检测 采用比色法检测小鼠血清中ALT、AST和ALP水平,均严格按照试剂盒说明书进行操作。
1.2.6 肝脏组织氧化应激指标检测 精确称取0.1 g肝脏组织,加入0.9 mL于4 ℃预冷的生理盐水,用匀浆机将肝脏组织匀浆。然后将肝脏组织匀浆液置于低温离心机中,4 ℃、4 000 r/min离心10 min,取上清液,按照试剂盒说明书测定肝脏组织中SOD、CAT和GSH-Px活性以及MDA含量。
1.2.7 小鼠血清中炎症指标检测 使用ELISA试剂盒测定小鼠血清中TNF-α、IL-1β和IL-6水平,均严格按照试剂盒说明书进行操作。
1.2.8 肝脏组织病理学观察 取固定液中的小鼠肝脏组织,常规石蜡包埋、切片、苏木素-伊红(Hematoxylin-eosin,H.E.)染色,光学显微镜下观察肝脏组织病理学变化。
1.2.9 Western blot检查肝脏组织中JNK、p-JNK、p38、p-p38、Bax和Bcl-2的蛋白表达水平 称取小鼠肝脏组织约50 mg,加入含1%蛋白酶抑制剂的放射免疫沉淀试验(Radio immunoprecipitation assay,RIPA)裂解缓冲液1 mL,于冰上充分裂解,4 ℃、12 000 r/min离心15 min,取上清液,二喹啉甲酸(Bicinchoninic acid,BCA)法测定蛋白浓度,加入5×蛋白上样缓冲液,水浴使蛋白变性;依次进行 SDS-PAGE电泳、转膜、封闭和含吐温20的 Tris 缓冲盐水(Tris buffered saline with tween-20,TBST)漂洗后加入目的蛋白一抗,4 ℃孵育过夜。TBST漂洗先除去未结合一抗后,加入二抗室温孵育2 h,TBST漂洗,进行增强化学发光(Enhanced chemiluminescence,ECL)显影成像。
1.3 统计学方法 试验数据用“平均值±标准差”表示,采用Microsoft Excel和GraphPad Prism 9.0软件,计量资料两组间数据比较采用t检验,多组间数据比较采用方差分析(Analysis of variance,ANOVA),以P<0.01 表示差异极显著,P<0.05表示差异显著,P>0.05 表示差异不显著。
2 结果
2.1 IOE对小鼠肝脏指数的影响 结果如表1所示,与对照组相比,模型组肝脏指数极显著升高(P<0.01),增长约30.68%,表明长期服用高剂量阿托伐他汀造成了小鼠肝脏肿大。与模型组相比,IOE低、中、高剂量组小鼠肝脏指数分别减小19.78%、19.35%和20.22%,均极显著降低(P<0.01),双环醇组小鼠肝脏指数也显著降低(P<0.05),减小了10.65%。即IOE各剂量组和双环醇组小鼠肝脏组织肿胀程度都得到不同程度的改善,特别是IOE各剂量组均能极显著抑制肝脏异常增大。
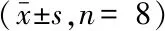
表1 IOE对阿托伐他汀致药物性肝损伤小鼠肝脏指数的影响
2.2 IOE对小鼠肝功能指标的影响 结果如表2所示,与对照组比较,模型组小鼠血清中的ALT、AST和ALP水平均极显著升高(P<0.01),平均值分别升至(24.36±4.32)、(17.38±2.85)和(16.50±3.84) U/L,表明药物性肝损伤小鼠模型建立成功。与模型组相比,IOE低、中和高剂量组ALT水平均极显著降低(P<0.01),平均值分别为(12.86±2.01)、(10.52±1.49)和(10.21±1.80) U/L,并且呈现一定的剂量依赖关系;IOE高剂量组不仅能够极显著抑制AST水平的升高(P<0.01),也能显著降低ALP水平的升高(P<0.05)。
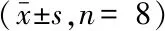
表2 IOE对阿托伐他汀致药物性肝损伤小鼠肝功能指标的影响
2.3 IOE对小鼠肝脏组织氧化应激指标的影响 结果如表3所示,与对照组相比,模型组小鼠肝脏组织中MDA含量极显著升高(P<0.01),已达到(11.39±1.03)nmol/mgprot;SOD、CAT和GSH-Px活性分别为(48.15±10.46)、(22.03±3.23)和(487.41±41.64)U/mgprot,均极显著降低(P<0.01),表明模型组小鼠体内氧化应激水平显著升高。与模型组相比,IOE中和高剂量组小鼠肝脏组织中MDA含量显著减少(P<0.05),分别为(10.03±1.06)和(9.85±1.14)U/mgprot;且SOD活性极显著升高(P<0.01),分别为(72.79±6.12)和(98.64±7.45)U/mgprot;IOE各剂量组CAT和GSH-Px活性均有不同程度地提高,特别是IOE高剂量组CAT和GSH-Px活性均极显著提高(P<0.01)。结果表明,IOE对ATO致小鼠药物性肝损伤的保护作用可能与其参与调节氧化应激有关。
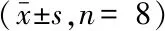
表3 IOE对阿托伐他汀致药物性肝损伤小鼠肝脏组织MDA含量以及SOD、CAT和GSH-Px活性的影响
2.4 IOE对小鼠血清中炎症指标的影响 结果如表4所示,与对照组相比,模型组小鼠TNF-α、IL-1β和IL-6水平均极显著升高(P<0.01),分别升至(381.67±26.69)、(49.21±10.53)和(170.54±30.13)pg/mL。与模型组相比,IOE低、中和高剂量组小鼠血清中TNF-α和IL-6水平均显著降低(P<0.05或P<0.01),且呈剂量依赖关系;IOE中和高剂量组小鼠血清中IL-1β水平均显著降低(P<0.05或P<0.01)。结果表明,IOE对ATO致小鼠肝损伤的保护作用可能与其抑制炎症反应有关。
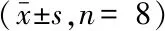
表4 IOE对阿托伐他汀致药物性肝损伤小鼠血清中TNF-α、IL-1β和IL-6水平的影响
2.5 IOE对小鼠肝脏组织病理学的影响 小鼠肝脏切片的组织病理学观察结果如图1所示,对照组小鼠肝小叶结构正常,中央静脉清晰,肝细胞正常,细胞质保存完好,细胞核突出,细胞核位于中央(图1A);模型组小鼠肝小叶中心坏死,肝细胞大小不一致,出现以中央静脉为中心的肝细胞变性、坏死或细胞核异位,可见炎性细胞浸润和片状坏死(图1B),提示模型建立成功;IOE低、中和高剂量组和双环醇组细胞坏死程度明显减轻,炎性细胞浸润得到改善(图1C~F),肝细胞排列较规律。结果表明,IOE对ATO致小鼠肝损伤的保护作用可能与减轻炎性细胞浸润、缓解肝脏组织损伤有关。
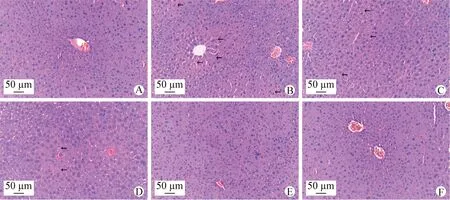
图1 IOE对阿托伐他汀致药物性肝损伤小鼠肝脏组织病理学的影响(H.E.染色,200×)
2.6 IOE对小鼠肝脏组织中JNK、p-JNK、p38、p-p38、Bax和Bcl-2蛋白表达水平的影响 结果如图2所示,与对照组比较,模型组小鼠肝脏组织中JNK磷酸化相对表达水平极显著升高(P<0.01);与模型组比较,IOE中和高剂量组小鼠JNK磷酸化相对表达水平极显著降低(P<0.01)。与对照组比较,模型组小鼠p38磷酸化相对表达水平极显著升高(P<0.01);与模型组相比较,IOE高剂量组小鼠p38磷酸化相对表达水平极显著降低(P<0.01)。结果表明,IOE能够抑制ATO所致小鼠肝脏组织中JNK和p38磷酸化水平的升高。

图2 IOE对阿托伐他汀致药物性肝损伤小鼠肝脏组织中JNK和p38蛋白磷酸化以及Bax和Bcl-2蛋白表达水平的影响
与对照组比较,模型组小鼠Bax相对表达水平极显著升高(P<0.01);与模型组相比,IOE低、中和高剂量组小鼠Bax相对表达水平均有不同程度的降低,各组之间呈剂量依赖关系,并且IOE中和高剂量组均能极显著抑制Bax相对表达水平(P<0.01)。各组小鼠Bcl-2相对表达水平均无显著差异(P>0.05)。结果表明,ATO可能增加小鼠肝脏组织中Bax蛋白表达水平而诱导肝细胞凋亡,而IOE能够抑制ATO诱导的肝脏组织中Bax蛋白表达水平的升高,阻止细胞凋亡而发挥保护肝脏的作用。
3 讨论
当肝脏发生药物性损伤时,肝脏的代谢功能会受到影响,导致相关代谢物种类和含量改变,从而引起人体代谢水平、氧化应激水平和免疫反应等发生改变。研究发现,长期使用阿托伐他汀会引起诸多不良反应[11,21],其中以肝损伤[22]较为常见,其主要表现为体内转氨酶水平升高,甚至可引起药物性自身免疫性肝炎[23]。近年来,以ATO作为诱导剂制备肝损伤动物模型的相关文献越来越多[10,24],使用天然药物及其有效成分预防或治疗药物性肝损伤的报道也越来越多[9,21,25]。桦褐孔菌作为一种药用真菌,其主要成分包括多糖、芳香类化合物、萜类化合物、甾体以及少量的生物碱和木质素类化合物[26-27]。研究表明,桦褐孔菌对多种类型的肝损伤都有保护作用[18-20]。因此,本试验通过建立ATO导致的小鼠肝损伤模型,研究桦褐孔菌提取物对长期使用ATO导致的肝损伤产生的保护作用及其作用机制。
ALT、AST和ALP是常见的反映肝损伤的生化标志物[28]。当肝细胞受损时,细胞膜通透性改变,ALT、AST和ALP释放进入血液,导致血清中三者水平升高。本试验结果显示,经过IOE治疗,IOE低、中和高剂量组小鼠血清中转氨酶ALT和AST水平均能够得到明显抑制,这与崔涛等[29]使用桦褐孔菌治疗环磷酰胺中毒小鼠时观察到的转氨酶变化情况一致。同时,本试验病理切片结果也显示,经IOE治疗小鼠的肝脏组织病理损伤程度有显著好转。以上结果说明,IOE对ATO造成的肝损伤有一定保护作用,能够抑制肝损伤时伴随的转氨酶水平升高。
线粒体氧化应激是导致药物性肝损伤发生和发展的重要因素[30-31]。线粒体氧化应激通常伴随氧自由基的产生和脂质过氧化,机体对脂质过氧化的防御主要是通过提高抗氧化酶SOD、CAT和GSH-Px等的活性,以保证其清除活性氧的能力,阻止自由基链锁反应。本试验结果显示,与对照组对比,模型组小鼠体内SOD、CAT和GSH-Px活性皆显著下降,且MDA含量显著增多,说明ATO可引起小鼠体内氧化应激水平升高而造成肝脏组织损伤,这与Heeba等[25]研究生姜与ATO合用预防其肝毒性中得到的结论一致。本试验中,与模型组小鼠相比,不同剂量IOE对3种抗氧化酶的活性都有不同程度的增强作用,且均能降低MDA的生成,其中以IOE高剂量组效果最佳。钟秀宏等[18]在研究桦褐孔菌提取物对抗结核药异烟肼和利福平导致的小鼠药物性肝损伤的保护作用中也证实,桦褐孔菌发挥保护肝脏作用可能与其抗氧化作用有关。
炎症反应是药物性肝损伤的易感因素,会加重肝损伤的发展进程。据报道,阿托伐他汀诱导的药物性肝损伤的发展过程中也有炎症反应的产生[11,32],抑制炎症因子的释放将有助于该类型药物性肝损伤的治疗。TNF-α是重要的促炎因子和免疫调节因子,既能加重炎症反应程度也能刺激免疫细胞吞噬能力增强[33]。IL-6作为一种促炎因子,和其激活的下游因子IL-1β均能引起肝脏发生炎症,并且两者与血清转氨酶水平的升高有关[34]。在本试验中,IOE能够显著抑制ATO诱导的肝损伤小鼠TNF-α、IL-1β和IL-6水平升高,这与王思霁[20]研究发现桦褐孔菌多糖能够抑制非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)小鼠肝脏炎症因子TNF-α、IL-6和IFN-γ水平升高的结果相同,表明IOE对ATO诱导的肝损伤出现的炎症反应有一定的抑制作用。
丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)在肝脏代谢疾病的发生和发展过程中具有重要意义[35-37]。一方面,JNK和p38在维持肝脏代谢功能中发挥重要作用。JNK能够通过维持肝细胞糖异生、增强胰岛素敏感性和调控脂肪代谢来调节葡萄糖代谢和能量稳态[36]。p38能够通过调节JAK-STAT信号通路、减少中性粒细胞浸润和减少活性氧积累等方式维持肝脏正常代谢功能,预防多种肝病(NAFLD、肝纤维化,甚至是肝癌)的发生[38-40]。另一方面,受到生长因子、细胞因子、药物和紫外线(Ultraviolet,UV)等多种因素的影响,JNK和p38的磷酸化常常引起肝脏代谢紊乱和肝脏损伤。JNK通过磷酸化激活后与线粒体外膜层Sh3bp5或Sab相互作用而介导肝毒性,导致膜间Scr磷酸化,从而造成线粒体呼吸受损和ROS释放增强,最终导致肝细胞损伤[41]。越来越多的研究显示,抑制JNK和p38的磷酸化可能是治疗肝脏疾病发生和发展的重要靶点[42-43]。在本试验中也证明了这一观点,IOE高剂量组能够明显地抑制肝脏组织中JNK和p38的磷酸化以及p-JNK和p-p38蛋白表达,从而起到保护肝脏的作用。此外,JNK的激活也会影响Bax激活和易位,使其从细胞质转移到线粒体,这种易位往往会导致线粒体膜损坏,影响线粒体呼吸和功能异常[30]。在本试验中,模型组小鼠肝脏组织JNK磷酸化升高的同时,Bax蛋白表达也显著升高,IOE中、高剂量组都能显著降低小鼠Bax蛋白的表达,说明IOE能通过抑制JNK和p38的磷酸化以及Bax的表达而起到拮抗ATO致药物性肝损伤的作用。
综上所述,本试验通过研究IOE对阿托伐他汀所致药物性肝损伤小鼠的保护作用,发现其发挥保护肝脏作用可能与抑制氧化应激、抑制炎症反应和调控MAPK信号通路有关,这为桦褐孔菌的开发和利用提供了参考依据。
