14种喀斯特地区植物药提取物的体外抗氧化活性比较*
2024-03-13邹健邓婕王道平吴昌学曾晓晓向洁冉龙艳肖霄喻彦龙官志忠
邹健, 邓婕, 王道平, 吴昌学, 曾晓晓, 向洁, 冉龙艳, 肖霄,喻彦龙, 官志忠, ***
(1.贵州医科大学 病理学教研室,贵州 贵阳,550004;2. 贵州医科大学 地方病与少数民族疾病教育部重点实验室,贵州 贵阳,550004;3.贵州省医学分子生物学重点实验室,贵州 贵阳,550004;4.贵州省中国科学院天然产物化学重点实验室,贵州 贵阳,550014)
喀斯特地区植物药基于独特的地理环境、气候因素和土壤因素等,通过单一或相互作用影响着药用植物的品质和疗效,具有鲜明的地域性和民族特性[1];其含有的生物碱、黄酮类、皂苷、挥发油等有其独特的药理作用,对某些疾病的治疗具有显著优势[2-3],在抗氧化、抗炎、改善微血管内皮炎症损伤、抗白血病等方面有重要作用[4-5],其活性成分在抗氧化方面具有疗效好、副作用少的优点。氧化应激与慢性氟中毒[6]、糖尿病[7]、高血压[8]及肝纤维化[9]等疾病的发病机制密切相关,故抗氧化成为了治疗的重要手段。但目前对药物的抗氧化能力的评价没有科学、有效的手段。以往的研究中,往往用单一抗氧化指标来评价药用植物的抗氧化能力[10],或者虽然多种抗氧化指标评价,但没有将各抗氧化指标联系起来[11],这样往往无法准确反映药物的实际抗氧化能力。为解决这一情况,本研究选用了14种喀斯特地区具有经济和生态保护价值、且推广应用度较高的优势植物药品种。构建了体外抗氧化测定体系[12-15],分别检测这些植物药提取物的抗氧化能力,并且引入模糊数学中的隶属函数分析法[16-17]的概念对植物药和维生素C进行抗氧化能力的综合评价并排序,筛选出具有抗氧化价值的药物,为后续的体内药物干预提供理论支持及指导作用,同时促进喀斯特地区特色药用资源的开发利用,也为氧化应激相关疾病的药物开发提供支撑。
1 材料与方法
1.1 实验材料
1.1.1植物药提取物来源 选用14种植物药(表1),仙桃草、锦茵陈、瓜子金、凉粉柴、响铃草的供试部位为地上全株,吴茱萸、皂角、薏苡仁、菟丝子的供试部位为成熟果实,一朵云的供试部位为全株,玉竹、锁阳、天冬、黄精的供试部位为块茎,通过75%乙醇提取分别获得这些药物的提取物(由贵州省中国科学院天然产物化学重点实验室提供)。以上植物药有效成分提取方法:药材阴干,粉碎成大小约1 mm的粗粉,称取约5 g,每次加10倍量75%乙醇溶液回流提取1.5 h,过滤待用。重复3次,合并提取液,减压浓缩,蒸干乙醇,真空干燥得供试品。

表1 喀斯特地区植物药的中、英文及拉丁文药名Tab.1 Chinese, English, and Latin names of phytomedicines in Karst areas
1.1.2主要试剂和仪器 羟自由基清除能力检测试剂盒(Micro Hydroxyl Free Radical Scavenging Capacity Assay Kit,货号BCBC1325,中国SOLARBIO公司)、维生素C(ascorbic acid,货号A8100,中国SOLARBIO公司)、大豆卵磷脂(L-α-Lecithin,货号L8050,中国SOLARBIO公司)、2,2-联苯基-1-苦基肼基(2,2-Diphenyl-1-picrylhydrazyl,货号D807279-100 mg,中国MACKLIN公司)、铁氰化钾[potassium hexacyanoferrate(3-) ,货号13746-66-2,中国天津致远化学试剂有限公司],上述化学试剂均为分析纯。所使用的主要仪器有Varioskan LUX多功能微孔读数仪(Thermo Fisher公司,美国)、VCX750超声破碎仪(Sonics公司,美国)、Exceed-AC-08型超纯水仪(艾科公司,中国)、5424R型制冷微量高速离心机(Eppendorf公司,德国)。
1.2 研究方法
1.2.1喀斯特地区植物药提取物的制备 取适量的14种植物药提取物,分别加入去离子水制备成10 g/L的药物混合液。将植物药混合液经超声充分混匀后,使用无菌针头过滤器过滤,将得到的滤过液加入去离子水分别稀释成不同浓度(0、0.05、0.1、2.5、5及10 g/L)[18-19]备用。
1.2.2清除羟自由基能力的测定 羟自由基可以使组织中的糖类、氨基酸、蛋白质、核酸等物质发生氧化,遭受氧化性损伤和破坏,羟自由基清除能力是样本抗氧化能力的重要指标之一。将实验分为空白组、阳性对照组(维生素C)及实验组,其中实验组药物浓度分别为0、0.05、0.1、2.5、5及10 g/L,实验过程遵照羟自由基清除能力检测试剂盒说明书操作。样品混匀后37 ℃孵育60 min,10 000 r/min常温离心10 min,取200 μL上清液于96 孔板中536 nm处测定其吸光度。空白管、对照管和测定管的吸光值分别记为A空、A对及A实。羟自由基清除率D(%)=(A实-A对)/(A空-A对)×100%。每组试验重复3次,取平均值并求标准差[12]。
1.2.3清除2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基能力测定 称取4 mg DPPH,用无水乙醇100 mL配制成0.04 g/L的DPPH乙醇溶液。实验分为空白组、阳性对照组(维生素C)及实验组,其中实验组浓度分别为0、0.05、0.1、2.5、5及10 g/L的待测药物溶液500 μL,再加入DPPH 500 μL,充分混匀,室温反应30 min后,取200 μL混合液于96 孔板内测其在517 nm处的吸光度。实验组和阳性对照组的吸光值分别记为Ao和As(无水乙醇代替待测液)。DPPH自由基清除率=(Ao-As)/Ao×100%。每组试验重复3次,取平均值并求标准差[13]。
1.2.4铁氰化钾还原能力测定 以维生素C为阳性对照,分别取0、0.05、0.1、2.5、5及10 g/L的待测药物溶液200 μL于试管中,随后加入PBS 500 μL,以保证溶液反应的PH环境。再加入质量分数为10%的铁氰化钾溶液500 μL,摇匀后于50 ℃水浴中反应20 min。冰水中快速冷却后,加入质量分数为10%三氯乙酸500 μL,反应完全后,4 000 r/min常温离心10 min。取上清液500 μL,依次加入去离子水500 μL和0.1%三氯化铁(FeCl3)溶液100 μL,充分混匀后静置10 min,取200 μL混合液于96孔板于700 nm处测定吸光值。每组试验重复3次,取平均值并求标准差[14]。药物中的抗氧化活性成分能使Fe3+还原成Fe2+,Fe2+进一步和FeCl3反应生成在700 nm处有最大吸收的蓝色沉淀,通过测定吸光度值可间接评价抗氧化剂的还原能力。所测药物的还原能力越强,测得的吸光度值越大。
1.2.5抑制脂质过氧化能力测定 称取30 mg大豆卵磷脂(LLS)溶于30 mL pH7.4的10 mmol/L的磷酸盐缓冲液,经超声充分混匀后,冰水浴保存备用。将三氟乙酸(TFA)15 g、硫代巴比妥酸(TBA)0.375 g和浓盐酸2.1 mL依次溶于100 mL去离子水,配制得TFA-TBA-HCl混合液。依次向试管中加入LLS溶液200 μL, 0.4 mol/L硫酸亚铁200 μL和浓度分别为0、0.05、0.1、2.5、5及10 g/L的待测药物溶液200 μL,混匀后37 ℃水浴避光反应60 min。随后加入TFA-TBA-HCl混合液400 μL,于90~100 ℃水中反应15 min,冰水浴中迅速冷却,终止反应。将混合液4 000 r/min离心10 min,取上清液200 μL于96孔板在532 nm处测定吸光值。每组试验重复3次,取平均值并求标准差[14]。大豆卵磷脂可通过一系列反应后能生成粉红色染料,抗氧化物与脂质过氧自由基反应从而抑制脂质过氧化的过程,表现为染料减少,吸光度值降低。即物质的抗氧化能力越强,测得的吸光度值越小。
1.3 统计学方法
采用Excel 2010和GraPhpad Prism 8软件进行数据的统计分析,再利用隶属函数法对14种喀斯特植物药进行体外抗氧化能力的综合评价及筛选。隶属函数值计算公式:R (Xi)=(Xi-Xmin)/(Xmax-Xmin)。式子中Xi为某药物的某一指标的测定值,Xmax为所有品种该指标测定值中的最大值,Xmin为所有药物该指标测量值中的最小值,若某一指标与药物浓度呈负相关,则可通过反隶属函数公式计算其抗氧化能力的隶属函数值。
2 结果
2.1 喀斯特地区植物药清除羟自由基能力测定
对14种喀斯特地区植物药进行清除羟自由基能力进行检测,其中有统计意义的结果如图1所示,在0~10 g/L药物浓度,锦茵陈、天冬、凉粉柴及瓜子金的药物浓度与羟自由基清除率之间存在量效关系,除仙桃草和瓜子金外其余样品都随着浓度的增大,清除率逐渐增大。仙桃草和瓜子金在0.05 g/L时已达最大清除率,提示低浓度的仙桃草和瓜子金有较强的抗氧化能力,且能预测半抑制浓度(IC50)值小于凉粉柴,但瓜子金的羟自由基清除率随着浓度增加而下降。以上药物表现出了较强的羟自由基清除能力,且优于阳性对照组,其余药物羟自由基清除率较低且弱于对照组。多种受测植物药对羟自由基的清除能力强弱顺序为仙桃草、瓜子金>凉粉柴>天冬>锦茵陈>维生素C>其余药物(除仙桃草、瓜子金及其他药物外,IC50依次为0.298、2.248、2.741、7.232 g/L)。

图1 14种喀斯特地区植物药、维生素C对羟自由基的清除率Fig.1 Hydroxyl radical scavenging rates of 14 Karst-area phytomedicines and Vitamin C
2.2 喀斯特地区植物药清除DPPH自由基
对14种喀斯特地区植物药进行清除DPPH自由基能力检测,其中有统计意义的结果如图2所示,所测药物均表现出DPPH自由基清除活性,随着浓度的增加,清除能力增强。在0~10 g/L药物浓度范围内,DPPH自由基清除能力稍逊或与对照组相当。多种受测植物药对DPPH自由基的清除能力强弱顺序为维生素C>锁阳>吴茱萸>响铃草>皂角>薏苡仁>仙桃草>其余药物(除其他药物外,IC50依次为0.222、0.224、0.226、0.687、0.919、1.183、1.999 g/L)。

图2 14种喀斯特地区植物药、维生素C对DPPH自由基的清除率Fig.2 DPPH radical scavenging rates of 14 Karst-area phytomedicines and Vitamin C
2.3 喀斯特地区植物药的还原能力
对14种喀斯特地区植物药进行还原能力检测,其中有统计意义的结果如图3所示,所测药物均具有一定的还原能力,在0~10 g/L药物浓度范围内,与羟自由基清除率之间存在量效关系。随着药物浓度的增加其在700 nm处的吸光度也逐渐增加,即还原能力增强。吴茱萸、仙桃草、锁阳、锦茵陈及菟丝子的还原能力比阳性对照组强,响铃草和皂角的还原能力与阳性对照组相近,其余植物药的还原能力弱于阳性对照组。

图3 14种喀斯特地区植物药、维生素C的还原能力Fig.3 Reducing ability of 14 Karst-area phytomedicines and Vitamin C
2.4 喀斯特地区植物药抑制脂质过氧化的能力
14种喀斯特地区植物药进行抑制脂质过氧化能力检测,其中有统计意义的结果如图4所示,在0~10 g/L药物浓度范围内,所测药物均具有一定的抑制脂质过氧化的能力且优于阳性对照组。存在一定的量效关系,随着药物浓度的增加其抑制脂质过氧化的能力越强。多种受测植物药抑制脂质过氧化能力强弱顺序为凉粉柴>仙桃草>响铃草>吴茱萸>菟丝子>玉竹>瓜子金>天冬>维生系C>其他药物(除其他药物外,IC50依次为0.122、0.250、0.256、0.471、0.590、1.318、3.381、4.100、8.915 g/L)。

图4 14喀斯特地区植物药、维生素C对脂质过氧化的抑制率Fig.4 Inhibition activity on lipid peroxidation of 14 Karst-area phytomedicines and Vitamin C
2.5 隶属函数分析对喀斯特地区植物药抗氧化活性的综合评价
由表2可以看出14种植物药按隶属函数加权值大小排列分别为仙桃草>吴茱萸>维生素C>凉粉柴>响铃草>锁阳>天冬>皂角>瓜子金>薏苡仁>菟丝子>锦茵陈>黄精>一朵云>玉竹,反映了这些药物抗氧化能力的强弱顺序。这些药物中仙桃草和吴茱萸的加权值高于维生素C,展现出较强的抗氧化能力。
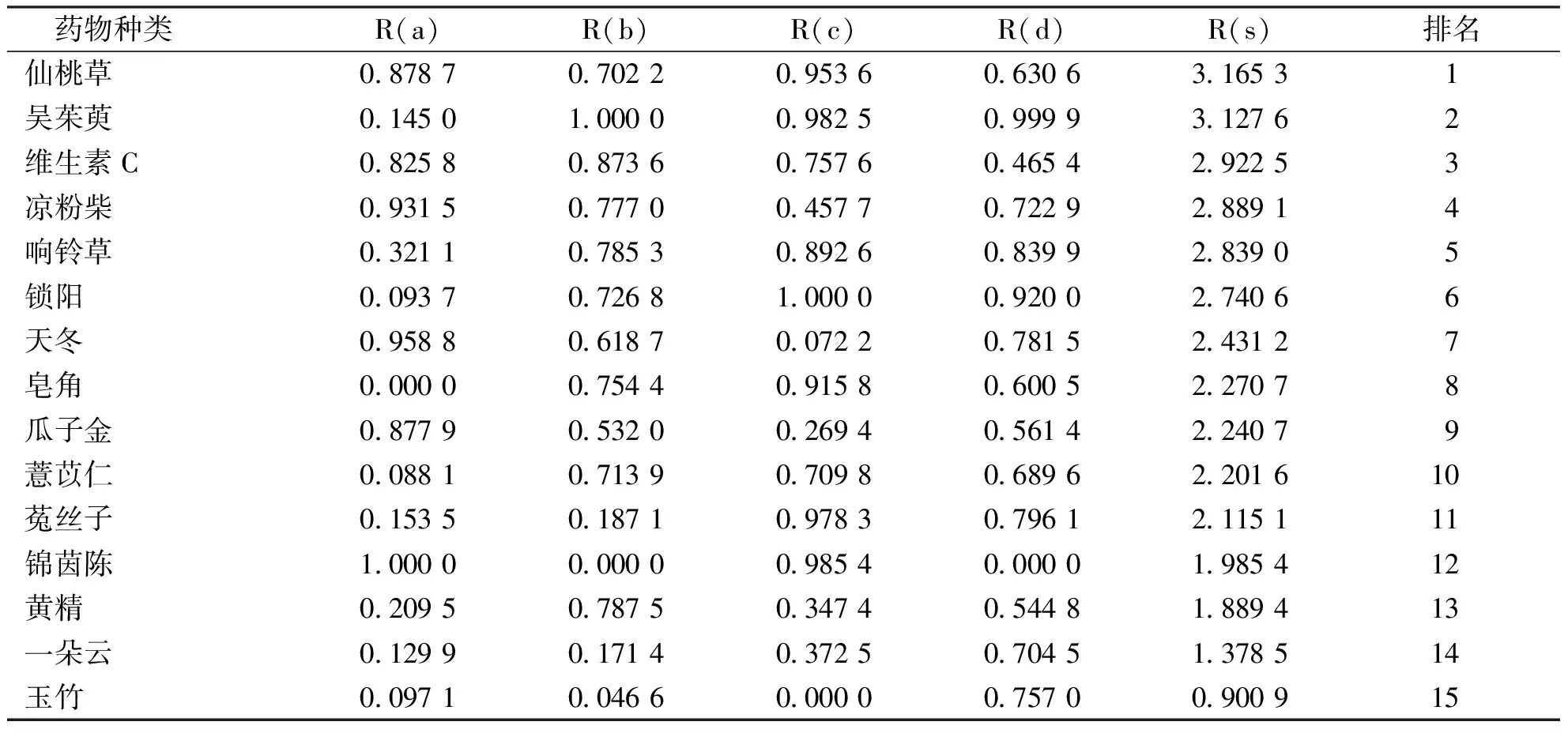
表2 14种植物药和维生素C的隶属函数值Tab.2 Membership function values of 14 Karst-area phytomedicines and Vitamin C
3 讨论
本研究对14种喀斯特地区优势植物药提取物进行了清除自由基、还原金属离子和抑制脂质过氧化等抗氧化能力的综合检测,结合隶属函数分析,对14植物药和维生素C的抗氧化能力强弱进行了综合客观的评价及排序。目前隶属函数多用于对农作物的抗逆性进行综合评价[16,20],鲜见用于植物药的抗氧化能力评价。引入隶属函数分析,提供了一条在多指标测定的基础上对药物抗氧化能力进行综合评价的途径,更具科学性和信服力。解决了单一指标或者多指标评价但无整体分析对比抗氧化能力的局限性,结果发现仙桃草的抗氧化能力最为显著。
仙桃草为玄参科植物蚊母草的带虫瘿的全草,其性味甘、苦,其主要含黄酮类和酚酸类成分[21-22],多用于外伤止血[23]、促进骨愈合[24],仙桃草中的活性物质具有抗癌作用[25-26]。但有关仙桃草抗氧化应激的文献报道较少,有学者从仙桃草中提取了8个环烯醚萜苷和4个酚类化合物,发现部分成分具有较强的抗氧化活性[27]。本实验亦证实了仙桃草具有较显著的抗氧化能力,此外天然抗氧化活性成分与合成的抗氧化剂相比,具有毒性小活性强等优点[28],具有极大的发掘潜力。
本研究处于对植物药提取物的抗氧化能力的初步研究阶段。植物药提取物是化合物,其成分繁杂,各组成成分之间的功效及抗氧化作用不甚清楚[29-30]。明确有效的抗氧化单体成分(如多酚类、维生素类、多糖类等)是极为必要的,不同的抗氧化成分之间可具有协同性,联合使用时能更好地增加疗效和降低成本[31]。后续可通过高通量分子筛选[32]等手段,从分子、细胞水平对仙桃草和吴茱萸等进行检测,以期发现抗氧化的新靶标或潜在的有效成分,最终用于以氧化应激升高为主要发病机制的疾病的干预治疗。综上所述,喀斯特地区植物药是我国医药的重要宝库,对其有效成分的研究应不仅仅局限于抗氧化功效,在抗炎、抗菌、抗肿瘤等方面可能有着巨大潜力,值得进一步深入研究。
