桑黄改善非酒精性脂肪肝的分子机制研究
2024-03-11刘静雨单秋丽何文兴陈安徽
刘静雨 曲 凡 单秋丽 何文兴 陈安徽
(1徐州工程学院食品与生物工程学院,江苏徐州 221028;2济南大学生物科学与技术学院,山东济南 250022)
桑黄(Sanghuang)是一种寄生于桑树树干处常年生真菌,名为桑黄属桑黄,是桑黄属成员。相关文献表明桑黄主要活性成分能够治疗糖尿病和肺炎,以及在减轻感染性休克、抗炎、抗氧化、抗肿瘤、降低血脂、预防和治疗自身免疫关节炎症等方面起着重要作用,其中三萜、多糖和黄酮类化合物是3种主要的药理活性化合物[1]。桑黄活性成分提取方法有醇提法和水提法,不同提取法所获得的活性成分种类及功能不同[2-3]。TAJI等[4]在1968年证实桑黄子实体水提物具有较强的生物活性,可用于抑制小鼠肉瘤细胞的生长。此外,SHIBATA等[5]证实桑黄子实体醇提物能够抑制肝癌细胞增殖的功能。并且近年来有大量关于桑黄药用功能的研究报道,进一步描述这种真菌的抗肿瘤和抗氧化特性[6-7]。
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种在没有过度饮酒的情况下,肝脏内脂肪积累过多为主要特征的临床病理综合征[8]。近几十年研究发现遗传、饮食和环境因素的相互作用是NAFLD发病的媒介[9]。NAFLD的发病进程可分为单纯性脂肪肝、非酒精性脂肪肝、非酒精性脂肪肝炎(non-alcoholic steatosis heptitis,NASH)以及肝硬化,最终严重危害人体生命健康[10]。近年的研究数据显示:目前,NAFLD的全球发病率约为25%[11],被认为是全球慢性肝病日益增长的重要原因,并已成为近年肝移植的主要原因之一[12];在中国,NAFLD的患病人数急剧增加到30%[13]。
NAFLD的发病通常伴随着各种代谢疾病的发生,如糖尿病和肥胖症。它被认为是肝脏代谢综合征的一种表现。Sanghuang Kangneng醇提物(ethanol Sanghuang Kangneng,ESK)主要提取Sanghuang Kangneng中多酚类和黄酮类化合物,前人研究显示,部分多酚类和黄酮类化合物可改善NAFLD,但是对于其改善NAFLD的分子机制尚不明确。人正常肝细胞系WRL68细胞是一类永生化肝细胞株,对生长环境的改变有比较高的灵敏度。笔者以WRL68细胞作为体外试验模型,研究ESK改善非酒精性脂肪肝的相关分子作用机制,为今后的研究提供理论基础。
1 材料与方法
1.1 试验材料
FFA,北京索莱宝科技有限公司;胎牛血清(FBS),北京赛默飞世尔科技有限公司;高糖DMEM培养基,北京赛默飞世尔科技有限公司;青霉素,北京索莱宝科技有限公司;链霉素,北京索莱宝科技有限公司;MTT试剂,北京索莱宝科技有限公司;油红O,上海和序生物科技有限公司;BCA蛋白浓度测定试剂盒,碧云天生物公司;甘油三酯(TG)测试盒,南京建成生物工程研究所;总胆固醇(TC)测试盒,南京建成生物工程研究所;Triton X-100,北京索莱宝科技有限公司;Trizol,南京诺唯赞生物科技有限公司;反转录试剂盒,南京诺唯赞生物科技有限公司;荧光定量PCR试剂盒,南京诺唯赞生物科技有限公司;无水乙醇,国药集团化学试剂有限公司;槲皮素,北京索莱宝科技有限公司;没食子酸,北京索莱宝科技有限公司;淫羊藿苷,北京索莱宝科技有限公司;芦丁,北京索莱宝科技有限公司;绿原酸,北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 ESK提取
桑黄产于江苏省,由徐州工程学院陈安徽鉴定并命名为Sanghuang Kangneng。称取Sanghuang Kangneng20 g,置50 ℃烘箱内烘至4 h,研磨过筛(孔径0.85 mm)。加入10倍体积的90%乙醇85 ℃索氏提取2 h。布氏漏斗过滤提取溶液,旋转蒸发仪55 ℃旋转蒸发五分之四溶液,浓缩液低温冷冻干燥成粉末(命名为ESK),所提取的ESK放置-20 ℃长期保存。
1.2.2 高效液相色谱分析
高效液相色谱分析ESK样品溶液的配置:准确称取ESK样品10 mg,将其溶解于1 mL甲醇(色谱级),10 000g离心20 min,配成样品储备液,过0.22 μM无菌滤膜过滤,收集液体部分。高效液相色谱分析标准溶液的配置:取槲皮素、没食子酸、咖啡酸、淫羊藿苷、芦丁、绿原酸标准品各10 mg,将其溶解于1 mL甲醇(色谱级),10 000g离心20 min,配成标准混合样品储备液,用0.22 μM无菌滤膜过滤。
色谱条件:色谱柱选择YMC-Pack ODS-AQ反相C18柱(250 mm×4.6 mm,5 μm),流动相由A、B两部分组成,A相:乙腈∶甲醇∶超纯水(体积比)=19∶5∶76(pH 3.0);B相:乙腈∶甲醇∶超纯水(体积比)=55∶15∶30(pH 3.0)。流速为1 mL/min,柱温为30 ℃,检测波长为256 nm;进样量为10 μL,梯度洗脱条件见表1。
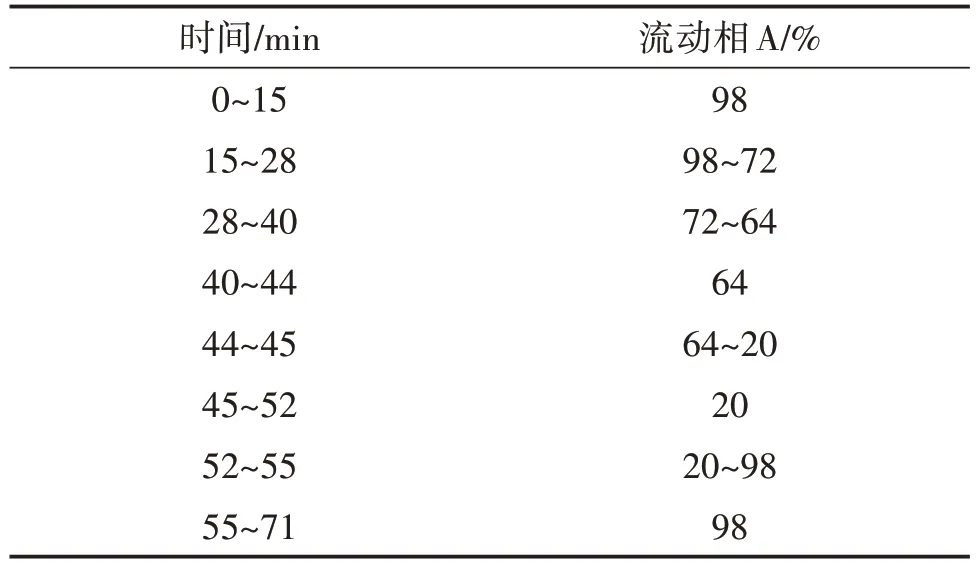
表1 梯度洗脱条件
1.2.3 细胞培养
人正常肝细胞(WRL68)购买于上海传秋生物科技有限公司(上海总部),在高糖DMEM培养基中培养,培养细胞时在培养基中加入10%的胎牛血清、100 mol/mL青霉素和100 mg/mL链霉素,将细胞放置于37 ℃和5% CO2的细胞恒温箱中进行体外培养。
1.2.4 细胞活力测定
使用MTT比色法检测细胞活力。收集并重悬细胞,控制细胞接种密度,将药物暴露24 h、48 h的细胞和药物暴露72 h的不同密度的细胞接种于96孔板中。质量浓度为5%CO2、37 ℃条件下培养过夜,待细胞贴孔底壁后对其进行不同质量浓度的药物暴露,分别按照100 μL/孔的暴露体积进行处理,随后将96孔板继续培养。药物处理结束后,将原加药物的培养基吸出,每孔加入100 μL新培养基和10 μL MTT溶液(5 mg/mL),混匀,37 ℃继续培养4 h。孵育结束后,将孔板内培养基弃去,每孔加150 μL DMSO,孔内形成的结晶物充分溶解后,再用酶标仪在490 nm处测量各孔的吸光值。
1.2.5 油红O染色
收集并重悬细胞,控制细胞接种密度,在24孔板里药物暴露24 h+72 h的细胞接种密度为1.6×105个/孔,质量浓度为5%CO2、37 ℃条件过夜培养,待细胞贴孔底壁进行暴露试验;暴露结束后,将24孔板里原加药物的培养基吸出,用PBS轻洗;每孔加入200 μL质量分数为4%的多聚甲醛,避光固定30 min后,用PBS轻洗;每孔快速滴加200 μL油红O工作液,避光染色20 min;每孔加适量质量分数为60%的异丙醇漂洗1 min,去掉浮色后用灭菌水漂洗至无色。镜下观察并成像。
1.2.6 细胞内总蛋白、TG和TC含量测定
将药物处理的细胞胰酶消化后分别收集于对应标记的EP管中,离心后弃上清;用灭菌PBS洗涤细胞沉淀2~3次,再次离心弃上清;每管中加入1%Triton X-100 30 μL,用旋涡振荡仪将细胞沉淀振荡开,冰上裂解细胞2 h,每隔30 min用旋涡振荡仪对细胞沉淀振荡使其充分裂解。吸取上裂解液,按照试剂盒说明书测定细胞内TG、TC以及总蛋白的含量。
1.2.7 实时荧光定量PCR
使用Trizol法提取各组细胞的mRNA,并按照反转录试剂盒的方法进行反转录。根据表2反应条件进行实时荧光定量PCR,结果根据各组Ct值,使用2-△△Ct法计算目的基因与内参基因β-actin的相对表达量(基因相对表达量计算公式使用2-ΔΔCt:其中ΔCt为目的基因和内参基因Ct值差值)。所有引物信息如表3,以β-actin为内参标准化目的基因。
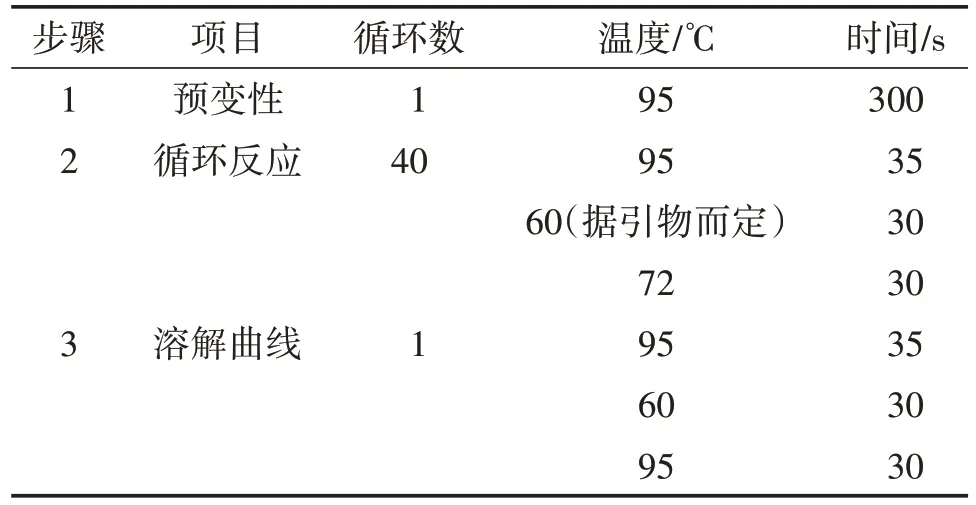
表2 实时荧光定量PCR反应条件

表3 WRL68 qRT-PCR引物
1.3 统计分析
数据使用GraphPad Prism7软件进行统计学分析和作图。样品重复孔数为3,数据结果表示为平均值±标准误。两个组之间的比较选择t检验,多组间比较选择双因素方差分析,*表示P≤0.05,**表示P≤0.01,***表示P≤0.001。
2 结果与分析
2.1 样品定性分析结果
通过对比标准品HPLC图谱(图1)可以推断出,ESK中含有槲皮素、没食子酸、咖啡酸、淫羊藿苷、芦丁、绿原酸物质。
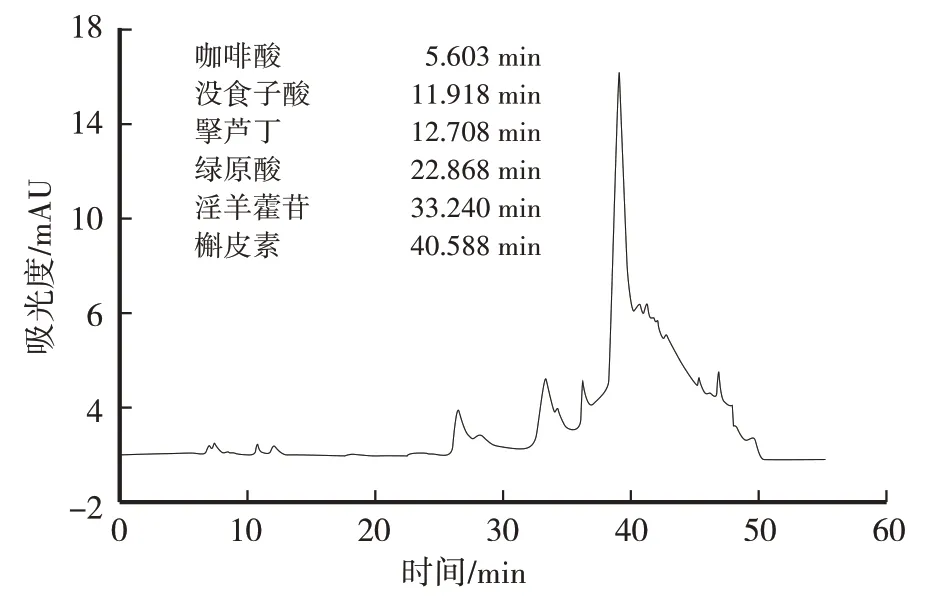
图1 HPLC定性分析结果
2.2 ESK对WRL68细胞活力和脂质代谢的影响
如图2所示,暴露于ESK24 h后,WRL 68细胞凋亡数目无明显增加,然而与对照相比,暴露于32 μg/mL、160 μg/mL、320 μg/mL的ESK48 h以及72 h细胞凋亡数目增加,160 μg/mL的ESK培养正常细胞72 h,细胞凋亡15%;相同处理时间320 μg/mL药物暴露细胞凋亡为对照的23%,均在药物处理细胞凋亡可接受范围内,因此选3.2 μg/mL、32 μg/mL、160 μg/mL以及320 μg/mL的ESK72 h处理。
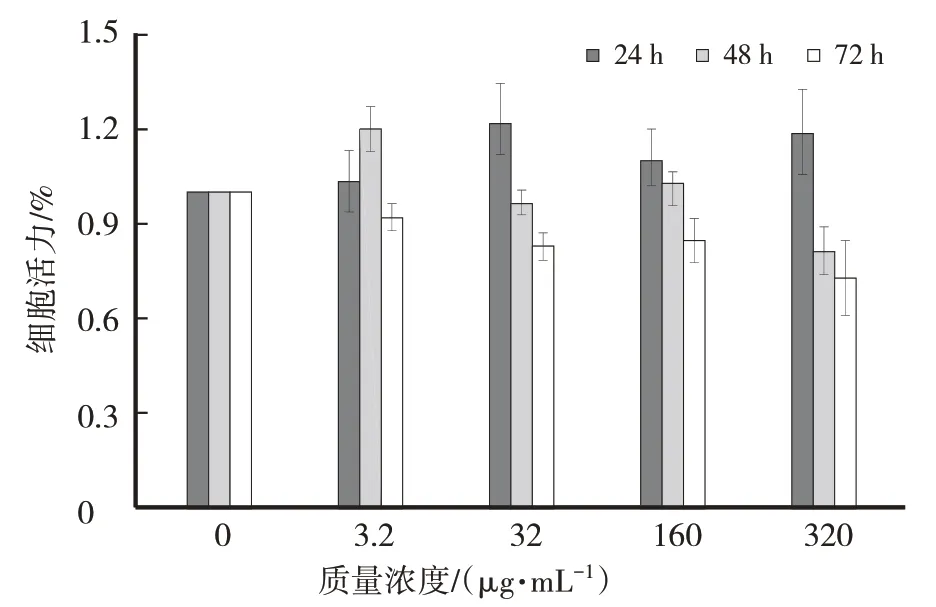
图2 ESK不同时间及质量浓度暴露对WRL68细胞活力的影响
如图3a所示,与高脂细胞未进行ESK处理的对照相比,ESK处理72 h后,高脂细胞内TG含量显著降低,并且随着ESK质量浓度的进一步增加,TG含量也逐渐降低。3.2 μg/mL的ESK暴露使得高脂WRL68细胞内TG含量显著减少37%(P<0.01),并且发现3.2 μg/mL的ESK不影响高脂细胞内TC水平,而用32 μg/mL和160 μg/mL的ESK暴露时,TC含量分别显著降低40%和35%(P<0.001,图3b)。然而,尽管320 μg/mL的ESK处理会显著降低高脂WRL68细胞内TC含量(降低22%,P<0.001),但相较于160 μg/mL的ESK处理,高脂细胞内TC水平却略有上升。此外,油红O染色结果显示:相比较于高脂细胞未进行ESK处理的对照,32 μg/mL和160 μg/mL的ESK处理能够显著降低WRL68细胞内脂滴(箭头)的形成(图4)。

图3 ESK对高脂细胞内脂质水平的影响

图4 不同质量浓度ESK对高脂WRL68细胞油红O染色影响
2.3 ESK对WRL68细胞脂质代谢相关基因表达的影响
为了初步阐明ESK减少高脂WRL68细胞内脂质含量的潜在机制,分别从脂质运输、脂质合成和脂质氧化方面来探讨ESK的作用机制。如图5a、5b所示,与高脂细胞未进行ESK处理的相比,320 μg/mL的ESK处理能够显著降低高脂细胞内参与脂质生成的Srebp-1c和Fas的表达,分别降低51%和39%(P<0.05)。此外,32 μg/mL的ESK处理还能显著下调参与脂质运输的关键基因如CD36(下调29%,P<0.05)的表达水平(图5c)。而脂质氧化相关基因PPARα表达没有变化(图5d)。

图5 ESK对高脂WRL68细胞脂质代谢相关基因表达的影响
3 小结
目前NAFLD是世界上常见的疾病之一,已成为研究热点,迫切需要治疗NAFLD新的药物。Sanghuang Kangneng是一种寄生于桑树树干处常年生真菌,其主要核心成分已知。以前的研究报道Sanghuang可以防止急性肝毒性和调节肝功能[14]。在目前的研究中,使用的FFA诱导模型,是一个被广泛接受的高脂肝细胞模型。笔者首次确定ESK在减轻高脂肝细胞内脂积累、治疗NAFLD发病机制中的作用。
TC和TG是机体发生高脂相关症状时常需检测的重要指标,当这两种生化指标异常时,初步认定检测的细胞或组织内部脂代谢异常。为了显示细胞内的脂肪含量常采用油红O进行细胞染色,因为油红O是一种脂溶性染料,在脂肪内能够高度溶解,因此其可特异性的使组织内TC等中性脂肪染为红色。ESK显著减少了高脂肝细胞内TC和TG含量,油红O染色图显示ESK显著减少了高脂肝细胞内中性脂肪含量,因此可初步判断ESK减少了高脂肝细胞内脂质积累。
利用WRL68细胞作为体外试验模型,通过设计不同的暴露剂量,考察ESK暴露对WRL68细胞的活力影响。在ESK处理FFA诱导的高脂细胞模型试验中,高脂WRL68细胞随ESK质量浓度增加,细胞内脂质蓄积显著降低。通过qRT-PCR技术发现,ESK暴露可显著影响高脂WRL68细胞内与脂质代谢相关基因的表达,其可能的模式有通过抑制细胞内SREBP-1c和Fas基因表达,抑制脂质合成,以及通过激活PPARα来促进肝细胞内脂肪酸氧化,这些可减缓NAFLD的第一发病阶段。
