一株野生硫黄鳞伞的分离纯化及菌丝培养条件优化
2024-03-11高恋恋王新童曾粮斌魏宝阳
高恋恋 王新童 张 浩 涂 镜 曾粮斌 魏宝阳*
(1湖南农业大学生物科学技术学院,湖南长沙 410128;2 沅江市芦小妹食品有限公司,湖南沅江 413100;3中国农业科学院麻类研究所,湖南长沙 410205)
硫黄鳞伞(Pholiota conissans)隶属于担子菌门(Basidiomycota)、蘑菇纲Agaricomycetes、蘑菇目(Agaricales)、球盖菇科(Strophariaceae)、鳞伞属(Pholiota),是一种食药兼用的小型真菌。鳞伞属分布广泛,全球约150种[1],国内已知的鳞伞属真菌有68种[2-4],如多脂鳞伞(P.adiposa)[5]、白鳞伞(P.destruens)[6]、翘鳞伞(P.squarrosa)[7]和柠檬鳞伞(P.limonella)[8]等,广泛分布我国27个省区[9],其中多数物种为木腐型真菌。鳞伞属真菌中富含多种营养物质和活性物质[10-11],具有抗癌、抗肿瘤和抗氧化等作用[12-13],因此,硫黄鳞伞是深受人们喜爱和青睐的“一条腿”保健食物。
笔者对采自湖南省沅江市天下第一芦苇荡的一株野生菌株进行分离、纯化及鉴定,最终确定其分类学地位;同时通过单因素试验探究其菌丝在固体培养基中的生长情况,以此了解硫黄鳞伞菌丝固体培养基培养条件。羊晨等[14]研究发现,附加基质可促进肺形侧耳菌丝体的生长并增强菌株抗木霉污染能力,因此,笔者在液体发酵培养基中分别添加5种附加基质粉末,探究附加基质对硫黄鳞伞液体菌丝生物量的影响,以期为硫黄鳞伞开发利用、液体发酵和活性物质的提取等提供理论指导和数据支撑。
1 材料与方法
1.1 供试材料
(1)供试菌株:野生菌株采自沅江市天下第一芦苇荡,由湖南农业大学生物科学技术学院实验室进行分离、纯化,该菌株由中国农业科学院麻类研究所保藏,编号为Y1。
(2)供试附加碳源基质:选用干燥无霉变的芦苇、稻草、木屑、玉米芯、麸皮等原料,粉碎,并过40目筛(孔径0.45 mm),取粉末干燥备用。
(3)供试培养基:①PDA培养基为马铃薯20%、葡萄糖2%、琼脂1.5%,pH自然,蒸馏水1 000 mL。②碳源培养基为碳源20 g、酵母粉2 g、蛋白胨2 g、磷酸二氢钾3 g、硫酸镁1.5 g、琼脂18 g,pH自然,水1 000 mL[15]。③氮源培养基为碳源20 g、氮源2 g、磷酸二氢钾3 g、硫酸镁1.5 g、琼脂18 g,水1 000 mL,pH自然。④基础发酵液体培养基为葡萄糖3%、酵母粉0.3%、磷酸二氢钾0.4%、硫酸镁0.2%、维生素B10.02%,加水定容至1 000 mL,pH自然。
1.2 试验方法
1.2.1 菌株的分离与纯化
用自来水冲洗幼嫩供试菌株子实体表面以及菌柄处的泥土,将其放入体积分数75%乙醇中浸泡5 min后取出,用无菌解剖刀自菌柄处切开少许,然后掰开子实体。在菌盖、菌盖与菌柄交界处切取米粒大小的菌肉,置于涂布100 μL质量浓度为50 mg/mL硫酸链霉素的PDA平板上,用封口膜封口后,于25 ℃生化恒温培养箱中暗培养,待菌丝块长至直径2~3 cm转接、纯化,获得纯种菌丝,置4 ℃冰箱保藏备用。
1.2.2 菌株形态学鉴定
观察野生菌株生长环境,子实体形态、大小、颜色,孢子形态,孢子印颜色,菌丝颜色以及菌柄着生方式等特征并拍照,结合《中国大型菌物资源图鉴》(李玉2015)进行形态学初步鉴定。
1.2.3 菌株分子鉴定
采用内源转录间隔(Internal Transcribed Spacer,ITS)鉴定法。菌丝体总DNA提取采用真菌DNA提取试剂盒。PCR扩增采用真菌ITS通用引物ITS1和ITS4[16],PCR反应体系为25 μL,每份体系包含12.5 μL 2×Es Taq MasterMix,ITS1和ITS4(100 μmol/L)各1 μL,1 μL DNA模板,9.5 μL ddH2O。PCR产物以1.5%琼脂糖凝胶电泳检测并测序,将获得的ITS序列输入NCBI中进行BLAST比对,选取与菌株Y1近缘关系不同的菌株ITS序列,利用MEGA 11软件构建系统发育树,进行同源性分析。
1.2.4 菌株活化
将贮存在4 ℃的硫黄鳞伞菌株取出,在超净工作台上将其接种于PDA培养基上,置25 ℃恒温箱中暗培养,备用。
1.2.5 固体培养基培养条件的优化
1.2.5.1 光照试验
挑取活化后的硫黄鳞伞直径为4 mm菌丝块接于PDA中,置光照气候箱中25 ℃培养7 d。通过调整包裹平板的遮光纸,设5个光照强度,分别为0 lx、500 lx、1 000 lx、1 500 lx、2 000 lx。每个处理5个重复。
1.2.5.2 温度试验
挑取4 mm活化后的硫黄鳞伞菌丝块接于PDA中,然后分别置19 ℃、22 ℃、25 ℃、28 ℃、31 ℃恒温培养箱中培养7 d。每个处理5个重复。
1.2.5.3 碳源试验
采用碳源培养基,分别添加碳源为葡萄糖、甘油、蔗糖、可溶性淀粉、乳糖,接种同1.2.5.2。然后置25 ℃恒温暗培养7 d。
1.2.5.4 氮源试验
采用氮源培养基,分别添加氮源为酵母粉、尿素、蛋白胨、硫酸铵、牛肉膏,接种、培养同1.2.5.3。
1.2.5.5 无机盐试验
采用最优碳源和氮源培养基,分别添加磷酸二氢钾、硫酸镁、氯化钠、硫酸钾,接种、培养同1.2.5.3。
1.2.5.6 pH试验
采用最优碳源、氮源、无机盐培养基,将其pH调至5、6、7、8、9,接种、培养同1.2.5.3。
1.2.6 附加基质对供试菌株液体菌丝生长影响
采用液体发酵培养基,分别添加0.3%的稻草、芦苇、木屑、玉米芯、麸皮5种附加基质,接种后,于25 ℃,180 r/min摇床培养7 d。以不添加附加基质处理为对照。
1.3 测定项目及方法
(1)菌落直径测定。观察并记录固体培养基中菌丝生长情况,采用十字交叉法测量菌落直径。
(2)菌丝生物量的测定。液体发酵结束后,将发酵液用无菌纱布过滤,所得沉淀物为硫黄鳞伞菌丝体与培养基混合物,将其烘干至恒重,即为培养基混合物与菌丝体干质量。称取等量的附加基质于配置好的液体培养基中,直接离心取沉淀烘干,即为培养基混合物干质量。两者之差即为发酵菌丝体生物量[mg/(100 mL)]。
1.4 数据分析
采用Excel 2021软件、Word 2021软件进行数据处理,PowerPoint 2021进行图片处理,IBM SPSS Statistics 26软件进行数据处理、差异显著性分析和方差分析。
2 结果与分析
2.1 菌株生态环境调查及形态学鉴定
供试野生菌株采自于湖南省沅江市天下第一芦苇荡(图1),子实体长于芦苇地中,属于腐生木腐菌,丛生,无菌环无菌托,体积较小,菌盖直径1~3 cm,呈伞形,菌盖浅黄褐至锈黄色,中间略凸起,表面较光滑有黏液。该菌菌柄中央生,中空圆柱状,略弯,长2~5 cm,直径为1.5~3.5 mm,菌柄的颜色为黄白色,比菌盖颜色略淡。该菌孢子印为褐色。初步认定该菌株隶属于担子菌门、蘑菇纲、蘑菇目、球盖菇科、鳞伞属,是一种可食用的大型真菌。该菌株经PDA纯化培养,菌丝长势洁白且浓密,菌落边缘整齐,质地松软、无色素产生(图1c)。菌株Y1的显微特征与吴芳等[17]探究的鳞伞特征一致。菌株Y1菌丝体为无色,有隔且隔间距不等,有锁状联合,可分叉出新的菌丝,孢子呈无色,椭圆形,表面无棱角,无凸起(图2)。

图1 菌株Y1的子实体及平板菌丝菌落

图2 显微镜下菌株Y1菌丝及孢子
2.2 野生菌株分子鉴定结果
基于ITS的系统发育树分析,经北京擎科生物科技有限公司测序,菌株Y1的序列为
CATTTGGGATGACTTGGTATGATTGTTGCTGGTCCTTTT GGGACATGTGCACATCTGCCATCTTTATATCTCCACCTGTGCA CACTTTGTAGGTCTGGAATAAGTATCTGGGGTAACTCAGTTGT TGGAATTGCTGCTGCAAAGTAGCTTTTCTTGTGATTCTAGATC TATGTTTTCATATACACCATAAAAATGTAACAGAATGTATTAA TGGGTGTTGTACCTATAAACTATATACAACTTTCAGCAACGGA TCTCTTGGCTCTCGCATCGATGAAGAACGCAGCGAAATGCGAT AAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTG AACGCACCTTGCGCTCCTTGGTATTCCGAGGAGCATGCCTGTT TGAGTGTCATTAAATTCTCAATCTTACCATCTTTTATTAGTTG GGAAAGAGTTGGATGTGGGGGGAAATTTTTGAAGGTTTTTCGA AGCCTTCTCCCCTGAAATGCATTAGCTGGATGCTCGCGCGGAC AGTCTATTGGTGTGATAATTATCTATGCCATTAGCTGACTGCC ATTAGTAGCTCTGCTTCTAACTGTCTTTGGACAATTTATGACA ATTTGACCTCAAATCAGGTAGGACTACCCGCTGAACTTAAGCA TATCAATAAAGCCGGAGGAACTTTT
经BLAST在线对比,该序列与Pholiota conissans的相似性为99.38%。使用MEGA 11软件将所下载序列与菌株Y1序列进行对比分析并构建系统发育树,结果如图3。该野生菌株Y1的ITS序列与硫黄鳞伞聚为一支,可以确定其为硫黄鳞伞。
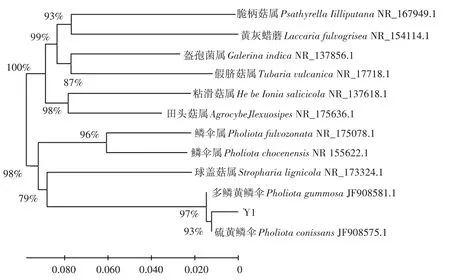
图3 基于ITS序列的菌株Y1系统发育树
2.3 固体培养基培养条件优化
2.3.1 光照强度对硫黄鳞伞Y1菌丝生长的影响
由表1可知,光照强度在0~2 000 lx硫黄鳞伞Y1菌丝均能生长,菌丝较为洁白,但不同光照强度菌落直径有所差异。无光照下菌落直径及菌丝长势明显优于其他处理,说明该硫黄鳞伞Y1在菌丝生长阶段不需要光照,过强的光照对菌丝的生长具有抑制作用(图4)。
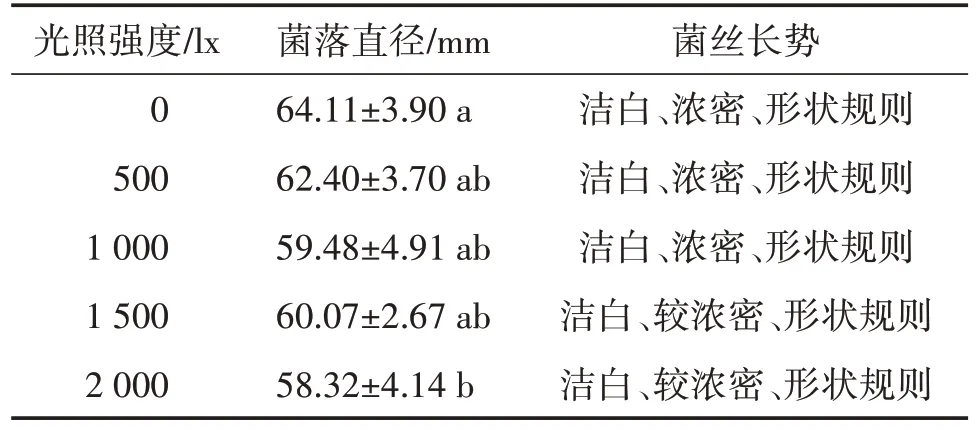
表1 光照强度对硫黄鳞伞Y1菌丝生长的影响

图4 不同光照强度下硫黄鳞伞Y1菌株菌落形态
2.3.2 培养温度对硫黄鳞伞Y1菌丝生长的影响
由表2可知,供试硫黄鳞伞菌株在19~31 ℃均可生长,19~28 ℃菌丝生长逐渐加快,31 ℃菌丝生长缓慢,25 ℃、28 ℃菌落直径明显大于其他处理,其中28 ℃菌落直径最大,但25 ℃的菌丝长势较28 ℃更为浓密且粗壮(图5)。

表2 温度对硫黄鳞伞Y1菌丝生长的影响
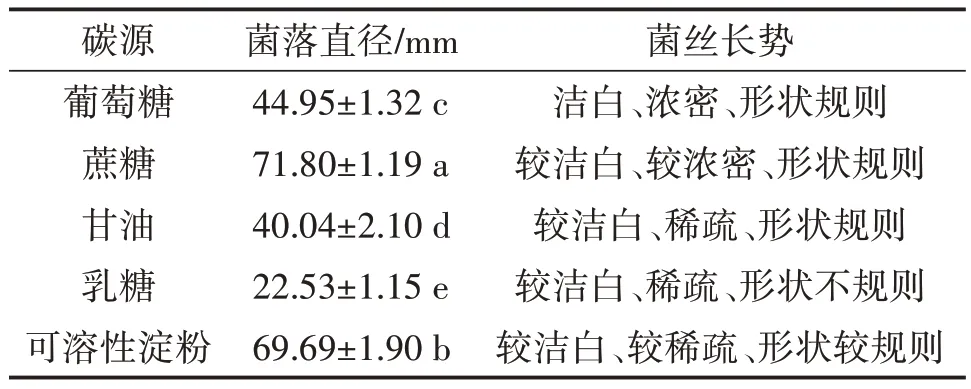
表3 不同碳源对硫黄鳞伞Y1菌丝生长的影响
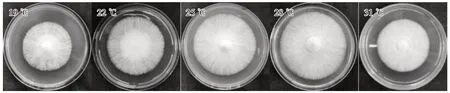
图5 不同温度下硫黄鳞伞Y1菌株菌落形态
2.3.3 不同碳源对硫黄鳞伞Y1菌丝生长的影响
由表4可知,供试硫黄鳞伞菌株在5种供试碳源培养基上均可生长,碳源为蔗糖培养基的菌落平均直径最大,显著大于甘油、葡萄糖、乳糖、可溶性淀粉培养基(图6),因此确定蔗糖为最适碳源。

表4 不同氮源对硫黄鳞伞Y1菌丝生长的影响

图6 不同碳源培养基上硫黄鳞伞Y1菌落形态
2.3.4 不同氮源对硫黄鳞伞Y1菌丝生长的影响
由表4可知,供试硫黄鳞伞菌株在除尿素以外的4种供试氮源培养基上均可生长。含蛋白胨培养基中菌落直径和菌丝长势明显优于其他氮源培养基(图7),因此蛋白胨为硫黄鳞伞Y1最适氮源。
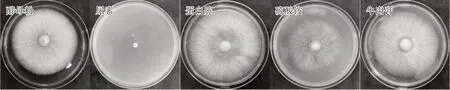
图7 不同氮源培养基上硫黄鳞伞Y1菌落形态
2.3.5 不同无机盐对硫黄鳞伞Y1菌丝生长的影响
由表5可知,供试硫黄鳞伞菌株在供试无机盐培养基上均可生长,氯化钠和硫酸钾培养基中硫黄鳞伞Y1的菌落直径明显小于硫酸镁培养基。磷酸二氢钾、硫酸镁培养基中硫黄鳞伞Y1的菌落直径无显著差异,但菌丝长势不同(图8)。
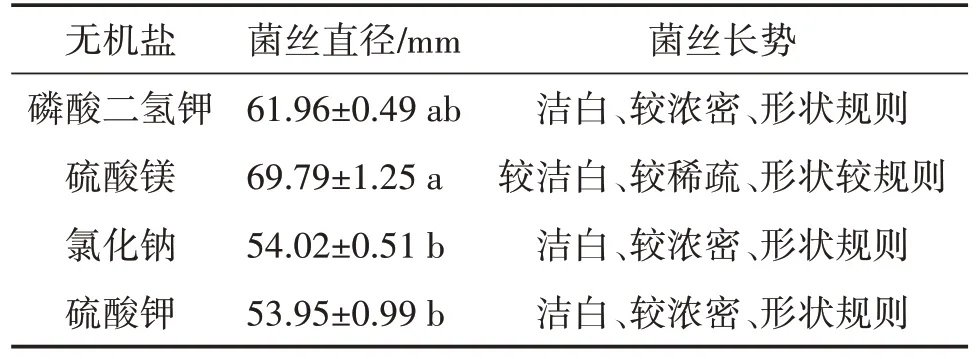
表5 不同无机盐对硫黄鳞伞Y1菌丝生长的影响
2.3.6 pH对硫黄鳞伞Y1菌丝生长的影响
由表6可知,硫黄鳞伞Y1在pH为9时,菌丝不萌发;在pH为5~8的培养基上均能生长,其中pH为5、6时菌落直径和菌丝长势明显优于其他处理(图9),因此pH 5~6为最适pH。

表6 不同pH下硫黄鳞伞Y1菌丝生长情况

图9 不同pH下硫黄鳞伞Y1菌落形态
2.4 不同附加基质对硫黄鳞伞Y1液体菌丝生物量的影响
由图10可知,CK与5种附加基质的发酵液均为黄色且澄清,菌丝均可形成新菌丝球,菌丝球形状不规则且呈黄色绒毛状,界限分明,各处理菌丝球大小差异显著(P<0.05)。其中麸皮、玉米和芦苇发酵液中菌丝球大小均一,稻草与木屑发酵液菌丝球不均一。与CK相比,麸皮、芦苇和玉米芯发酵液均能提升菌丝生物量,麸皮发酵液菌丝球密度相对较大,效果最优,菌丝生物量最大,为494 mg(/100 mL)(图11),而稻草和木屑对硫黄鳞伞Y1菌丝生长有抑制作用。各附加基质对硫黄鳞伞Y1菌丝生物量的影响为麸皮>芦苇>玉米芯>CK>稻草>木屑。

图10 添加附加基质后液体培养硫黄鳞伞Y1菌液形态

图11 添加附加基质后硫黄鳞伞Y1液体菌丝生物量
3 小结
研究通过结合形态学观察和ITS序列对Y1菌株进行分类鉴定,最终确定该野生菌株Y1为硫黄鳞伞(Pholiota conissans)。
硫黄鳞伞Y1菌丝在无光照条件下生长最佳,固体培养基培养最优条件为培养温度25 ℃,碳源为蔗糖,氮源为蛋白胨,pH 5,无机盐为磷酸二氢钾和硫酸镁。
液体发酵培养基添加0.3%的麸皮对硫黄鳞伞Y1菌丝生物量累积有一定的促进作用。试验结果为硫黄鳞伞Y1的开发利用提供理论指导和数据支撑。
