滋水清肝饮对慢性束缚应激抑郁小鼠海马ERK、GSK3β、CREB、BDNF 蛋白表达的影响
2024-03-10曹珊珊袁诗宇史磊磊张瑞华张雨涵韩朝军刘继平
曹珊珊,袁诗宇,史磊磊,张瑞华,张雨涵,石 勇,王 欣,韩朝军*,刘继平
(1.陕西中医药大学药学院,陕西 咸阳 712046; 2.陕西中医药大学第二附属医院,陕西 咸阳 712046)
重度抑郁症又称为抑郁障碍,现代医学认为其主要特征是持续的情绪或心境低落,常伴食欲不振、身体不适等各种躯体症状以及生理功能障碍等,属于精神类疾病,本病具有患病率高、复发率高、致残率高、疾病负担高的特点[1]。据世界卫生组织统计,重度抑郁症已成为世界第四大疾病,目前其临床治愈率仅为27%[2],已成为严重的医学与社会难题。
滋水清肝饮方源自 《医宗己任编·四明心法》[3],云“疏肝益肾汤,凡胃脘痛,大便秘结者,肝血虚也,此方主之,逍遥散所不能愈者,此方妙。柴胡、白芍、熟地、山药、萸肉、丹皮、茯苓、泽泻,加归身、枣仁、山栀,名滋肾清肝饮”,以其滋肾养阴、清泻肝火功效用于临床治疗抑郁、失眠等精神类疾病。研究发现,滋水清肝饮能有效降低抑郁患者汉密尔顿抑郁量表评分,抑制血清孤啡肽水平,进而提高机体内5-羟色胺(5-HT) 表达,改善抑郁症状[4],还能有效改善慢性肾衰竭伴发抑郁症患者的抑郁状况[5]。因此,本研究采用慢性束缚应激 (chronic restraint stress,CRS) 建立小鼠重度抑郁症模型,进一步研究滋水清肝饮防治抑郁症的作用和可能的机制。
1 材料
1.1 动物 60 只SPF 级C57BL 雄性小鼠,6 ~8周龄,体质量(20±2) g,购自成都达硕实验动物有限公司[实验动物生产许可证号SCXK (川)2020-030],饲养于陕西中医药大学中药药理实验动物房,垫料和饲料均购自成都达硕实验动物有限公司。动物实验经陕西中医药大学动物伦理委员会批准(伦理号SUCMDL20210310006)。
1.2 药物 滋水清肝饮组方药材(熟地黄10 g、山茱萸10 g、山药10 g、当归10 g、白芍10 g、牡丹皮10 g、茯苓10 g、泽泻10 g、栀子10 g、酸枣仁10 g、柴胡6 g) 均购自陕西中医药大学校医院,经陕西中医药大学药学院中药鉴定教研室颜永刚教授鉴定为正品,符合2020 年版《中国药典》 一部相关规定,饮片加10 倍量水浸泡40 min,武火煮沸后转文火慢煎1 h,趁热过滤,滤渣加8 倍量水,武火煮沸,文火慢煎40 min,合并滤液,常压80 ℃浓缩,即得高剂量滋水清肝饮(1.7 g/mL),稀释2 倍为中剂量,稀释4 倍为低剂量。滋水清肝饮总方106 g,按人与小鼠体表面积换算,等效剂量为17.670 g/kg,即中剂量,同时设定低、高剂量分别为8.835、35.340 g/kg。盐酸氟西汀(批号33323) 购自美国MedChemExpress 公司,每1 mg溶于2 mL 纯水中,给药剂量为10 mg/kg,现用现配。
1.3 试剂与仪器 小鼠5-HT 试剂盒 (批号20221020,上海酶联生物科技有限公司); 小鼠肿瘤坏死因子-α (TNF-α)、白介素-1β (IL-1β) 试剂盒(批号202209、202209,江苏酶免实业有限公司); 丙二醛 (MDA)、总超氧化物歧化酶(SOD) 试剂盒(批号20220831、20221213,南京建成生物工程研究所有限公司); ERK1/2、p-ERK、GSK-3β、p-GSK3β、GAPDH 抗体(批号00115457、00106696、00117935、00106696、10017731,美国Proteintech 公司); CREB 抗体(批号4000000113,武汉爱博泰克生物科技有限公司); 羊抗小鼠二抗、羊抗兔二抗、BDNF 抗体、超敏ECL 化学发光液(批号BA1050、BA1051、GB11559、AR1197,武汉博士德生物工程有限公司); RNAiso Plus、Oligo dT (50 μmol/L)、5 × M-MLV Buffer、dNTP (10 mmol/L)、RTase M-MLV (200 U/mL)、RTase inhibitor (40 U/mL)、TB Green Premix Ex Taq、50× ROX Reference Dye Ⅱ ( 批号 AL11814A、AL11594A、2641Q、AKE1955A、AK71336A、AKF1047A、AK90852A、SDO384,日本TaKaRa 公司)。酶标仪、多功能酶标仪 (美国BioTek 公司); 电泳仪(美国Bio-Rad 公司); PCR 仪(杭州博日科技股份有限公司); 荧光定量PCR 仪(美国Thermo Fisher Scientific 公司)。
2 方法
2.1 分组、造模及给药 小鼠适应性喂养7 d,空白组不作处理,造模组采用自制打孔离心管进行21 d 慢性束缚应激处理,即每天将小鼠禁锢于安静昏暗的环境6 h[6-7]。造模结束后,进行糖水偏好实验,以糖水偏好率小于75% 为造模成功标准[8]。将造模成功的小鼠随机分为模型组、盐酸氟西汀组(10 mg/kg) 和滋水清肝饮低、中、高剂量组(8.835、17.670、35.340 g/kg),每组10只,模型组和空白组灌胃生理盐水,各给药组灌胃相应剂量药液,容积0.4 mL/20 g,给药结束30 min 后除空白组外,其余小鼠继续进行CRS 处理。
2.2 行为学实验
2.2.1 糖水偏好实验 小鼠暴露于2 个完全相同的水瓶中,分别装有1%蔗糖水和饮用水,以排除小鼠对个别水瓶的偏好。第1 天适应24 h 后互换1%糖水、饮用水的水瓶位置,以避免小鼠在饮水期间形成特殊的位置偏好; 第2 天继续适应24 h;第3 天所有小鼠禁水禁食24 h,结束后进行2 h 的糖水偏好检测,检测前对1%糖水和自来水瓶分别称重,2 h 后取下2 瓶再次称重,计算糖水偏好率,公式为糖水偏好率= [糖水饮用量/(自来水饮用量+糖水饮用量)] ×100%。
2.2.2 悬尾实验 将小鼠倒挂在头部距离地面20 cm 高的装置上,记录6 min 内悬尾不动状态,当其表现为被动悬挂、没有任何肢体活动时可判定为不动,秒表计算后4 min 内累积不动时间。
2.2.3 强迫游泳实验 将小鼠放入高24.5 cm、直径16 cm 的高硼硅玻璃容器中,盛有20 cm 深的水,水温保持在(23±2)℃,视频记录6 min 内游泳状态,当其没有明显的游泳动作时被认为漂浮不动,秒表计算后4 min 内累积不动时间。
2.3 HE 染色观察海马组织病理形态变化 取固定24 h 以上的全脑组织,石蜡切片4 μm,脱水,脱蜡,苏木素染色3~5 min,自来水洗,返蓝,脱水,伊红染色5 min,脱水,透明,中性树胶封片,于显微镜下观察小鼠海马CA1 区细胞形态和数量变化。
2.4 血清生化指标检测 采用试剂盒检测小鼠血清SOD 活性和MDA 水平,ELISA 试剂盒检测血清5-HT、TNF-α、IL-1β 水平。
2.5 RT-qPCR 法检测海马组织BDNF、TNF-α、IL-1βmRNA 表达 采用氯仿提取法提取各组总RNA,核酸定量法检测浓度后逆转录为cDNA,随后进行PCR 扩增反应。反应体系(20 μL) 为TB Green Premix Ex Taq 10 μL、正反向引物 (10 μmol/L) 各0.4 μL、50×ROX Reference Dye Ⅱ0.4 μL、DNA 模板2 μL、RNase free H2O 6.8 μL,反应程序为95 ℃预变性30 s; 95 ℃5 s,60 ℃30 s,95 ℃5 s,60 ℃1 min,共40 个循环,定量PCR 特异产物通过熔解曲线分析,引物序列见表1。以GAPDH为内参,2-ΔΔCT法计算目的基因mRNA 相对表达。

表1 引物序列Tab.1 Primer sequences
2.6 Western blot 法检测海马组织ERK1/2、GSK-3β、CREB、BDNF 蛋白表达 取小鼠一侧海马组织,加入RIPA 裂解液、蛋白酶抑制剂和磷酸酶抑制剂,在低温冷冻研磨仪中充分研磨,4 ℃离心取上清液,BCA 法蛋白定量后取等量蛋白上样,通过SDS-PAGE 凝胶电泳分离,并转移至0.22 μm PVDF 膜上,TBST 清洗后在5% 脱脂牛奶中封闭2 h,分别加入一抗ERK1/2 (1 ∶1 000)、p-ERK1/2 (1 ∶3 000)、GSK3β (1 ∶4 000)、p-GSK3β(1 ∶3 000)、CREB (1 ∶ 1 000)、BDNF (1 ∶5 000)、GAPDH (1 ∶25 000),4 ℃孵育过夜,TBST 洗膜3 次,加入二抗室温孵育1 h,TBST 洗膜3 次,ECL 化学发光显影,利用Image J 软件计算目的蛋白相对表达量。
2.7 统计学分析 通过SPSS 26.0 软件进行处理,若符合正态分布,计量资料以(±s) 表示,多组间比较采用单因素方差分析,方差齐时组间比较采用LSD 法,方差不齐时组间比较采用Games-Howell 法; 若不符合正态分布,多组间比较采用非参数检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 滋水清肝饮对CRS 抑郁小鼠行为学的影响
3.1.1 糖水偏好率 与空白组比较,给药前模型组及各给药组糖水偏好率降低(P<0.01)。给药7 d后,与模型组比较,盐酸氟西汀组及滋水清肝饮中剂量组糖水偏好率升高(P<0.05),滋水清肝饮低、高剂量组糖水偏好率无明显变化 (P>0.05)。给药14 d 后,与模型组比较,各给药组糖水偏好率升高(P<0.05,P<0.01),见表2。
表2 滋水清肝饮对CRS 抑郁小鼠糖水偏好率的影响(±s,n=8)Tab.2 Effects of Zishui Qinggan Decoction on preference rate of sugar water in CRS depressed mice (±s,n=8)

表2 滋水清肝饮对CRS 抑郁小鼠糖水偏好率的影响(±s,n=8)Tab.2 Effects of Zishui Qinggan Decoction on preference rate of sugar water in CRS depressed mice (±s,n=8)
注: 与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别糖水偏好率/%给药前给药7 d 后给药14 d 后空白组88.27±2.7190.08±4.5689.78±6.14模型组54.03±13.87##51.06±17.77##46.77±14.94##盐酸氟西汀组52.34±15.20##71.87±8.85*83.22±12.16**滋水清肝饮低剂量组52.27±6.07##66.22±16.8781.50±7.88**滋水清肝饮中剂量组50.06±12.82##74.69±13.83*85.52±5.44**滋水清肝饮高剂量组54.11±10.90##68.55±17.8779.34±7.55*
3.1.2 悬尾实验不动时间 与空白组比较,模型组小鼠悬尾实验不动时间延长(P<0.01); 给药7、14 d 后,与模型组比较,盐酸氟西汀组及滋水清肝饮各剂量组小鼠悬尾实验不动时间缩短(P<0.05,P<0.01),见表3。
表3 滋水清肝饮对CRS 抑郁小鼠悬尾实验不动时间的影响(±s,n=8)Tab.3 Effects of Zishui Qinggan Decoction on immobilization time of tail suspension experiment in CRS depressed mice (±s,n=8)
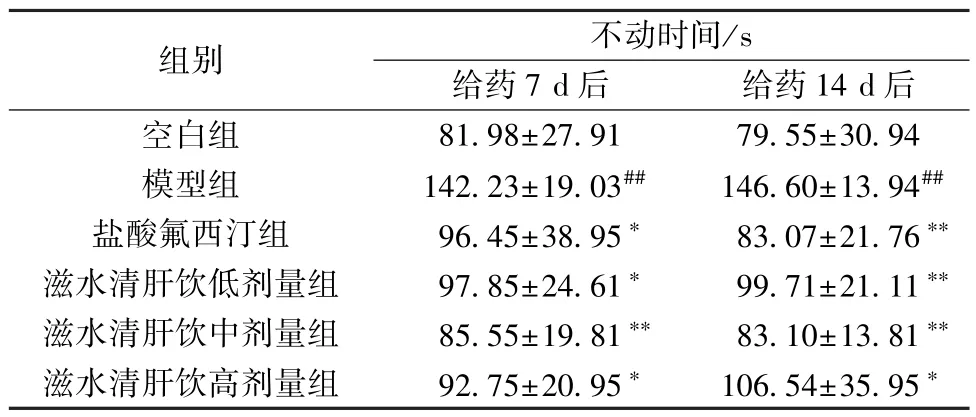
表3 滋水清肝饮对CRS 抑郁小鼠悬尾实验不动时间的影响(±s,n=8)Tab.3 Effects of Zishui Qinggan Decoction on immobilization time of tail suspension experiment in CRS depressed mice (±s,n=8)
注: 与空白组比较,##P <0.01; 与模型组比较,*P <0.05,**P<0.01。
组别不动时间/s给药7 d 后给药14 d 后空白组81.98±27.9179.55±30.94模型组142.23±19.03##146.60±13.94##盐酸氟西汀组96.45±38.95*83.07±21.76**滋水清肝饮低剂量组97.85±24.61*99.71±21.11**滋水清肝饮中剂量组85.55±19.81**83.10±13.81**滋水清肝饮高剂量组92.75±20.95*106.54±35.95*
3.1.3 强迫游泳实验不动时间 与空白组比较,模型组小鼠强迫游泳实验不动时间延长 (P<0.01); 给药7、14 d后,与模型组比较,盐酸氟西汀组及滋水清肝饮各剂量组小鼠强迫游泳实验不动时间缩短(P<0.05,P<0.01),见表4。
表4 滋水清肝饮对CRS 抑郁小鼠强迫游泳实验不动时间的影响(±s,n=8)Tab.4 Effects of Zishui Qinggan Decoction on immobilization time of forced swimming experiment in CRS depressed mice (±s,n=8)

表4 滋水清肝饮对CRS 抑郁小鼠强迫游泳实验不动时间的影响(±s,n=8)Tab.4 Effects of Zishui Qinggan Decoction on immobilization time of forced swimming experiment in CRS depressed mice (±s,n=8)
注: 与空白组比较,##P <0.01; 与模型组比较,*P <0.05,**P<0.01。
组别不动时间/s给药7 d给药14 d空白组90.80±16.3786.54±18.54模型组150.55±16.74##155.43±13.51##盐酸氟西汀组83.72±17.60**87.97±14.99**滋水清肝饮低剂量组105.29±12.06*121.81±15.83*滋水清肝饮中剂量组93.08±25.66**96.67±20.84**滋水清肝饮高剂量组111.30±16.15*128.33±19.04*
3.2 滋水清肝饮对CRS 抑郁小鼠海马神经细胞损伤的影响 空白组小鼠海马神经细胞形态饱满,轮廓清晰; 模型组细胞变形,颜色被深染,轮廓模糊,结构形态较差; 与模型组比较,滋水清肝饮中剂量组及盐酸氟西汀组病理形态明显改善,神经细胞形态基本正常,核固缩现象较少; 滋水清肝饮低、高剂量组有部分神经细胞结构形态发生改变,见图1。
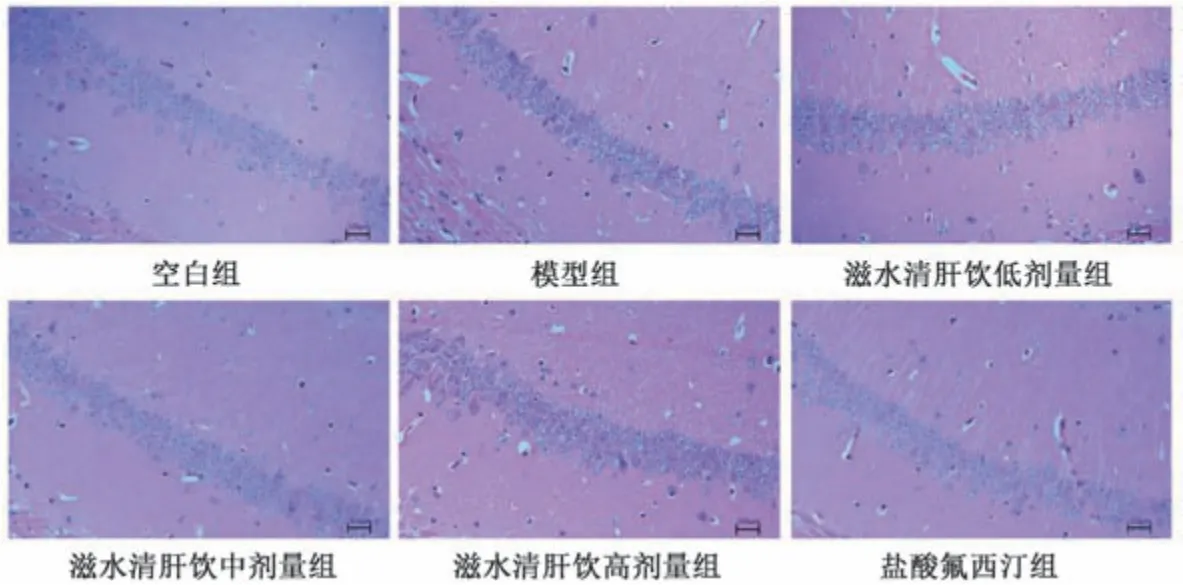
图1 滋水清肝饮对CRS 抑郁小鼠海马神经细胞损伤的影响(HE,×400)Fig.1 Effects of Zishui Qinggan Decoction on hippocampal neuron injury in CRS depressed mice (HE,×400)
3.3 滋水清肝饮对CRS 抑郁小鼠血清生化指标的影响 与空白组比较,模型组小鼠血清5-HT 水平和SOD 活性降低 (P<0.01),TNF-α、IL-1β、MDA 水平升高(P<0.01); 与模型组比较,盐酸氟西汀组及滋水清肝饮中剂量组小鼠血清5-HT 水平和SOD 活性升高(P<0.05,P<0.01),TNF-α、IL-1β、MDA 水平降低(P<0.05,P<0.01),滋水清肝饮低剂量组5-HT、MDA 水平无明显变化(P>0.05),TNF-α、IL-1β 水平降低(P<0.05),SOD活性升高(P<0.01),滋水清肝饮高剂量组5-HT水平无明显变化(P>0.05),TNF-α、IL-1β、MDA水平降低(P<0.05),SOD 活性升高(P<0.05),见表5。
表5 滋水清肝饮对CRS 抑郁小鼠血清5-HT、TNF-α、IL-1β、MDA 水平和SOD 活性的影响(±s,n=8)Tab.5 Effects of Zishui Qinggan Decoction on serum levels of 5-HT,TNF-α,IL-1β,MDA and SOD activity in CRS depressed mice (±s,n=8)
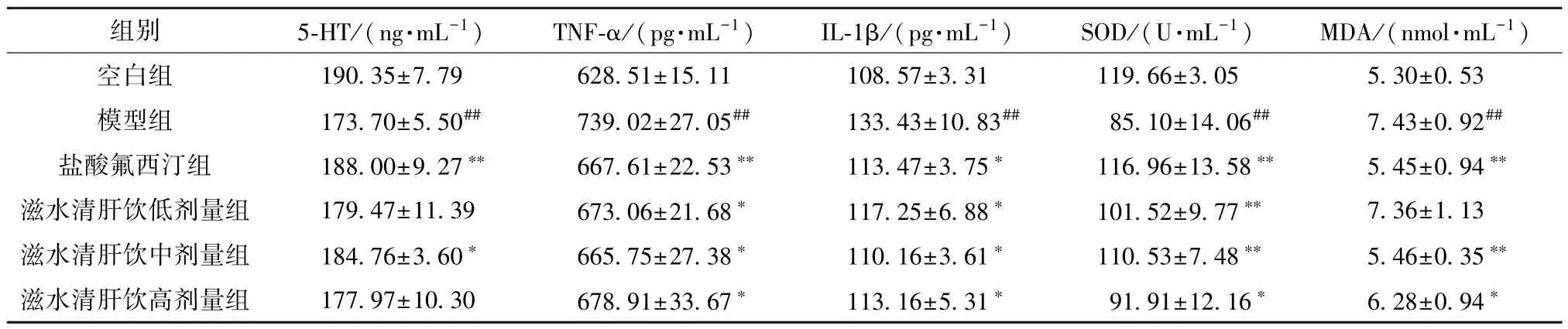
表5 滋水清肝饮对CRS 抑郁小鼠血清5-HT、TNF-α、IL-1β、MDA 水平和SOD 活性的影响(±s,n=8)Tab.5 Effects of Zishui Qinggan Decoction on serum levels of 5-HT,TNF-α,IL-1β,MDA and SOD activity in CRS depressed mice (±s,n=8)
注: 与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别5-HT/(ng·mL-1)TNF-α/(pg·mL-1)IL-1β/(pg·mL-1)SOD/(U·mL-1)MDA/(nmol·mL-1)空白组190.35±7.79628.51±15.11108.57±3.31119.66±3.055.30±0.53模型组173.70±5.50##739.02±27.05##133.43±10.83##85.10±14.06##7.43±0.92##盐酸氟西汀组188.00±9.27**667.61±22.53**113.47±3.75*116.96±13.58**5.45±0.94**滋水清肝饮低剂量组179.47±11.39673.06±21.68*117.25±6.88*101.52±9.77**7.36±1.13滋水清肝饮中剂量组184.76±3.60*665.75±27.38*110.16±3.61*110.53±7.48**5.46±0.35**滋水清肝饮高剂量组177.97±10.30678.91±33.67*113.16±5.31*91.91±12.16*6.28±0.94*
3.4 滋水清肝饮对CRS 抑郁小鼠海马组织BDNF、TNF-α、IL-1βmRNA 表达的影响 与空白组比较,模型组小鼠海马组织BDNFmRNA 表达降低(P<0.01),TNF-α、IL-1βmRNA 表达升高(P<0.01);与模型组比较,盐酸氟西汀组及滋水清肝饮中、高剂量组小鼠海马组织BDNFmRNA 表达升高(P<0.01),TNF-α、IL-1βmRNA 表达降低(P<0.05,P<0.01),滋水清肝饮低剂量组小鼠海马组织BDNFmRNA 表达无明显变化(P>0.05),TNF-α、IL-1βmRNA 表达降低(P<0.05),见表6。
表6 滋水清肝饮对CRS 抑郁小鼠海马组织BDNF、TNF-α、IL-1β mRNA 表达的影响(±s,n=5)Tab.6 Effects of Zishui Qinggan Decoction on hippocampal mRNA expressions of BDNF,TNF-α and IL-1β of CRS depressed mice (±s,n=5)
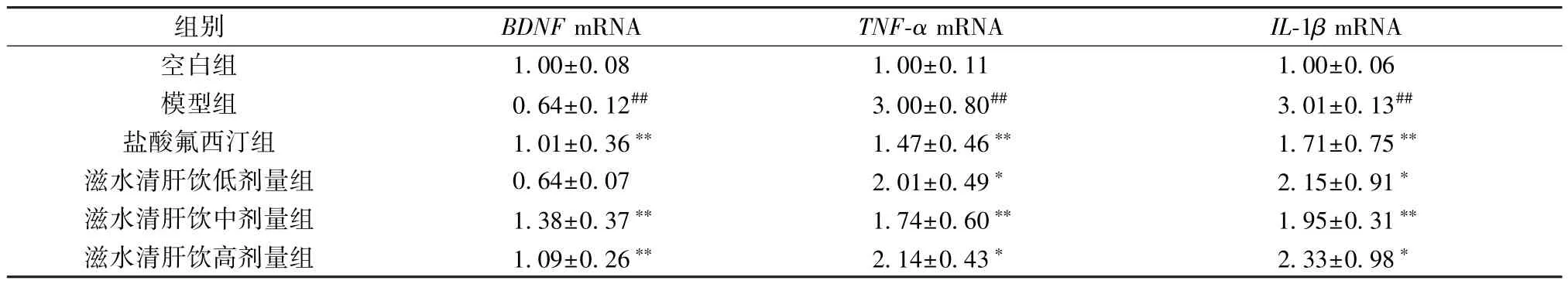
表6 滋水清肝饮对CRS 抑郁小鼠海马组织BDNF、TNF-α、IL-1β mRNA 表达的影响(±s,n=5)Tab.6 Effects of Zishui Qinggan Decoction on hippocampal mRNA expressions of BDNF,TNF-α and IL-1β of CRS depressed mice (±s,n=5)
注: 与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别BDNF mRNATNF-α mRNAIL-1β mRNA空白组1.00±0.081.00±0.111.00±0.06模型组0.64±0.12##3.00±0.80##3.01±0.13##盐酸氟西汀组1.01±0.36**1.47±0.46**1.71±0.75**滋水清肝饮低剂量组0.64±0.072.01±0.49*2.15±0.91*滋水清肝饮中剂量组1.38±0.37**1.74±0.60**1.95±0.31**滋水清肝饮高剂量组1.09±0.26**2.14±0.43*2.33±0.98*
3.5 滋水清肝饮对CRS 抑郁小鼠海马组织ERK1/2、GSK3β、CREB、BDNF 蛋白表达的影响 与空白组比较,模型组小鼠海马组织p-ERK1/2、p-GSK3β、CREB、BDNF 蛋白表达降低(P<0.05,P<0.01); 与模型组比较,盐酸氟西汀组及滋水清肝饮各剂量组小鼠海马组织p-ERK1/2、p-GSK3β、CREB、BDNF 表达升高(P<0.05,P<0.01),见图2、表7。
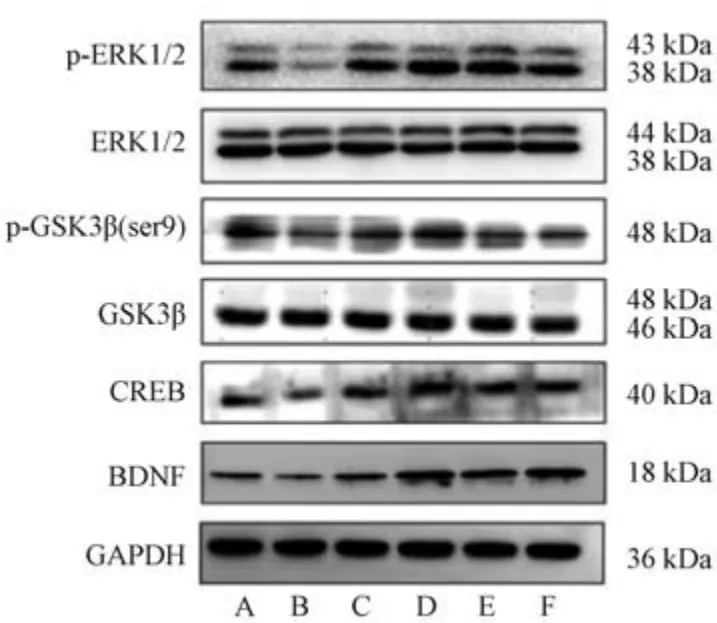
图2 各组小鼠海马组织ERK1/2、GSK3β、CREB、BDNF 蛋白电泳图Fig.2 Electropherograms of ERK1/2,GSK3β,CREB and BDNF proteins in hippocampus of mice in each group
表7 滋水清肝饮对CRS 抑郁小鼠海马组织ERK1/2、GSK3β、CREB、BDNF 蛋白表达的影响(±s,n=3)Tab.7 Effects of Zishui Qinggan Decoction on hippocampal protein expressions of ERK1/2,GSK3β,CREB and BDNF of CRS depressed mice (±s,n=3)

表7 滋水清肝饮对CRS 抑郁小鼠海马组织ERK1/2、GSK3β、CREB、BDNF 蛋白表达的影响(±s,n=3)Tab.7 Effects of Zishui Qinggan Decoction on hippocampal protein expressions of ERK1/2,GSK3β,CREB and BDNF of CRS depressed mice (±s,n=3)
注: 与空白组比较,#P<0.05,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别p-ERK1/2/ERK1/2p-GSK3β/GSK3βCREB/GAPDHBDNF/GAPDH空白组0.64±0.040.89±0.070.68±0.020.26±0.02模型组0.23±0.04##0.53±0.12##0.32±0.03##0.16±0.01#盐酸氟西汀组0.82±0.09**0.68±0.10*0.63±0.01**0.50±0.02**滋水清肝饮低剂量组0.75±0.05**0.77±0.02*0.92±0.07**0.33±0.30**滋水清肝饮中剂量组0.96±0.06**0.89±0.05**0.95±0.02**0.51±0.01**滋水清肝饮高剂量组0.82±0.11**0.72±0.05*0.78±0.03**0.41±0.05**
4 讨论
众所周知,压力是重度抑郁症发展的致病因素之一[9]。CRS 是抑郁动物研究中常见的慢性应激模型,是一种同时诱导心理和生理压力的经典方法。本研究采用糖水偏好实验判断小鼠是否存在快感缺失的状况,并根据小鼠快感缺失的情况进行剔除和分组,在一定程度上保证后续验证滋水清肝饮抗抑郁效果的准确性。悬尾实验及强迫游泳实验的不动时间主要用来评估抑郁中的绝望行为,不动时间越长表示小鼠对生存的意愿越低、绝望性越高。研究表明,海马CA1 容易受到压力的影响,导致神经元的树突分枝和脊椎密度的减少进而影响其海马体积及细胞形态[10],本研究结果显示,中剂量滋水清肝饮及盐酸氟西汀可对CRS 抑郁小鼠神经细胞的损伤起到一定的防治作用。当给予滋水清肝饮后抑郁小鼠对糖水的偏好性增强,不动时间缩短,小鼠血清5-HT 水平和SOD 活性升高,MDA及炎症因子TNF-α、IL-1β 水平降低,提示滋水清肝饮具有一定的抗抑郁作用[11]。
BDNF 作为与神经可塑性、记忆力和情感表达相关的重要因子,是抑郁障碍发病机制的关键因素之一,且BDNF 水平随着抑郁严重程度的增加而降低[12]。在抑郁自杀患者的大脑中发现BDNF 蛋白表达降低[13],给予抑郁症病人抗抑郁药物治疗后能够使血液中BDNF 水平回到正常范围[14]; 啮齿动物暴露于慢性应激,早年生活应激或不可预测应激都会使海马体中BDNF 表达降低[15-16],这些研究都表明BDNF 水平升高可支持抗抑郁药赋予其有益功能的机制[17]。CREB 作为BDNF 的正向靶点,已被证明是BDNF 介导细胞存活的关键介质,两者的表达有一定的相关性[18]。CREB 可以被各种激酶激活,包括ERK、GSK3β 等。GSK3β 是一种丝氨酸/苏氨酸激酶,广泛存在于中枢神经系统,主要分布在神经元,GSK3β 活性增加支持细胞凋亡,活性减弱增强神经可塑性和细胞弹性[19],神经元调节GSK3β 活性的主要方式是通过控制Ser9 的磷酸化,GSK3β 在Ser9 残基处的磷酸化可以抑制GSK3β 响应正向信号的活性[20]。研究表明GSK3β活性的调节与许多情绪稳定剂和抗抑郁药的直接或下游作用机制有关[21],主要通过CREB 为中介,调节BDNF 的转录从而达到抗抑郁样作用的效果。ERK 为丝裂原活化蛋白激酶的原型亚家族,在几种ERK 亚型(ERK1/2/3/4/5/7) 中,ERK1/2 在中枢神经系统中的研究和表征最为显著[22]。现有数据显示,ERK1/2 在包括抑郁症在内的各种神经精神疾病中起着关键作用[23],不仅可以激活CREB 参与神经元存活和神经保护,还可以促进BDNF 对神经元细胞发挥抗损伤和促生长的作用,从而影响抑郁症的发生、发展[24]。本研究结果显示,当给予抑郁小鼠滋水清肝饮及盐酸氟西汀后,小鼠海马组织 BDNF、CREB、p-ERK1/2、p-GSK3β 蛋白表达升高,海马组织BDNFmRNA 表达升高,表明滋水清肝饮可以通过ERK1/2/GSK3β/CREB/BDNF 通路参与抑郁症发病进展。
综上所述,滋水清肝饮可以通过上调抑郁小鼠糖水偏好率,降低抑郁小鼠对生存的绝望性,提高5-HT 水平,降低炎症因子水平,调控ERK1/2/GSK3β/CREB/BDNF 通路发挥抗抑郁作用,有望成为治疗抑郁症的潜在新策略。
