黄葵胶囊质量标准提升
2024-03-10崔雨晴冯文明沙禕炜
崔雨晴,冯文明,张 甦,沙禕炜
[鉴甄检测技术(上海) 有限公司,上海 200131]
黄葵胶囊为单方制剂,组方药材为黄蜀葵花,功效清利湿热、解毒消肿[1],具有抑制炎症反应、改善微循环、降低尿蛋白、减轻水肿、清除自由基、抗肾纤维化等作用,临床广泛用于糖尿病肾病湿热症、慢性肾炎的治疗,疗效确切[2-5]。研究表明,黄葵胶囊有效成分为黄酮[6],虽然该类成分含量测定已有大量报道[7-16],但目前该制剂现行质量标准仍以槲皮素为定性鉴别指标,缺乏专属性;以金丝桃苷含量为定量分析指标,成分单一,难以进行全面评价。本实验针对黄葵胶囊中多元活性成分的特点[17],建立黄酮类成分的定性鉴别、特征图谱、含量测定方法,以期为该制剂质量评价提供参考。
1 材料
ATS 4 全自动点样仪、Visualizer 2 薄层色谱数码成像系统(瑞士CAMAG 公司); Waters Aquility UPLC H-class 超高效液相色谱仪(美国Waters 公司); Schmidbauer GmbH/P300H 超声波清洗仪(德国Elma 公司); MS204TS/02、XSE105DU 电子天平(瑞士梅特勒-托利多公司); TLC Silica gel 60 F254 薄层板(德国Merck 公司)。金丝桃苷(批号111521-201809,纯度 94.9%)、芦丁 ( 批号100080-201811,纯度91.7%)、异槲皮苷 (批号111809-201804,纯度97.2%)、槲皮素 (批号100081-201610,纯度99.1%) 对照品均购自中国食品药品检定研究院; 棉皮素-8-O-葡糖醛酸苷对照品(批号T01J11Z117171,纯度98.5%) 购自上海源叶生物科技有限公司; 杨梅素对照品(批号6609,纯度99.8%) 购自上海诗丹德标准技术服务有限公司; 槲皮素-3′-O-葡萄糖苷对照品(纯度94.2%) 购自江苏苏中药业集团股份有限公司。黄葵胶囊由江苏苏中药业集团股份有限公司提供(批号20061503、20061504、20061601、20061602、20061702、20061703、20061801、20061802、20062001、20062002、20080303、20080304、20080403、20080404、20080503、20080504)。二苯基硼酸-2-氨基乙酯[梯希爱(上海) 化成工业发展有限公司]; 聚乙二醇(上海泰坦科技股份有限公司)。流动相用乙腈(上海阿达玛斯试剂有限公司)、甲酸(美国Fisher公司) 均为色谱纯; 供试品溶液制备、薄层展开剂用甲醇、乙醇、无水甲酸、二氯甲烷均为分析纯; 水为超纯水[由Master Touch-DUVF 综合型超纯水机(上海和泰仪器有限公司) 制备]。
2 方法与结果
2.1 TLC 定性鉴别 取本品内容物0.1 g,研细,加5 mL 甲醇超声提取15 min,离心,上清液作为供试品溶液; 取棉皮素-8-O-β-D-葡萄糖醛酸苷、异槲皮苷对照品适量,加甲醇制成每0.5 mL 含两者各1 mg 的溶液,作为系统适用性溶液; 取芦丁、棉皮素-8-O-β-D-葡萄糖醛酸苷、异槲皮苷对照品适量,加甲醇制成每0.5 mL 含三者各1 mg 的溶液,作为参照品溶液,吸取上述溶液各4 μL,点于同一高效硅胶GF254薄层板上,以乙酸乙酯-无水甲酸-水(8 ∶1 ∶1) 为展开剂,展开缸用滤纸预饱和20 min,展距6 cm,取出,晾干,在105 ℃下加热3 ~4 min,先喷以10 g/L 二苯基硼酸-2-氨基乙酯甲醇溶液,再喷以50 g/L 聚乙二醇400 甲醇溶液,空气中干燥3 ~4 min,在紫外光灯(365 nm) 下检视,结果见图1。由此可知,供试品溶液色谱图在对照品溶液色谱图相应位置上显示相同颜色斑点。
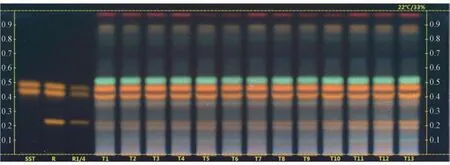
图1 黄葵胶囊TLC 色谱图Fig.1 TLC chromatogram of Huangkui Capsules
2.2 UPLC 特征图谱建立
2.2.1 色谱条件与系统适用性考察 Acquity UPLC BEH C18色谱柱 (150 mm×2.1 mm,1.7 μm); 流动相乙腈(A) -0.05% 甲酸(B),梯度洗脱(0 ~2 min,12% ~15%A; 2 ~7 min,15%A;7 ~8 min,15% ~17% A; 8 ~13.5 min,17% A;13.5~17 min,17% ~30% A; 17 ~20 min,30% ~80%A; 20 ~21 min,80% ~95% A; 21 ~22 min,95% ~12%A; 22~25 min,12%A); 体积流量0.3 mL/min; 柱温30 ℃; 检测波长360 nm; 进样量1.0 μL。理论塔板数按金丝桃苷峰计,不低于10 000。
2.2.2 对照品溶液制备 精密称取金丝桃苷对照品适量,70%乙醇制成每1 mL 含45 μg 该成分的溶液,即得。
2.2.3 供试品溶液制备 取装量差异项下本品内容物,混匀,研细,取约0.05 g,精密称定,置于具塞锥形瓶中,精密加入70%乙醇20 mL,密塞,称定质量,超声(功率380 W,频率37 kHz) 处理30 min,放冷,70% 乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.4 阴性样品溶液制备 取阴性样品适量,按“2.2.3” 项下方法制备,即得。
2.2.5 标准规定 供试品特征图谱中应呈现7 个特征峰,以金丝桃苷为参照,2 号峰应与对照品溶液峰保留时间对应,相对保留时间应在规定值的±5%范围之内,规定值分别为0.95 (峰1)、1.09(峰3)、1.58 (峰4)、1.75 (峰5)、2.03 (峰6)、2.26 (峰7)。
2.2.6 专属性试验 图2 显示,峰1 为芦丁,峰2 为金丝桃苷,峰3 为异槲皮苷,峰4 为棉皮素-8-O-β-D-葡萄糖醛酸苷,峰5 为杨梅素,峰6 为槲皮素-3′-O-葡萄糖苷,峰7 为槲皮素,阴性无干扰,表明该方法专属性良好。
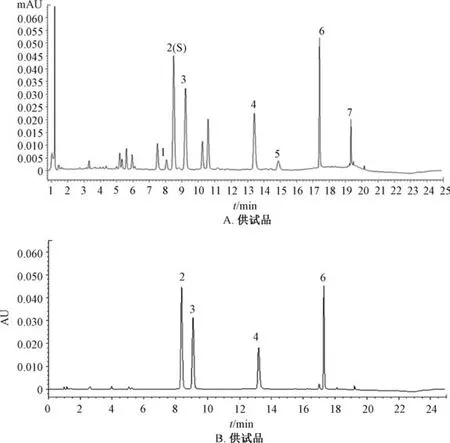
图2 各成分UPLC 色谱图Fig.2 UPLC chromatograms of various constituents
2.2.7 精密度试验 取本品(批号20061602) 适量,按“2.2.3” 项下方法制备供试品溶液,在“2.2.1” 项色谱条件下进样测定6 次,以金丝桃苷为参照,测得各特征峰相对保留时间RSD 在0 ~0.11%范围内,相对峰面积RSD 在0 ~0.60%范围内,表明仪器精密度良好。
2.2.8 重复性试验 取本品(批号20061602) 适量,按“2.2.3” 项下方法平行制备6 份供试品溶液,在“2.2.1” 项色谱条件下进样测定,以金丝桃苷为参照,测得各特征峰相对保留时间RSD 在0.05% ~0.37% 范围内,相对峰面积 RSD 在0.45% ~6.05%范围内(个别特征峰因其峰面积过小,导致相对峰面积偏大),表明该方法重复性良好。
2.2.9 中间精密度试验 由不同分析人员在不同检验日期采用不同仪器,将同一份本品 (批号20061602) 按“2.2.3” 项下方法平行制备6 份供试品溶液,在“2.2.1” 项色谱条件下进样测定,以金丝桃苷为参照,测得各特征峰相对保留时间RSD 在0.17% ~2.21%范围内,相对峰面积RSD 在0.25% ~23.12% 范围内(个别特征峰因其峰面积过小,导致相对峰面积偏大),表明该方法中间精密度良好。
2.2.10 稳定性试验 取“2.2.3” 项下供试品溶液(批号20061602) 适量,室温下于0、3、6、9、12 h 在“2.2.1” 项色谱条件下进样测定,以金丝桃苷为参照,测得各特征峰相对保留时间RSD 在0.03% ~0.55% 范围内,相对峰面积 RSD 在0.11% ~3.62%范围内,表明溶液在12 h 内稳定性良好。
2.2.11 图谱生成 采用上述方法建立16 批样品UPLC 特征图谱,以金丝桃苷为参照,发现7 个特征峰在16 批样品中均有体现,而且其相对保留时间均在规定值的±5%以内。
2.3 含量测定 采用一测多评法。
2.3.1 色谱条件与系统适用性考察 同“2.2.1” 项。
2.3.2 对照品溶液制备 精密称取金丝桃苷、棉皮素-8-O-β-D-葡萄糖醛酸苷对照品适量,70%乙醇制成每1 mL 分别含两者45、65 μg 的溶液,即得。
2.3.3 供试品溶液制备 取装量差异项下本品内容物适量,混匀,研细,取约0.05 g,精密称定,置于具塞锥形瓶中,按“2.2.3” 项下方法制备,即得。
2.3.4 线性关系考察 精密称取各对照品适量,加70%乙醇制成每1 mL 分别含金丝桃苷0.180 8 mg/mL、异槲皮苷0.122 5 mg/mL、棉皮素-8-O-葡糖醛酸苷0.528 7 mg/mL、槲皮素-3′-O-葡萄糖苷0.109 5 mg/mL 的贮备液,精密量取适量,70%乙醇逐级稀释成系列质量浓度,在“2.3.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,结果见表1,可知各成分在各自范围内线性关系良好。
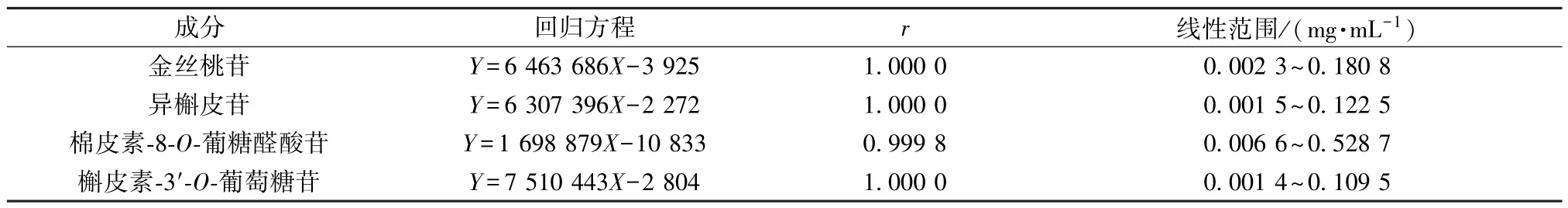
表1 各成分线性关系Tab.1 Linear relationships of various constituents
2.3.5 精密度试验 取本品(批号20061602) 适量,按“2.3.3” 项下方法制备供试品溶液,在“2.3.1” 项色谱条件下进样测定6 次,测得金丝桃苷、异槲皮苷、棉皮素-8-O-葡糖醛酸苷、槲皮素-3′-O-葡萄糖苷峰面积RSD 分别为0.03%、0.04%、1.14%、0.06%,表明仪器精密度良好。
2.3.6 重复性试验 取本品(批号20061602) 适量,按“2.3.3” 项下方法平行制备6 份供试品溶液,在“2.3.1” 项色谱条件下进样测定,测得金丝桃苷、异槲皮苷、棉皮素-8-O-葡糖醛酸苷、槲皮素-3′-O-葡萄糖苷含量RSD 分别为0.56%、0.56%、1.59%、1.06%,表明该方法重复性良好。
2.3.7 中间精密度试验 由不同分析人员在不同检验日期采用不同仪器,将同一份本品 (批号20061602) 按“2.3.3” 项下方法平行制备6 份供试品溶液,在“2.3.1” 项色谱条件下进样测定,测得金丝桃苷、异槲皮苷、棉皮素-8-O-葡糖醛酸苷、槲皮素-3′-O-葡萄糖苷含量 RSD 分别为1.57%、0.57%、2.22%、0.03%,表明该方法中间精密度良好。
2.3.8 稳定性试验 取“2.3.3” 项下供试品溶液(批号20061602) 适量,室温下于0、3、6、9、12 h 在“2.3.1” 项色谱条件下进样测定,测得金丝桃苷、异槲皮苷、棉皮素-8-O-葡糖醛酸苷、槲皮素-3′-O-葡萄糖苷峰面积RSD 分别为0.17%、0.22%、2.16%、0.56%,表明溶液在12 h 内稳定性良好。
2.3.9 加样回收率试验 精密称取各成分含量已知的本品内容物(批号20061602) 0.025 g,平行分为3 组(低、中、高组),每组3 份,分别精密加入对照品溶液(各成分质量浓度分别为金丝桃苷0.044 3 mg/mL、异槲皮苷0.034 2 mg/mL、棉皮素-8-O-葡糖醛酸苷0.055 2 mg/mL、槲皮素-3′-O-葡萄糖苷0.024 1 mg/mL) 5、10、15 mL,按“2.3.3” 项下方法制备供试品溶液,在“2.3.1”项色谱条件下进样测定,计算回收率。结果,金丝桃苷、异槲皮苷、棉皮素-8-O-葡糖醛酸苷、槲皮素-3′-O-葡萄糖苷平均加样回收率分别为100.5%、99.3%、99.4%、98.7%,RSD 分别为 1.44%、1.55%、1.79%、1.46%。
2.3.10 相对校正因子、相对保留时间测定 取“2.3.4” 项下不同质量浓度对照品溶液适量,在“2.3.1” 项色谱条件下进样测定,以金丝桃苷为内标,计算其他2 种成分相对校正因子fk/s,公式为fk/s=fk/fs= (CkAs) /(CsAk),其中Ck为其他成分含量,Ak为其他成分峰面积,Cs为内标含量,As为内标峰面积,同时计算相对保留时间(RRT),结果见表2。
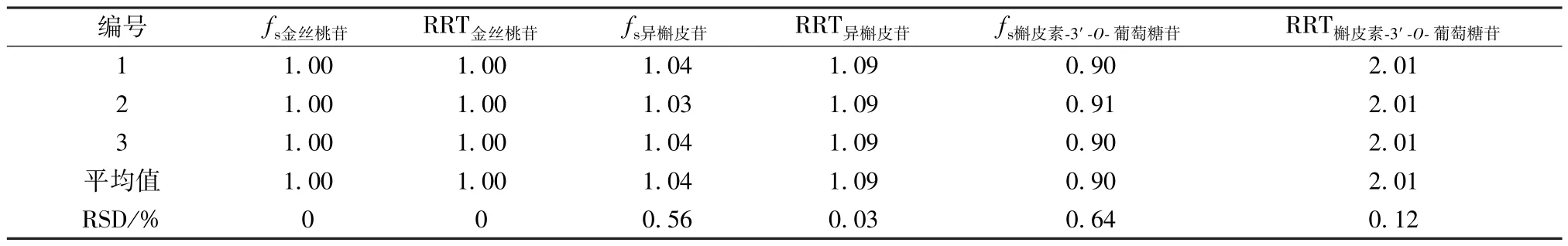
表2 各成分相对校正因子、相对保留时间Tab.2 Relative correction factors and relative retention time of various constituents
2.3.11 耐用性试验
2.3.11.1 相对校正因子 取“2.3.9” 项下不同质量浓度对照品溶液适量,分别考察不同仪器、色谱柱、水相、体积流量、柱温、进样量对相对校正因子的影响,结果见表3 ~4,可知均无明显影响(RSD<4.0%)。
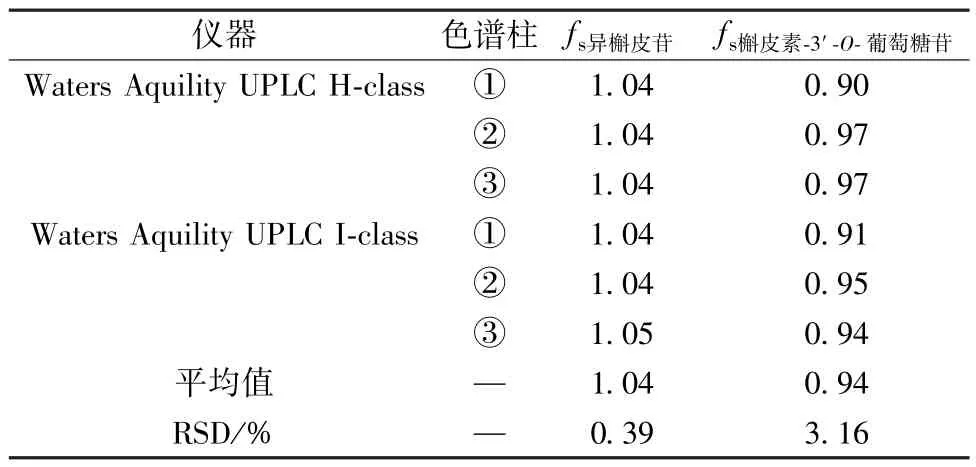
表3 不同仪器、色谱柱对相对校正因子的影响Tab.3 Effects of different instruments and columns on relative correction factors
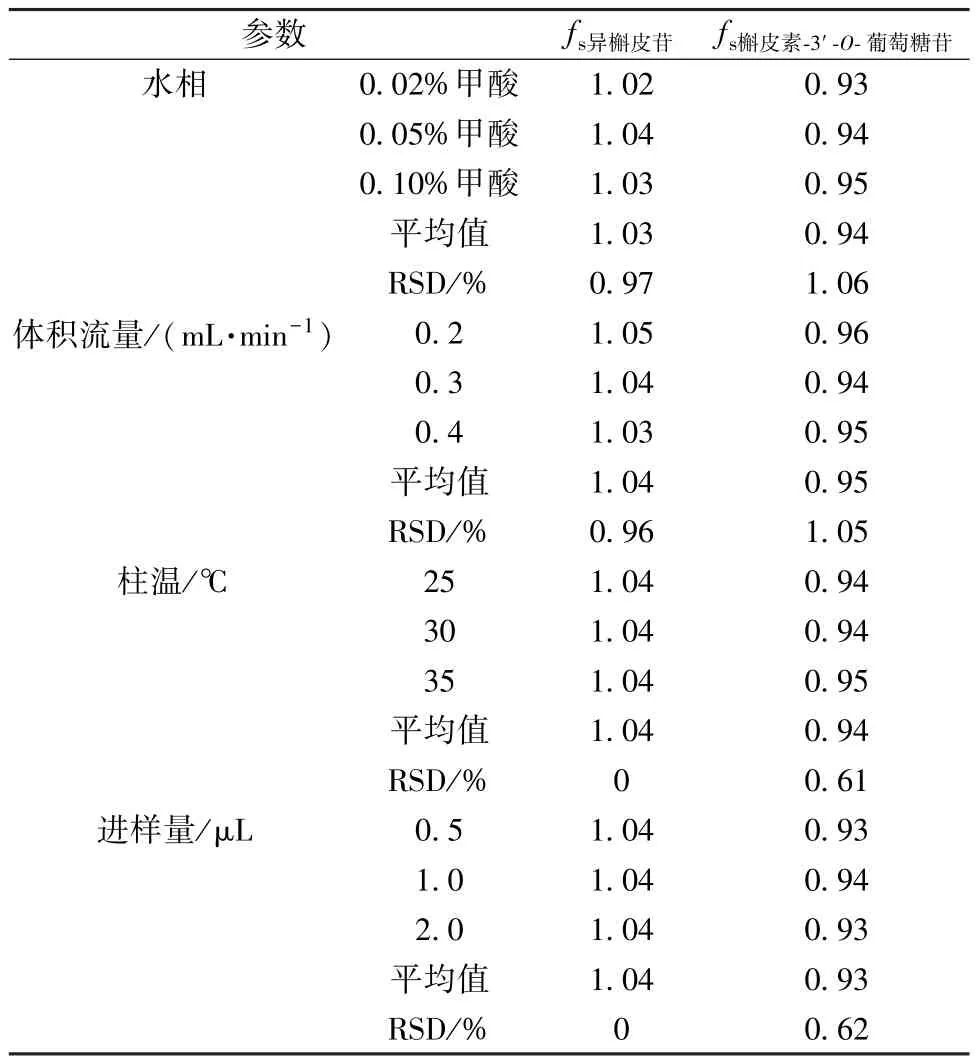
表4 不同水相、体积流量、柱温、进样量对相对校正因子的影响Tab.4 Effects of different aqueous phases,volumetric flow rates,column temperatures and injection volumes on relative correction factors
2.3.11.2 相对保留时间 取“2.3.9” 项下不同质量浓度对照品溶液适量,分别考察不同仪器、色谱柱、水相、体积流量、柱温、进样量对相对保留时间的影响,结果见表5~6,可知仪器、水相、柱温、进样量均无明显影响(RSD <5%),而色谱柱、体积流量影响较明显(RSD>5%),建议固定色谱柱为ACQUITY UPLC BEH C18(2.1 mm×150 mm,1.7 μm),体积流量为0.3 mL/min。
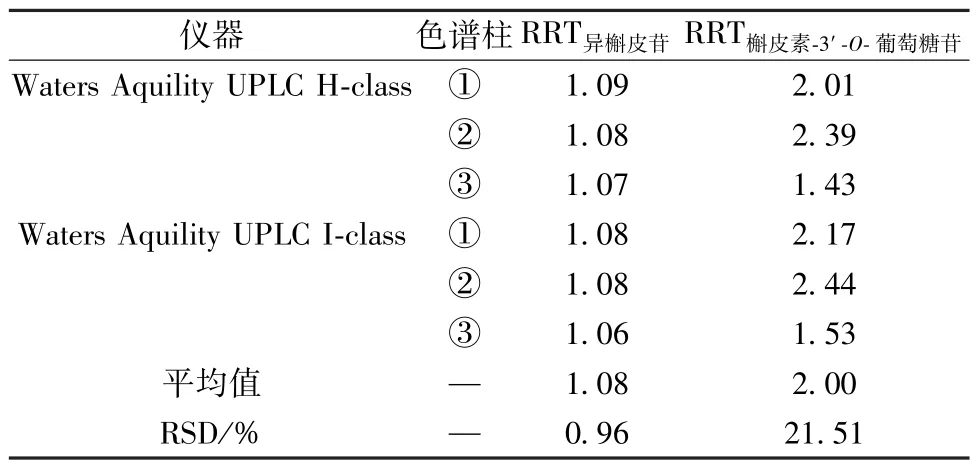
表5 不同仪器、色谱柱对相对保留时间的影响Tab.5 Effects of different instruments and columns on relative retention time

表6 不同水相、体积流量、柱温、进样量对相对保留时间的影响Tab.6 Effects of different aqueous phases,volumetric flow rates,column temperatures and injection volumes on relative retention time
2.3.12 样品测定 取16 批样品,按 “2.3.3”项下方法制备供试品溶液,每批 2 份,在“2.3.1” 项色谱条件下进样测定,分别采用外标法、一测多评法计算含量,结果见表7,可知2 种方法所得结果无明显差异[相对平均偏差(RAD) <1%]。
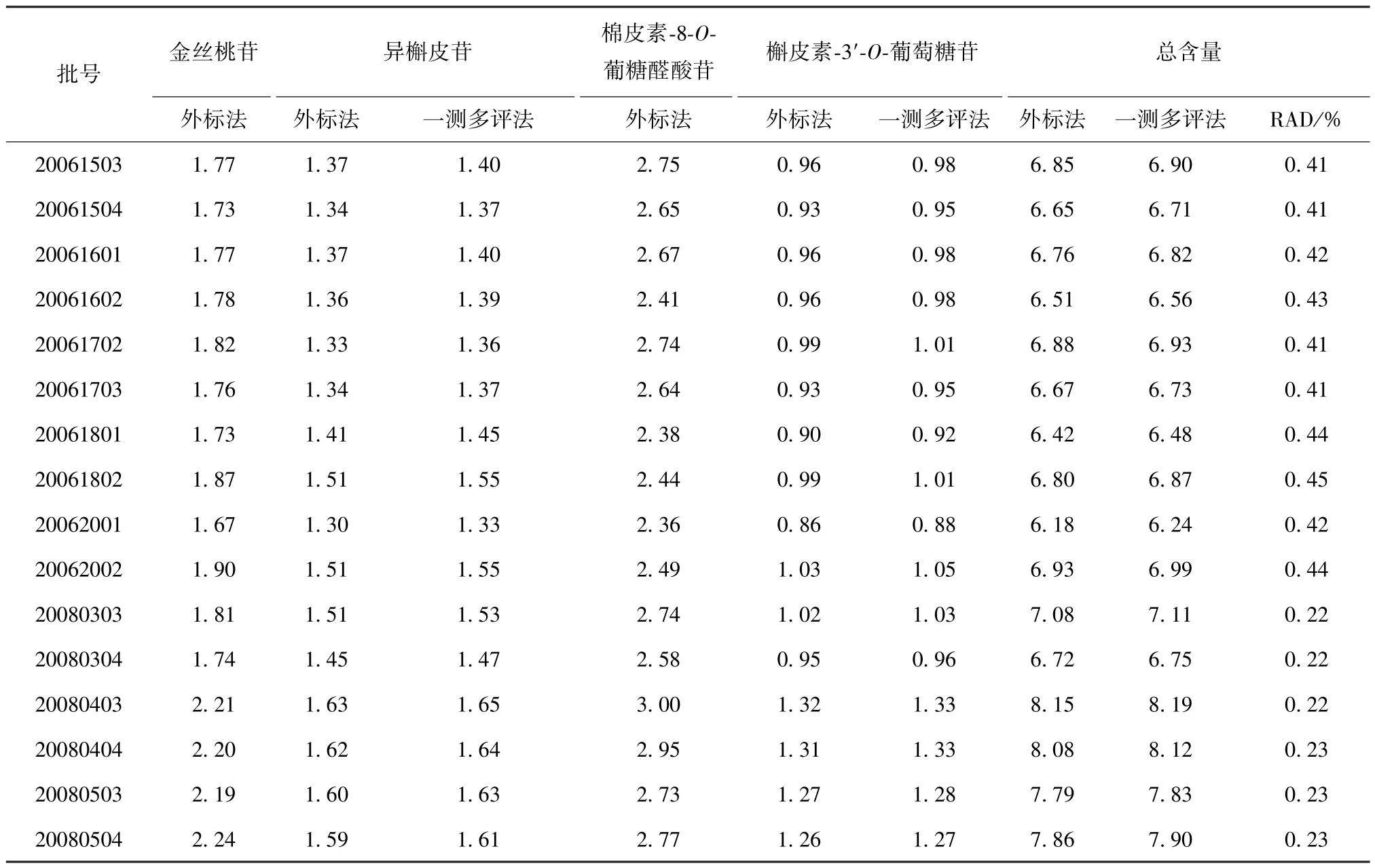
表7 各成分含量测定结果(%,n=2)Tab.7 Results for content determination of various constituents (%,n=2)
3 讨论
在黄葵胶囊现行质量标准中,薄层鉴别指标仅有槲皮素,缺乏专属性,本实验参考《欧洲药典》中黄蜀葵花薄层鉴别方法,优化了供试品溶液制备方法、展开剂等条件,最终确定以棉皮素-8-O-β-D-葡萄糖醛酸苷、异槲皮苷为指标,其专属性强,耐用性好,可实现有效成分鉴别的目的。
在建立黄酮类成分特征图谱时,测定了芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-β-D-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、槲皮素含量,涵盖了杨梅素、槲皮素、棉皮素3 种母核的黄酮类化合物[18],可全面控制该类成分质量。
在含量测定过程中,选择含量较高的金丝桃苷、异槲皮苷、槲皮素-3′-O-葡萄糖苷、棉皮素-8-O-β-D-葡萄糖醛酸苷作为指标,由于棉皮素-8-O-β-D-葡萄糖醛酸苷母核结构与其他3 种成分不一致,而且槲皮素-3′-O-葡萄糖苷对照品不易得到,故最终确定采用外标法测定棉皮素-8-O-β-D-葡萄糖醛酸苷含量,再以金丝桃苷为内标,采用一测多评法同时其他3 种成分含量。
4 结论
本实验中的定性鉴别新增棉皮素-8-O-β-D-葡萄糖醛酸苷、异槲皮苷2 种黄酮类成分,特征图谱包含芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-β-D-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、槲皮素7 种黄酮类成分,含量测定在原有金丝桃苷的基础上增加异槲皮苷、槲皮素-3′-O-葡萄糖苷、棉皮素-8-O-β-D-葡萄糖醛酸苷3 种黄酮苷类成分,从而实现更全面地控制黄葵胶囊质量的目的。
