黄芩茎叶葡萄糖醛酸水解酶提取工艺、酶学性质、实际应用研究
2024-03-10程雨婕刘云华黄志芳刘玉红易进海
程雨婕,陈 旭,刘云华,黄志芳,陈 燕,刘玉红,易进海*
(1.成都中医药大学药学院,四川 成都 611130; 2.四川省中医药科学院,中药材品质及创新中药研究四川省重点实验室,四川 成都 610041)
黄芩主要有效成分为黄芩苷、汉黄芩苷、黄芩素、汉黄芩素等黄酮,其中黄芩素较黄芩苷有更强的生物活性,而且更易吸收,生物利用度更高[1-3],故从黄芩中直接提取该成分具有更好的药用价值。黄芩存在葡萄糖醛酸水解酶,主要催化黄芩苷水解形成黄芩素,属于糖基水解酶家族79[4],被命名为黄芩酶。课题组前期报道从黄芩中提取黄芩酶以酶解黄芩苷类成分,制备黄芩素和总苷元[5],本实验在此基础上从黄芩茎叶这一地上部分废弃物中提取葡萄糖醛酸水解酶(sbslGUS),研究其酶学特性,并筛选其转化黄芩苷的条件,以期提高黄芩素收率,为相关高效生产提供新思路。
1 材料
Agilent 1200 型高效液相色谱仪,配置四元泵、VWD 检测器、柱温箱、自动进样器、工作站(美国Agilent 公司); KQ-300 型超声波清洗仪(昆山市超声仪器有限公司); FW-200 型高速万能粉碎机(北京中兴伟业仪器有限公司); SQP 型电子天平[十万分之一,赛多利斯科学仪器(北京) 有限公司]; JY-30002 型电子天平(广州玉治仪器有限公司); DZKW-4 型电热恒温水浴锅(北京中兴伟业世纪仪器有限公司); Integral-3 型超纯水机(成都宝赛思科技有限公司)。
黄芩苷(纯度95.4%,批号110715-201821)、黄芩素(纯度97.9%,批号111595-201808) 对照品均购自中国食品药品检定研究院; 黄芩苷对照品(纯度85%,批号nkl201119038) 购自成都钠钶锂生物科技有限公司。乙腈为色谱纯(美国Fisher 公司); 甲醇为色谱纯(成都市科龙化工试剂厂);甲酸为色谱纯(成都市科龙仪器有限公司); 其余试剂均为分析纯; 水为超纯水(超纯水机制备)。
黄芩茎叶经四川省中医药科学院李青苗研究员鉴定,为唇形科植物黄芩ScutellariabaicalensisGeorgi 的茎叶。
2 方法与结果
2.1 酶活性测定
2.1.1 测定条件 参考文献[6] 报道,以黄芩苷为底物。精密量取13.4 mmol/L pH 6.0 的黄芩苷溶液1 mL、0.02 mol/L pH 6.0 的磷酸缓冲盐溶液2 mL、sbslGUS 提取液0.5 mL,在45 ℃、pH 6.0 条件下反应20 min,加入3 倍酶解体系量乙醇终止反应,转移至50 mL 量瓶中,70%乙醇超声处理20 min,放置至室温,70%乙醇定容至刻度,摇匀,滤过,取续滤液,进样分析,计算酶活性(酶活性定义为在45 ℃、pH 6.0 条件下,每1 h催化酶解1 μmol 黄芩苷所需的酶量为1 U[7-8],结果以生药计,单位为U/g)。
2.1.2 色谱条件 Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm); 流动相0.1% 甲酸(A) -甲醇(B),梯度洗脱(0~8 min,50%B; 8 ~9 min,50% ~70%B; 9 ~20 min,70%B); 体积流量1.0 mL/min; 柱温35 ℃; 检测波长278 nm; 进样量10 μL。理论塔板数按黄芩苷色谱峰计,应不低于3 000。色谱图见图1。
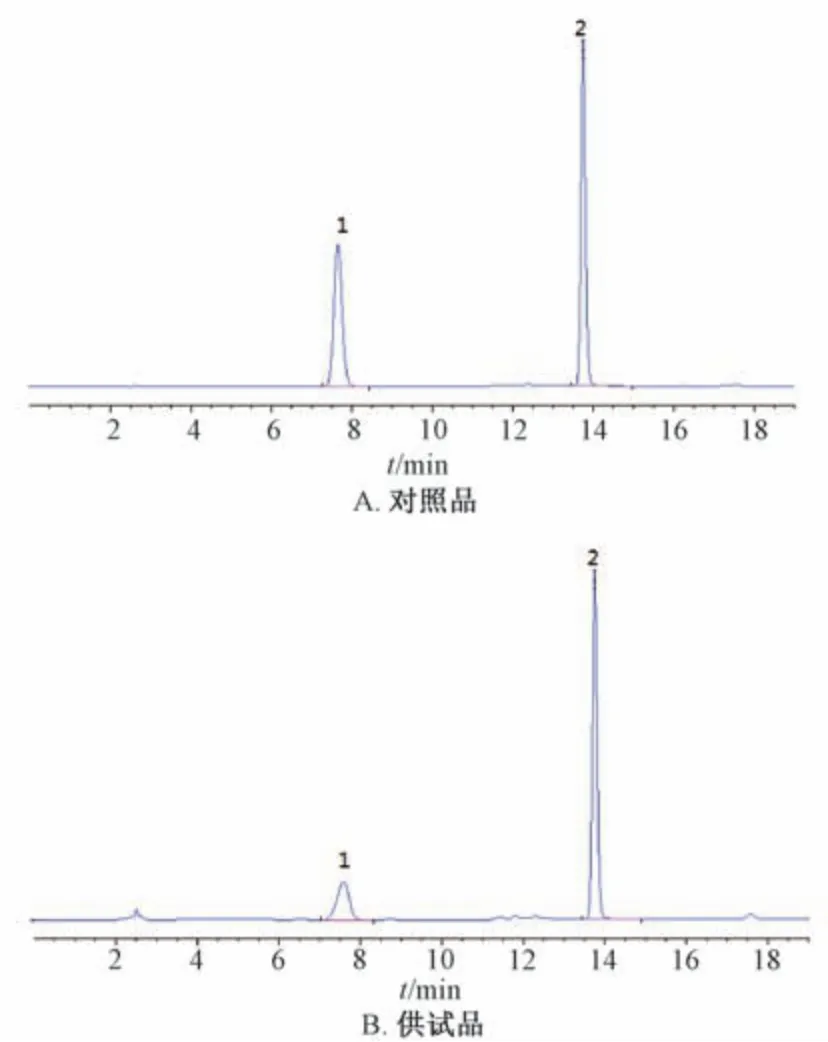
图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
2.1.3 对照品溶液制备 精密称取黄芩苷、黄芩素对照品适量,70%乙醇制成每1 mL 分别含两者156.84、177.59 μg 的溶液,即得。
2.1.4 供试品溶液制备 同“2.1.1” 项。
2.1.5 线性关系考察 分别精密移取对照品溶液0.5、1、2、4、5、10 mL,置于10 mL 量瓶中,70%乙醇定容,在“2.1.2” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,结果见表1,可知各成分在各自范围内线性关系良好。
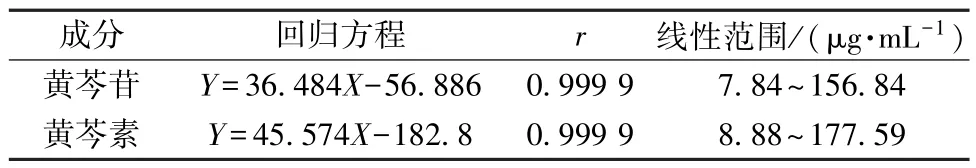
表1 各成分线性关系Tab.1 Linear relationships of various constituents
2.1.6 精密度试验 取同一质量浓度对照品溶液适量,在“2.1.2” 项色谱条件下进样测定6 次,测得黄芩苷、黄芩素峰面积RSD 分别为0.14%、1.11%,表明仪器精密度良好。
2.1.7 稳定性试验 取供试品溶液适量,室温下于0、2、4、6、8、10、12、24 h 在“2.1.2” 项色谱条件下进样测定,测得黄芩苷、黄芩素峰面积RSD 分别为0.12%、1.83%,表明溶液在24 h 内稳定性良好。
2.1.8 重复性试验 按“2.1.4” 项下方法平行制备6 份供试品溶液,在“2.1.2” 项色谱条件下进样测定,测得黄芩素、黄芩苷含量RSD 分别为1.73%、1.54%,表明该方法重复性良好。
2.1.9 加样回收率试验 精密量取各成分含量已知的供试品溶液6 份,加入适量对照品溶液,混匀,在“2.1.2” 项色谱条件下进样测定,计算回收率。结果,黄芩苷、黄芩素平均加样回收率分别为99.63%、100.25%,RSD 分别为1.97%、1.92%。
2.2 提取工艺研究
2.2.1 筛选 参照文献[6-9] 报道的方法,并略加改进。将干燥黄芩茎叶粉碎,过40 目筛,称取3 份,每份50 g,第1 份加24 倍量水,在45 ℃下水浴浸提12 h; 第2 份分别加14、10 倍量水,室温搅拌提取2 次,每次30 min; 第3 份分别加14、10 倍量磷酸缓冲盐溶液(0.01 mol/L,pH 7.0),室温搅拌提取2 次,每次30 min,8 000 r/min 离心8 min,即得提取液,按“2.1” 项下方法测定酶活性。结果,3 份提取液酶活性分别为460、1 322、1 401 U/g,表明水浴浸提后酶活性最低,而水或磷酸缓冲盐溶液室温搅拌提取后较高,结合实际生产应用,最终确定为用水搅拌提取。
2.2.2 正交试验 在“2.2.1” 项下结果基础上,选择粒度(A,10、20、40 目)、加水量(B,8、10、12 倍)、提取时间(C,15、30、45 min)、提取次数(D,1、2、3 次) 作为影响因素,酶活性为评价指标,采用L9(34) 正交试验表,结果见表2,方差分析见表3。由此可知,各因素影响程度依次为A>D>C>B,最优水平为A3B2C1D3; 因素A有显著影响(P<0.05),B、C、D无显著影响(P>0.05)。最终确定,最优提取工艺为黄芩茎叶粉碎后过40 目筛,室温下加10 倍量水(第1 次多加4 倍药材吸水量) 搅拌提取3 次,每次15 min,8 000 r/min 离心8 min,合并上清液。

表2 正交试验设计与结果Tab.2 Design and results for orthogonal tests
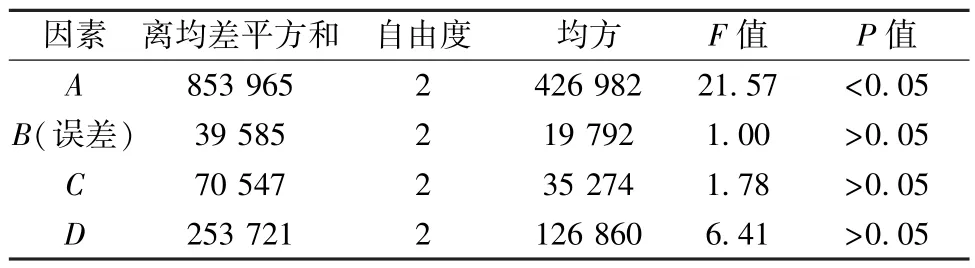
表3 方差分析结果Tab.3 Results for analysis of variance
按上述优化工艺进行3 批验证试验,测得酶活性分别为1 621、1 554、1 610 U/g,平均值为1 595 U/g (RSD=2.27%),表明该工艺稳定可行,重复性良好。
2.3 酶学性质研究 参考文献[10-12] 报道。
2.3.1 底物浓度、动力学常数测定 分别配制2.2、4.3、6.5、8.6、10.8 mmol/L 黄芩苷溶液,按“2.1” 项下方法测定酶活性,考察底物浓度与酶解速度的关系,结果见图2,再通过Lineweaver-Burk 双倒数作图,计算最大反应速率Vmax、米氏常数Km(Km表示酶与底物结合的难易程度,其数值越小,底物与酶的亲和力越大),结果见图3。由此可知,底物浓度与酶解速度的关系符合酶促动力学,拟合方程为Y=0.000 09X+0.014 2 (R2=0.994 2,其中X为1/[S],Y为1/V),Vmax为70.42 μmol/h,Km为0.006 3 mol/L。
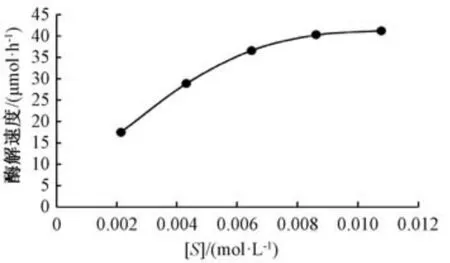
图2 底物浓度与酶活性的关系Fig.2 Relationship between substrate concentration and enzymatic activity
2.3.2 pH 值对酶活性的影响 使sbslGUS 酶解体系分别处于不同pH 值 (4.0、5.0、5.5、6.0、6.5、7.0、8.0) 环境中,按“2.1” 项下方法测定酶活性,以100%为最高值计算相对酶活性,结果见图4。由此可知,最适pH 值为6.0,与文献[13] 报道接近; 酶活性在pH 值5.54 ~6.55 下较高,并且过高或过低都会影响酶构象,从而影响其与底物的结合能力,导致其活性降低[14]。

图4 pH 值对酶活性的影响Fig.4 Effect of pH value on enzymatic activity
2.3.3 pH 稳定性研究 将sbslGUS 分别置于不同pH 值(4.0、5.0、6.0、7.0、8.0) 下保持4、8、12、24、36 h 后立即取出,按“2.1” 项下方法测定酶活性,结果见图5。由此可知,sbslGUS 在pH 4.0~7.0 范围内稳定性良好,36 h 内相对酶活性均大于85%。

图5 不同时间点sbslGUS pH 稳定性Fig.5 pH stabilities for sbslGUS at different time points
2.3.4 温度对酶活性的影响 固定pH 值6.0,在不同温度 (4、20、30、40、45、50、55、60、70 ℃) 下按 “2.1” 项下方法测定酶活性,以100%为最高值计算相对酶活性,结果见图6。由此可知,酶活性在4 ~45 ℃下呈缓慢升高的趋势,以40~60 ℃更明显,但60 ℃后明显降低,最终确定为45 ℃。

图6 温度对酶活性的影响Fig.6 Effect of temperature on enzymatic activity
2.3.5 热稳定性研究 将sbslGUS 分别置于不同温度下保持一定时间(4、30 ℃下保持4、8、12、24、48 h,45、50、60 ℃下保持0.5、1、2、3、4 h),于对应时间点取出,按“2.1” 项下方法测定酶活性,以最初提取的酶活性为100%计算相对酶活性,结果见图7。由此可知,sbslGUS 在4 ~30 ℃下热稳定性较高,45 ℃下逐渐降低,50 ℃以上后明显降低。
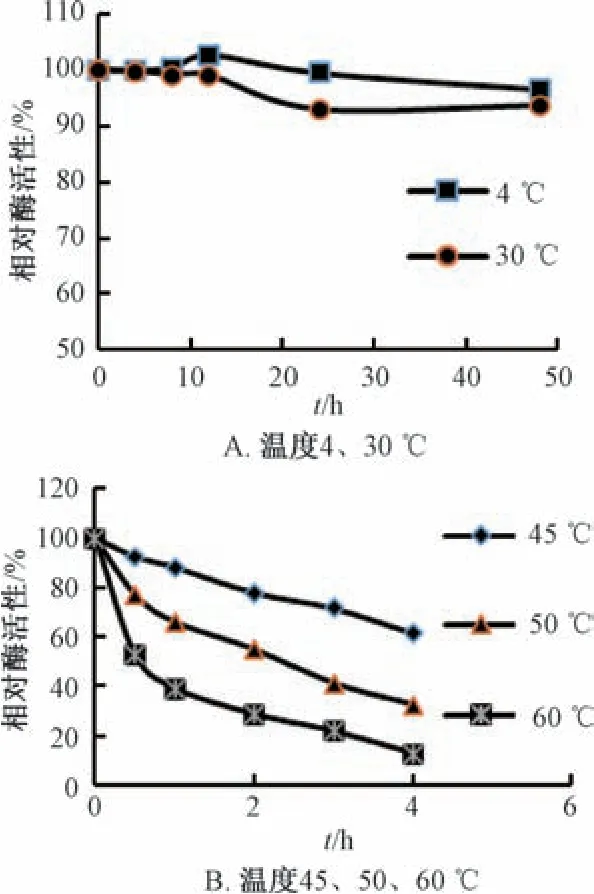
图7 不同温度sbslGUS 热稳定性Fig.7 Thermal stabilities for sbslGUS at different temperatures
2.3.6 金属离子对酶活性的影响 将sbslGUS 分别与不同浓度(10、50、100 mmol/L) 金属离子(Na+、K+、Cu2+、Mg2+、Ca2+) 等体积混合后,室温静置1 h,按“2.1” 项下方法测定酶活性,以同等条件下sbslGUS 与等体积去离子水混合后的酶活性为100%计算相对酶活性,结果见图8。由此可知,Na+、K+、Ca2+、Mg2+对酶活性影响不大,而Cu2+能激活酶活性,并且作用随着其浓度升高而增强,在100 mmol/L 时提高了约300%。

图8 金属离子对酶活性的影响Fig.8 Effect of metal ion on enzymatic activity
2.4 实际应用研究 参考文献[15-17] 报道,用sbslGUS 酶解黄芩苷以制备黄芩素。
2.4.1 供试品溶液制备 精密量取268.8 mmol/L黄芩苷溶液1 mL,加入适量sbslGUS 提取液,磷酸缓冲盐溶液补充至4 mL,在上述条件下酶解反应一定时间,加入3 倍酶解体系量乙醇终止反应,转移至50 mL 量瓶中,加70%乙醇超声处理20 min,放置至室温,70% 乙醇定容至刻度,精密量取1 mL,置于50 mL 量瓶中,70%乙醇定容至刻度,摇匀,滤过,取续滤液,即得。然后,在“2.1.2” 项色谱条件下进样测定,计算黄芩苷酶解转化率,公式为转化率= [m2×M1/(m1×M2)]×100%,其中m1为黄芩苷实际投入量,m2为黄芩素实际测得量,M1为黄芩苷相对分子质量,M2为黄芩素相对分子质量。
2.4.2 pH 值对转化率的影响 精密量取268.8 mmol/L 黄芩苷溶液、sbslGUS 提取液各1 mL,加入不同pH 值的磷酸缓冲盐溶液2 mL,使酶解体系pH 值分别为5.0、5.5、5.8、6.0、6.5,反应12 h,按“2.4.1” 项下方法测定转化率,结果分别为20.61%、71.86%、95.19%、95.25%、90.68%,最终确定为6.0。
2.4.3 温度对转化率的影响 精密量取268.8 mmol/L 黄芩苷溶液、sbslGUS 提取液各1 mL,加入pH 6.0 的磷酸缓冲盐溶液2 mL,分别在30、40、45、50、55 ℃下反应12 h,按“2.4.1” 项下方法测定转化率,结果分别为83.03%、89.33%、97.25%、48.14%、34.02%,最终确定为45 ℃。
2.4.4 反应时间对转化率的影响 精密量取268.8 mmol/L 黄芩苷溶液、sbslGUS 提取液各1 mL,加入pH 6.0 的磷酸缓冲盐溶液2 mL,置于45 ℃水浴锅中,分别酶解2、4、8、10、12、24 h,按“2.4.1” 项下方法测定转化率,结果分别 为 33.73%、55.32%、90.58%、94.03%、98.01%、98.19%,最终确定为12 h 以上。
2.4.5 底物初始浓度对转化率的影响 黄芩苷与sbslGUS 提取液按0.269 mmol/1 mL 比例,加入pH 6.0 的磷酸缓冲盐溶液,制成黄芩苷浓度分别为22.4、44.8、67.2、89.6、112 mmol/L 的溶液,置于45 ℃水浴锅中酶解12 h,按“2.4.1” 项下方法测定转化率,结果分别为97.75%、98.26%、97.95%、95.68%、78.37%,符合酶促反应的中间络合物学说,为了提高生产效率和黄芩苷转化率,最终确定为67.2 mmol/L。
2.4.6 加酶量对转化率的影响 参考文献[8]报道,精密量取268.8 mmol/L 黄芩苷溶液1 mL,分别加入sbslGUS 提取液0.25、0.5、1、1.25、1.5 mL,pH 6.0 的磷酸缓冲盐溶液补足至4 mL,45 ℃水浴酶解12 h,按“2.4.1” 项下方法测定转化率,结果分别为30.37%、60.34%、95.67%、96.19%、96.53%,表明加酶量达到1 mL 时酶含量已经趋饱和,最终确定为1 mL/0.269 mmol 黄芩苷。
2.4.7 验证试验 根据“2.4.2” 至“2.4.6” 项下结果,得到最优制备工艺为pH 值6.0,温度45 ℃,反应时间12 h 以上,底物初始浓度67.2 mmol/L,加酶量1 mL/0.269 mmol 黄芩苷。按上述优化工艺进行3 批验证试验,测得转化率分别为97.50%、98.12%、97.86%,平均值为97.83%。
3 讨论
3.1sbslGUS 提取工艺 本实验首先采用文献[18] 报道的45 ℃浸泡提取黄芩糖苷酶,发现提取液酶活性远低于室温搅拌提取所得,并且水提取、缓冲盐提取酶液活性差异不大,故采用实际生产中更方便的加水搅拌提取。在筛选sbslGUS 提取条件的单因素、正交试验中发现,黄芩茎叶不同粉碎粒度对提取液酶活性有显著影响,40 目明显优于20 目; 黄芩茎叶酶水提时间15 min 优于30 min,推测可能是因为sbslGUS 被快速提取后与水液中某种物质(底物) 发生作用,从而时间延长,酶活性降低。
3.2sbslGUS 酶学性质 目前,转化黄芩苷生成黄芩素的糖苷酶主要通过真菌培养、基因克隆等[13,19],尚未发现黄芩茎叶中葡萄糖醛酸水解酶制备的报道。本实验发现,sbslGUS 以黄芩苷为底物时,最适酶活条件为pH 值6.0,温度45 ℃,酶解符合酶促反应动力学,Km为0.006 3 mol/L,Vmax为 70.42 μmol/h。另外,Na+、K+、Mg2+、Ca2+对sbslGUS 酶活性影响不大,而Cu2+对其有很强的激活作用,但它会使黄芩苷酶解转化率显著降低,推测可能是因为黄芩苷等黄酮类化合物与金属离子螯合形成配合物,从而阻碍酶解反应[15,20]。
3.3sbslGUS 实际应用 本实验以黄芩苷酶解转化率为评价指标,对sbslGUS 酶解pH、温度、反应时间、底物浓度、加酶量等进行考察,确定最佳反应条件为黄芩苷初始浓度67.2 mmol/L,pH 值6.0,温度45 ℃,sbslGUS 提取液加入量1 mL/0.269 mmol 黄芩苷,反应时间不少于12 h,黄芩素产率达95%以上,可为黄芩苷类结构转化和从天然植物中酶解提取生理活性更强的苷元类成分提供参考。
