岩藻黄素对小鼠非酒精性脂肪性肝病的修复作用
2024-03-10任祥雨郑佳文田笑笑曹洪杰李航婷唐云平杨最素
任祥雨,郑佳文,田笑笑,曹洪杰,李航婷,唐云平,杨最素
(浙江海洋大学食品与药学学院,浙江省海洋生物医用制品重点工程技术研究中心,浙江 舟山 316022)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种与酒精无关的、以弥漫性肝细胞大泡性脂肪变性为主要特征的一类临床病理综合征。NAFLD可从脂肪变性发展为非酒精性脂肪性肝炎、纤维化、肝硬化,容易发展为癌症,是目前最常见的慢性肝脏疾病[1]。NAFLD的全球患病率为25%,NAFLD已成为全球关注的公共健康问题,患者会同时出现2型糖尿病、高血脂、高血压和心脑血管疾病等并发症[2]。目前,临床上缺乏针对NAFLD的特效药物。尽管NAFLD发病机制尚未完全明晰,但肝脂质聚积所致的氧化应激、炎性应激等是导致疾病发生发展的重要机制[3]。研究显示,高脂饮食是导致NAFLD的形成与发生的重要因素[4]。NAFLD患者通常会出现体脂和肝质量的增加、血脂水平变化以及肝脂肪病变,并伴随着炎症的发生。因此对于NAFLD的预防和治疗仍然强调健康的生活方式和降低体质量的重要性。
已有的研究表明,从海洋褐藻中提取的非VA类胡萝卜素——岩藻黄素是一种呈橙红色的粉末状物质,其分子式为C42H58O6,密度为1.09 g/cm³,熔点为166~168 ℃。其不溶于水,易溶于有机溶剂,稳定性较差,但具有强大的抗氧化、减轻炎症等生理活性,且分子质量很小,很容易被生物体吸收[5]。本实验室前期研究发现,岩藻黄素对小鼠急性酒精性肝损伤具有保护作用,其机制是激活核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)介导的抗氧化防御和抑制由Toll样受体(Toll-like receptor,TLR)介导的炎症机制相关[6]。此外,还发现岩藻黄素可以改善体外NAFLD细胞模型中的脂质沉积,降低炎症因子白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的释放,通过抑制TLR4信号通路的关键蛋白并通过过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptors α,PPARα)途径改善Chang liver细胞脂质代谢平衡而发挥作用[7]。然而岩藻黄素对高脂饲料诱导C57BL/6J小鼠建立的NAFLD模型是否具有修复作用目前报道不多。本实验通过给予8 周高脂饲料喂养小鼠,建立小鼠非酒精性脂肪性肝病的动物模型后,从体内途径通过检测小鼠生理、生化指标的变化,肝脏中主要抗氧化酶和炎症因子的水平、降脂抗炎信号传导途径相关蛋白表达的变化,来探究岩藻黄素对高脂饮食诱导的小鼠NAFLD的修复作用机制,为开发海洋来源的天然抗氧化剂在慢性肝病中的防治作用提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
雄性C57BL/6J小鼠52 只(4 周龄,体质量为16~18 g),购自浙江省实验动物中心(生产许可证号:SCXK 2014-0001)。实验小鼠均在本校SPF级动物房(SYXK(浙)2014-0013)中饲养,饲养条件为24~26 ℃、60%相对湿度、12 h光/暗循环控制条件,自由进食进水(全营养灭菌饲料,去离子水),适应性饲养1 周后对所有小鼠进行称质量并分组开始实验。
60%高脂实验鼠粮(D12492)苏州双狮实验动物饲料科技有限公司;岩藻黄素(70%)山东洁晶集团股份有限公司;脂联素、瘦素试剂盒 武汉伊莱瑞特生物科技股份有限公司;低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、游离脂肪酸(free fatty acid,FFA)、脂多糖(lipopolysaccharide,LPS)和糖原染色(periodic acidschiff stain,PAS)试剂盒 南京建成生物工程研究所;苏木精-伊红(hematoxylin-eosin,H&E)染色试剂盒上海碧云天生物技术有限公司;DAB免疫组织化学试剂盒博士德生物工程有限公司;BCA蛋白浓度测定试剂盒、三羟甲基氨基甲烷、ECL Plus超敏发光液、20×TBS、牛血清白蛋白V 北京索莱宝科技有限公司;甲醇、吐温80 国药集团化学试剂有限公司;甘氨酸上海麦克林生化科技股份有限公司;十二烷基硫酸钠GEN-VIEW科技有限公司;NAD(P)H-醌氧化还原酶1(NAD(P)H quinone oxidoreductase 1,NQO1)、血红素氧合酶1(heme oxygenase-1,HO-1)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein-1,Keap-1)、Nrf2、谷氨酸-半胱氨酸连接酶(glutamatecysteine ligase modifier,GCLM)、5’-单磷酸腺苷活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)、磷酸化乙酰辅酶A羧化酶(p-acetyl-CoA carboxylase,p-ACC)、肉碱脂酰转移酶1(carnitine acyl transferase 1,CPT-1)、固醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)、PPARα、磷酸化5’-单磷酸腺苷活化蛋白激酶(p-adenosine 5’-monophosphate-activated protein kinase,p-AMPK)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪酸合酶(fatty acid synthase,FAS)武汉三鹰生物科技有限公司;TLR4、髓样分化因子88(myeloid differentiation factor 88,MyD88)、磷酸化人核因子κB抑制蛋白α(p-nuclear factor κB inhibitory protein α,p-IκBα)、磷酸化核因子κB(p-nuclear factor kappa-B,p-NF-κB)蛋白 上海碧云天生物科技有限公司。
1.2 仪器与设备
CX31型光学显微镜 日本OLYMPUS公司;RM2135型切片机、HI1210型摊片机、H1220型烤片机德国Leica公司;SpectraMax型酶标仪、Mini sub cell型电泳系统 美国Bio-Rad公司;BSA124S型电子天平德国Satorius AG公司;CF16RX II型高速低温离心机日本日立公司;Fluor Chem FC3型化学发光成像分析系统美国ProteinSimple公司。
1.3 方法
1.3.1 动物分组
实验动物分组情况如图1所示,适应性喂养1 周后,随机挑选14 只小鼠喂养普通饲料(Con组),其余38 只小鼠均给予高脂饲料进行自由进食,8 周后,从Con组和高脂饲料(high fat diet,HFD)组中各挑选小鼠2 只,进行血清生化指标检测和肝脏组织学观察,发现高脂饲料组中血清生化指标(谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)等)明显高于Con组,且伴有肝细胞中的空泡样脂肪沉着,表明NAFLD小鼠模型建立成功。然后将喂养高脂饲料的小鼠随机分为3 组(每组12 只)进行灌胃治疗,每日1 次,连续6 周:1)普通饲料+生理盐水(HFD组);2)普通饲料+20 mg/kgmb岩藻黄素(Fx-20组);3)普通饲料+40 mg/kgmb岩藻黄素(Fx-40组)。每周记录小鼠的体质量。第14周结束时小鼠禁食12 h后全部处死。肝脏、脂肪解剖离体后立即称质量并进行观察拍照,所有组织和血清按实验所需要保存备用。

图1 小鼠分组和实验方法Fig.1 Grouping and treatments of mice
1.3.2 小鼠Lee’s指数的计算
根据小鼠的体质量与体长,计算Lee’s指数。其计算公式为:
1.3.3 小鼠血清生化指标的测定
小鼠眼球取血,4 ℃、10000 r/min离心5 min取血清。血清样本收集后于-80 ℃储存,谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)活力,总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、LDL-C、HDL-C、游离脂肪酸(free fatty acid,FFA)脂联素和瘦素含量按试剂盒说明书进行测定。
1.3.4 小鼠肝脏中炎症因子和抗氧化指标的测定
称取一定质量的肝脏,用生理盐水均质处理制成10%的匀浆液,混合液以4000 r/min离心10 min后,取上清液,依照试剂盒操作说明对肝脏中炎症因子IL-1β、IL-6、TNF-α以及抗氧化指标MDA、SOD、谷胱甘肽(glutathione,GSH-Px)、CAT含量进行测定。
1.3.5 小鼠组织切片和形态学分析
1)H&E染色和PAS:小鼠肝脏、脂肪组织取出后,切成1 cm2大小立即放入4%中性甲醛固定液中固定,经脱水、包埋、制片,按说明书染色后,在光学显微镜下观察并拍照。
2)油红O染色:小鼠肝组织取出后经常规方法进行冰冻切片,按试剂盒说明进行油红O染色,光学显微镜下观察并拍照。
3)透射电镜观察:小鼠肝组织取出后,切成0.5 cm2大小立即放入2.5%戊二醛固定液中固定,委托浙江大学电镜中心进行透射电镜观察。
1.3.6 蛋白免疫印迹法检测小鼠肝脏中相关蛋白的表达情况
提取肝脏中蛋白:液氮中研磨肝组织,加入预先配制含有蛋白酶抑制剂的RIPA裂解液并充分混匀,4 ℃条件下10000 r/min离心10 min,取上清液,BCA法测定各个样品的蛋白浓度,加入适量的5×蛋白上样缓冲液并在95 ℃金属浴条件下10 min致蛋白质变性,封口后于-20 ℃保存。蛋白免疫印迹法参考Ren Xiangyu等[8]方法进行。
1.3.7 免疫组织化学法观察小鼠肝脏中p-AMPK、p-ACC、FAS的表达
小鼠肝脏切片至5 μm厚,脱蜡至水,EDTA高温高压进行修复抗原,3% H2O2封闭内源性过氧化物酶10 min,37 ℃、5% BSA封闭30 min,一抗4 ℃孵育过夜,二抗孵育30 min,滴加DAB显色,镜下控制时间,苏木素染核2 min,脱水、透明、中性树胶封片后在光学显微镜下观察各蛋白的表达情况并拍照,随后用ImageJ软件对各蛋白表达量进行半定量分析。
1.4 数据统计与分析
2 结果与分析
2.1 岩藻黄素对小鼠体质量和肝脏指数的影响
如图2所示,饲喂高脂饲料的小鼠出现明显的体质量上升和竖毛现象。第9周开始用岩藻黄素干预后,小鼠体质量开始下降,特别是Fx-40组的小鼠体质量接近于Con组。此外,和Con组相比,HFD组小鼠的肝脏指数和Lee’s指数也显著上升(P<0.01),而岩藻黄素组逆转了这一现象,Fx-40组小鼠的肝脏指数和Lee’s指数与Con组相比无显著差异(P>0.05)。说明岩藻黄素对抑制高脂饮食引起的体质量和肝质量增加效果明显。
图2 岩藻黄素对NAFLD小鼠体质量、肝脏指数的影响Fig.2 Effect of fucoxanthin on body mass and liver index in NAFLD mice
2.2 岩藻黄素对小鼠脂肪质量的影响
相较于皮下脂肪,内脏脂肪的显著增加更能直观地反映出小鼠存在代谢紊乱、肥胖等健康问题。如图3所示,HFD诱导后小鼠体内附睾和肾周脂肪明显增多,与HFD组相比,用岩藻黄素干预的小鼠脂肪质量显著减少(P<0.01)。同时,对各组的附睾脂肪进行H&E染色,结果显示,与Con组相比,HFD组小鼠附睾脂肪细胞明显增大,而经岩藻黄素处理后小鼠的附睾脂肪细胞明显减小。

图3 岩藻黄素对NAFLD小鼠脂肪质量的影响Fig.3 Effect of fucoxanthin on fat mass in NAFLD mice
2.3 岩藻黄素对小鼠血清ALT和AST活力的影响
血清ALT、AST的检测结果如图4所示,对比Con组,HFD组的ALT和AST活力出现了异常升高。而与HFD组相比,岩藻黄素给药组小鼠血清中的ALT和AST活力均显著降低(P<0.01)。
图4 岩藻黄素对NAFLD小鼠血清ALT(A)和AST(B)水平的影响Fig.4 Effect of fucoxanthin on the serum levels of ALT (A) and AST (B)in NAFLD mice
2.4 岩藻黄素对小鼠血脂水平的影响
小鼠血清中脂质代谢参数TG、TC、LDL-C、HDL-C和FFA的含量如表1所示。相较于Con组,HFD组小鼠血清中TG、TC、LDL-C和FFA含量均显著升高(P<0.01),而HDL-C则显著性下降(P<0.01)。与此同时,岩藻黄素组中小鼠的TG、TC、LDL-C和FFA含量相较于HFD组则显著下降(P<0.01),并且基本恢复到正常水平,而HDL-C含量明显升高。

表1 岩藻黄素对NAFLD小鼠血脂水平的影响Table 1 Effect of fucoxanthin on blood lipid levels in NAFLD micemmol/L
2.5 岩藻黄素对小鼠血清脂联素和瘦素水平的影响
如图5所示,HFD诱导使小鼠血清中脂联素水平下降,瘦素水平上升。而与HFD组相比,岩藻黄素可降低血清中瘦素水平,并增加脂联素的分泌。
图5 岩藻黄素对NAFLD小鼠血清脂联素(A)和瘦素(B)水平的影响Fig.5 Effect of fucoxanthin on the serum levels of adiponectin (A) and leptin (B) in NAFLD mice
2.6 岩藻黄素对小鼠肝脏组织学结构的影响
各组小鼠解剖后,取出肝脏用生理盐水清洗后观察其形态的变化。如图6所示,可见Con组小鼠肝脏体积较小,呈鲜艳的暗红色,相比之下,HFD组肝脏体积变大,颜色偏黄无光泽,经岩藻黄素处理后肝脏的体积减小,颜色与正常相近呈暗红色。
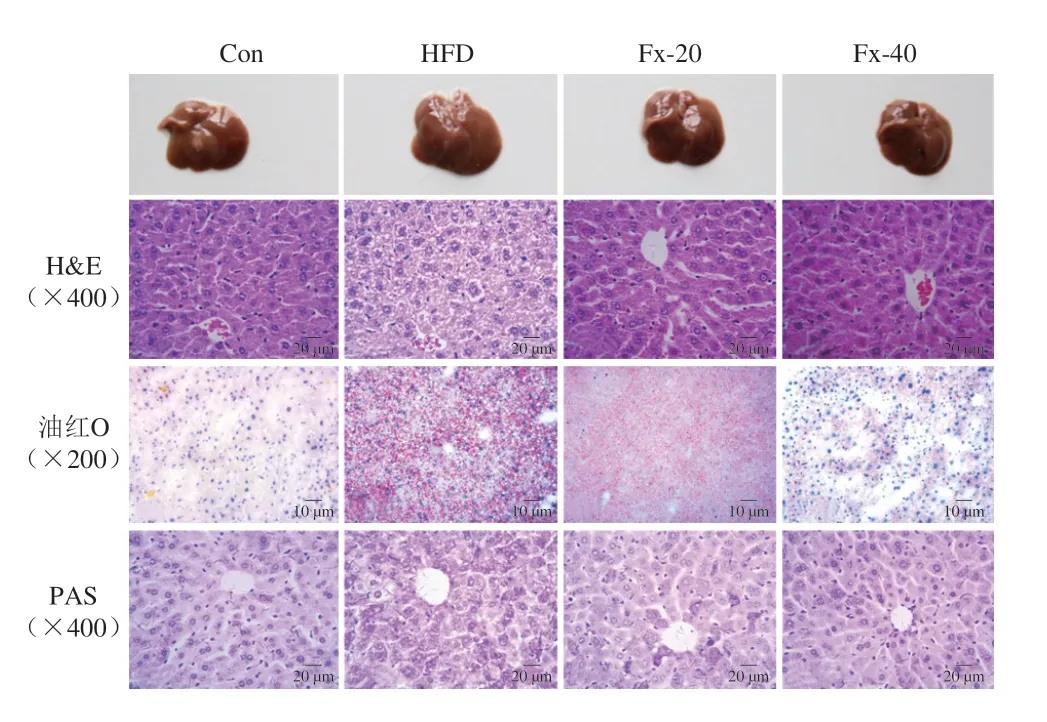
图6 岩藻黄素对NAFLD小鼠肝脏组织形态学的影响Fig.6 Effect of fucoxanthin on morphological characteristics of liver tissue in NAFLD mice
H&E染色结果显示,Con组小鼠的肝索呈放射状排列在中央静脉周围、肝细胞胞质内少见脂肪滴。而HFD组的肝索排列紊乱,细胞质出现大量空泡样变性。经岩藻黄素处理后肝组织修复较好,肝索排列整齐,细胞质中空泡较少。
油红O染色阳性部位呈红色颗粒,从图6可以看出,HFD组肝组织较Con组出现大量的脂质沉积,细胞内可见不同大小的脂滴。而岩藻黄素组切片显示细胞内脂滴分布明显减少。
PAS阳性部位为细胞质内出现的紫红色区域,从图中可见,HFD组细胞内与细胞间糖原染色明显增多,糖原颗粒明显。岩藻黄素组的糖原阳性区域明显减少。
2.7 岩藻黄素对小鼠肝脏超微结构的影响
如图7所示,Con组小鼠肝脏细胞内细胞器丰富,核膜清晰;HFD组小鼠肝脏中出现大量大小不一、电子密度低的白色圆形脂滴,同时细胞器结构模糊,粗面内质网减少,滑面内质网肿胀,核膜不清晰。经岩藻黄素干预后,内质网的数量增多,脂滴数量明显减少,线粒体明显增多。

图7 岩藻黄素对NAFLD小鼠肝脏超微结构的影响Fig.7 Effect of fucoxanthin on ultrastructure of liver tissue in NAFLD mice
2.8 岩藻黄素对小鼠肝脏脂质过氧化的影响
如图8所示,MDA是细胞膜脂质过氧化的标志性产物,与Con组相比,HFD组MDA含量显著增高(P<0.01),而相较于HFD组,岩藻黄素组小鼠肝脏中MDA的含量明显降低。肝脏中SOD、GSH-Px和CAT是体内固有抗氧化防御系统的标志物,与Con组相比,HFD组中SOD、GSH-Px和CAT的活性显著下降(P<0.01),而岩藻黄素干预可以逆转由HFD引起的小鼠肝脏中抗氧化酶活力的下降,使其呈剂量依赖性增加。
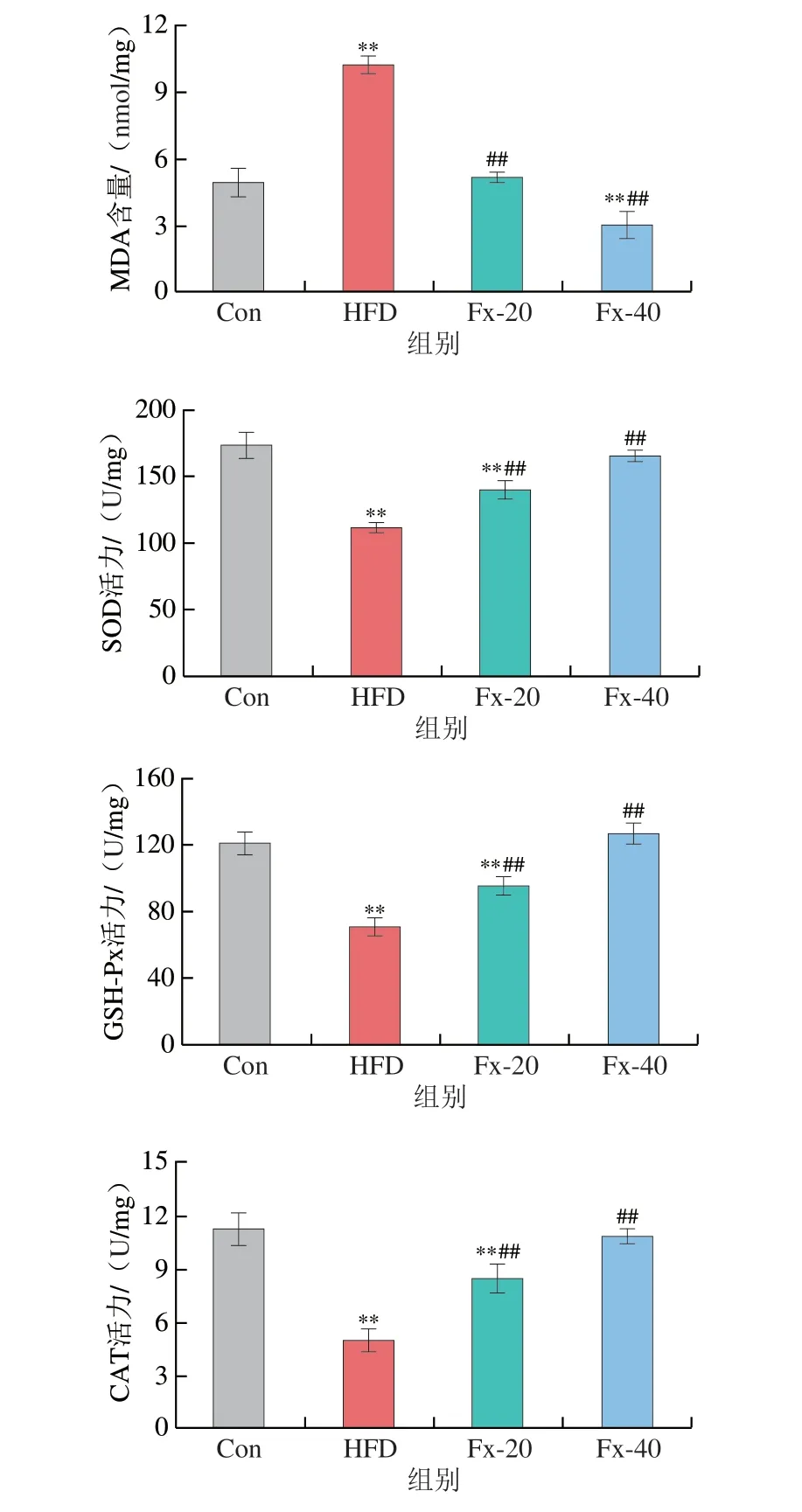
图8 岩藻黄素对NAFLD小鼠肝脏脂质过氧化的影响Fig.8 Effect of fucoxanthin on lipid peroxidation of liver tissue in NAFLD mice
2.9 岩藻黄素对小鼠肝脏中炎症因子水平的影响
为探究岩藻黄素对HFD诱导小鼠NAFLD炎症水平的影响,检测了血清中炎性因子IL-1β、IL-6和TNF-α的质量浓度。如图9所示,相较于Con组,HFD组小鼠肝脏中IL-1β、IL-6和TNF-α质量浓度均显著增加(P<0.01),而与HFD组相比,岩藻黄素组这3 种因子的质量浓度均显著下降(P<0.01)。
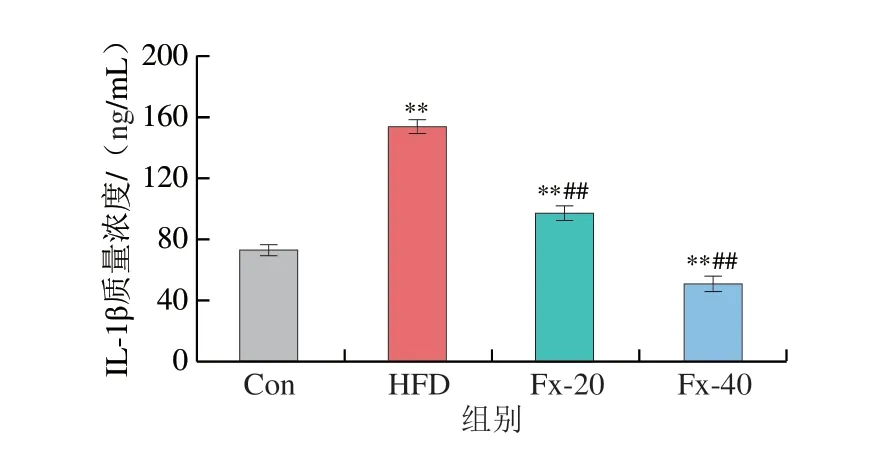

图9 岩藻黄素对NAFLD小鼠肝脏中炎症因子质量浓度的影响Fig.9 Effect of fucoxanthin on the levels of inflammatory cytokines in liver tissue of NAFLD mice
2.10 岩藻黄素对AMPK通路相关蛋白表达的影响
如图10所示,相较于Con组,HFD组小鼠肝脏中p-AMPK、PPARα蛋白表达水平显著降低(P<0.01),SREBP-1c、FAS蛋白的表达上升;给予岩藻黄素干预后p-AMPK和PPARα的蛋白表达水平显著上升(P<0.01),SREBP-1c表达下降,上调p-ACC、CPT-1蛋白和抑制FAS蛋白的表达。

图10 岩藻黄素对NAFLD小鼠肝脏中AMPK通路相关蛋白表达的影响Fig.10 Effect of fucoxanthin on the expression of proteins associated with AMPK signaling pathway in liver tissue of NAFLD mice
为了进一步证实该结论,采用免疫组织化学法检测小鼠肝脏组织中p-AMPK、p-ACC和FAS蛋白的表达,细胞质中出现的棕黄色结构即为阳性部位。如图11所示,经各蛋白的半定量分析结果可以看出,免疫组织化学的结果与蛋白免疫印迹法结果一致。
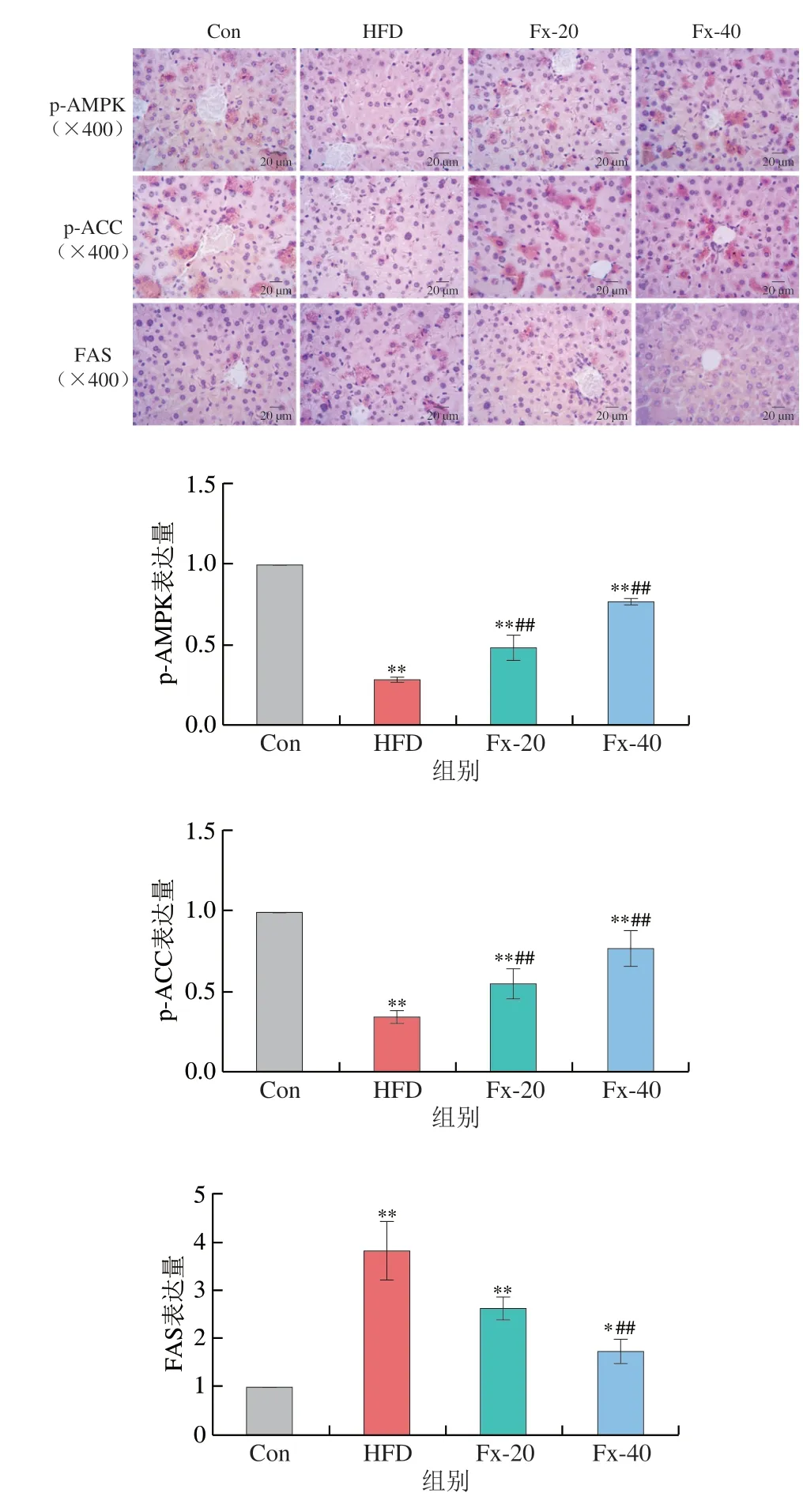
图11 免疫组织化学法检测NAFLD小鼠肝脏中p-AMPK、p-ACC和FAS光学显微镜照片和蛋白表达情况Fig.11 Immunohistochemical results of optical microscope photo and the protein expression of p-AMPK,p-ACC and FAS in liver tissue of NAFLD mice
2.11 岩藻黄素对Nrf2通路相关蛋白表达的影响
为进一步探讨岩藻黄素对NAFLD小鼠氧化应激关键调控蛋白的影响,检测了Keap/Nrf2通路关键蛋白的表达。如图12所示,HFD喂养后可显著提高小鼠肝脏中Keap-1的水平(P<0.01),同时抑制Nrf2及其下游抗氧化蛋白HO-1、NQO1和GCLM的表达水平。岩藻黄素给药组显著改变了这些蛋白的表达水平(P<0.01),与Con组的表达情况一致,说明岩藻黄素可以通过激活Nrf2介导的抗氧化反应,从而减轻HFD对小鼠肝脏造成的氧化应激。
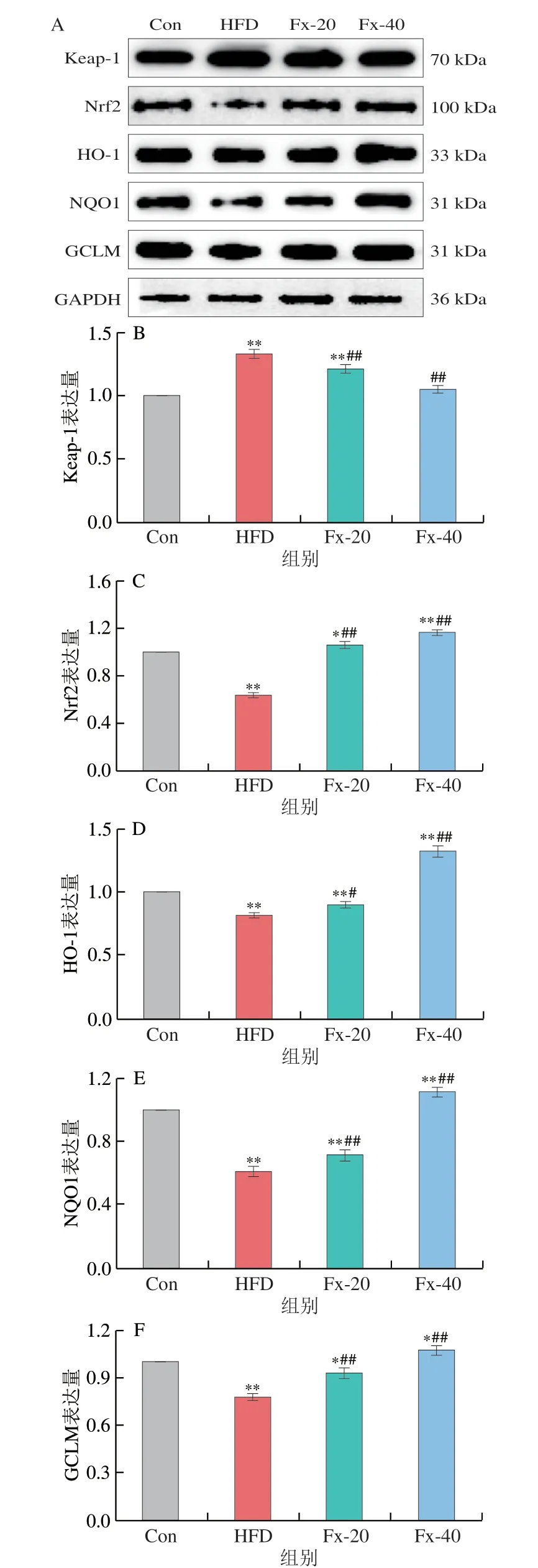
图12 岩藻黄素对NAFLD小鼠肝脏中Nrf2通路相关蛋白表达的影响Fig.12 Effect of fucoxanthin on the expression of proteins associated with the Nrf2 signaling pathway in liver tissue of NAFLD mice
2.12 岩藻黄素对TLR4通路相关蛋白表达的影响
TLR4信号通路与NAFLD发展过程密切相关,从图13可以看出,相较于Con组,HFD组小鼠肝脏中TLR4表达显著上调(P<0.01),同时启动下游信号级联,诱导MyD88、p-IκBα和p-NF-κB (p65)表达显著上调(P<0.01)。而岩藻黄素有效抑制了这些蛋白的上调,表明岩藻黄素能通过减少TLR4蛋白的表达,继而抑制其与下游MyD88的结合,减少炎症因子的合成及活化,从而达到抑制炎症产生、缓解肝脏损伤的目的。

图13 岩藻黄素对NAFLD小鼠肝脏中TLR4通路相关蛋白表达的影响Fig.13 Effect of fucoxanthin on the expression of proteins associated with the TLR4 signaling pathway in liver tissue of NAFLD mice
3 讨论
随着生活方式及饮食习惯的改变,全球代谢综合征患病率不断上升,NAFLD已取代病毒性肝病成为全球第一肝病,对病人的身体造成严重的影响并加重了经济负担。然而NAFLD尚无明确的发病机制,缺乏有效的防治方法[9]。目前的“多重打击假说”已取代了“二次打击”,从最初的脂质堆积和单纯脂肪变性,逐渐演变为线粒体功能障碍、氧化应激、脂肪和细胞因子改变等,最终导致NAFLD发展为非酒精脂肪性肝炎[10],因此减脂、抗氧化应激、抗炎症反应仍是防治的要点[11-12]。
本实验发现,经高脂饮食诱导可成功建立NAFLD模型,表现为小鼠体质量异常增加,肝脏指数和Lee’s指数增加,肝组织结构中出现大量的脂滴堆积,附睾和肾周脂肪的质量增加及脂肪细胞体积增大,肝功能敏感指标ALT、AST升高,并伴有血清TG、TC和LDL-C等血脂水平的增高,而给予岩藻黄素后改善了这些异常表现,使肝的形态结构、肝功能敏感指标和血脂水平恢复到正常范围。同时使用岩藻黄素后减轻了氧化应激水平,表现为SOD、GSH-Px和CAT水平的升高,MDA水平的降低;炎症因子IL-1β、IL-6和TNF-α的质量浓度呈现明显下降,表明岩藻黄素通过抑制脂质水平和减轻氧化应激改善小鼠NAFLD,这与文献报道的修复NAFLD的活性物质的机制[13-14]相似。另有研究表明,肥胖小鼠的脂肪组织可分泌过量的瘦素,并与下丘脑神经元上的瘦素受体发生结合,从而降低食欲,减轻体质量[15]。脂联素也是由脂肪细胞分泌产生,可调节血清中的葡萄糖和脂质水平,并减少肝脏中的脂质积累[16],实验中给予岩藻黄素改善NAFLD的作用可通过降低血清中瘦素水平、升高脂联素的分泌而实现。
AMPK可通过调节脂质分解代谢和合成代谢来改善能量代谢的激酶,并调节相关基因和蛋白的表达,因此是代谢疾病的潜在治疗靶标。AMPK活化可能通过抑制肝脏中的脂肪生成、增加ACC的磷酸化来改善脂肪酸氧化,抑制NAFLD[17]。AMPK信号通路活化可以改善NAFLD小鼠肝脏的脂质沉积[18]。在NAFLD中,PPARα的激活可预防TG的积累,调节炎症反应[19];并可通过诱导CPT-1表达而增加游离脂肪酸氧化[20]。而AMPK是下游ACC、SREBP-1c和FAS的主要激酶调节因子[21-22],其中ACC主要存在于合成脂类组织的细胞质中[23];SREBP-1c是一种细胞质转录因子,主要被胰岛素激活,在脂质合成的诱导中起核心作用[24];FAS是脂肪酸从头合成的关键酶[25],其过表达会导致大量脂肪酸的合成,SREBP-1c通过刺激FAS来诱导脂肪酸和TG的合成。有研究表明,在糖尿病小鼠模型中岩藻黄素能通过激活AMPK调节糖原生成[26-27]。因此检测AMPK通路的相关蛋白可判断岩藻黄素是否激活该通路影响能量代谢。本实验结果表明,在HFD组中,AMPK通路蛋白受到抑制,同时脂质合成关键蛋白的表达增加,而岩藻黄素改变了这一现象:激活AMPK通路,通过PPARα途径改善肝脏脂质代谢平衡,减少脂质的生成,促进NAFLD修复。
脂质积累的衰减和氧化应激的抑制将是治疗NAFLD的有效方法[28]。Nrf2信号作为关键的细胞防御系统,通过调节一系列基因来防止病理性损伤[29]。Nrf2信号还参与负控制脂质积累,不仅通过抑制FFA摄取因子,也可通过激活PPARα信号来调节脂肪酸代谢和转运[30]。Nrf2通过参与脂质代谢、炎症和抗氧化反应的调节,在NAFLD的发展中起关键作用[31]。有报道称,橘子素通过Nrf2途径改善高脂肪饮食诱导的NAFLD小鼠的肝脂肪变性和氧化应激[32]。本实验通过检测Keap/Nrf2介导的抗氧化通路相关蛋白的表达,发现岩藻黄素可明显降低Keap-1的水平,增加Nrf2及其下游抗氧化蛋白HO-1、NQO1和GCLM的表达水平,因此岩藻黄素通过调节肝细胞抗氧化系统和脂质过氧化反应而发挥修复作用。
TLR4信号传导是先天免疫的关键组成部分,与NAFLD的发病机制有关,当其与特异性配体结合后,可通过系列的级联反应激活信号通路下游的炎症因子,导致肝脏损伤[33]。有研究证明,TLR4、MyD88、p-NF-κB/NF-κB的水平在HFD诱导的NAFLD大鼠肝脏中显著增加[34],本实验结果与此相似,即给予岩藻黄素后,这些相关的蛋白表达明显下降,表明岩藻黄素可通过TLR4/NF-κB途径介导其在NAFLD修复中的作用。
综上所述,本研究认为岩藻黄素对HFD诱导的小鼠NAFLD有一定的修复作用,通过调节脂质代谢、抑制氧化应激、调节炎症反应等多途径、多靶点起作用,从而对HFD诱导NAFLD的“多重打击”具有保护作用,为揭示岩藻黄素修复NAFLD的机制提供新的思路。
