大蒜多糖通过核因子-κB通路改善代谢相关脂肪性肝病小鼠肝脏损伤
2024-03-10玉王宁王成海程立媛
刘 杰,玉王宁,王成海,李 沙,程立媛,张 伟
(1.河北农业大学食品科技学院,河北 保定 071001;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056038;3.河北工程大学医学院,河北 邯郸 056038;4.河北工程大学附属医院,河北省血液净化应用基础研究重点实验室,河北 邯郸 056002;5.河北工程大学分析测试实验中心,河北 邯郸 056038;6.河北农业大学生命科学学院,河北 保定 071001)
代谢相关脂肪性肝病(metabolic-associated fatty liver disease,MAFLD),曾用名为非酒精性脂肪性肝病,是代谢综合征的一种肝脏表现,涉及从单纯脂肪变性到肝纤维化、肝硬化甚至肝细胞癌的复杂进展[1-2]。MAFLD全球患病率接近30%,严重危害人类健康并对社会造成巨大经济负担,至今在美国和欧盟尚无药物获批用于治疗该病。目前,关于MAFLD的致病机理有“二次打击”“多次打击”等多种理论,其中,曾经得到广泛认可的“二次打击”学说认为,第一次打击的肥胖、胰岛素抵抗等因素引发了肝细胞中脂质异常沉积,第二次打击的氧化应激、炎症、线粒体障碍、脂肪因子调节紊乱等,引起肝脏损伤及炎症,甚至肝纤维化等疾病发生。但是,随着新的研究领域的拓展和新的研究结论的提出,“二次打击”的观点在用于病理解释时出现了局限性。近年来,“多次打击”理论正在被更多的人接受,该理论认为肠道微生物发挥着重要的作用,强调通过“肠肝轴”起关键作用,进而导致脂肪毒性、氧化应激、线粒体功能障碍和肝细胞炎症等。
大蒜(Allium sativum)是一种在中国使用历史悠久的调味品和中药,已被正式批准为药食同源的食品原料,可用于治疗结核病、咳嗽、感冒、高血压、轻微血管疾病、糖尿病、肥胖、肾和肝损伤以及癌症[3]。大蒜多糖是大蒜干物质的主要成分[4],具有多种生理功能,包括抗肿瘤、提高免疫力、抗氧化和抗凝血作用、保护肝脏和平衡肠道微生物群[5-6]。大蒜多糖的骨架结构被鉴定为α-D-Glcp-1→(2-β-D-果糖-1)n→(n=9~10),侧链上可能附着有微量岩藻糖[7],结构与菊粉型果聚糖相似[8],它是一种潜在的益生元,可能具有增加益生菌多样性、改善肠黏膜和提高肠道免疫力的作用[9]。已有研究表明,大蒜多糖可以通过改善黏膜屏障、阻断促炎细胞因子和调节肠道微生物群缓解右旋糖酐硫酸酯钠诱导的结肠炎[7],然而,针对MAFLD探讨大蒜多糖肝保护作用的研究鲜有报道。本实验采用蛋氨酸胆碱缺乏(methionine-choline deficiency,MCD)饮食诱导小鼠构建MAFLD模型,探索大蒜多糖对MAFLD小鼠肝脏的保护作用机理,为以大蒜多糖为原料,具有保肝护肝功效特色食品的开发利用提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
雄性C57BL/6小鼠(6 周龄)购自斯贝福(北京)生物技术有限公司。
大蒜多糖 晨光生物科技集团有限公司;蛋氨酸胆碱充足(methionine-choline sufficient,MCS)饲料和MCD饲料 北京华富康生物科技有限公司;EasyPure®RNA纯化试剂盒、EasyScript®逆转录酶和TransStart Top Green定量PCR试剂盒 北京全式金生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;HH-4数显恒温水浴锅 常州国华电气有限公司;KZ-II组织破碎仪 武汉塞维尔生物科技有限公司;酶标仪、real-time聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;病理切片扫描仪 德国Leica公司;凝胶成像系统美国冷泉港公司;VERTEX 70v傅里叶变换红外光谱仪德国Bruker公司。
1.3 方法
1.3.1 大蒜多糖红外光谱分析
采用溴化钾压片法,称取大蒜多糖样品10 mg,按照质量比1∶200的比例加入溴化钾,充分研磨,然后放入压片机压片。采用傅里叶变换红外光谱仪在4000~400 cm-1波长范围内进行扫描,步长为4 cm-1。
1.3.2 小鼠模型的建立
50 只C57BL/6小鼠在温度((22±2)℃)、湿度(55%~65%)和12 h/12 h光/暗循环的标准条件下饲养,并且允许小鼠在抵达后适应1 周,随意饮用水和饲料。然后被随机分为5 组,分别为正常组(MCS)、模型组(MCD),大蒜多糖低(LGP,250 mg/kgmb)、中(M G P,1000 m g/k gmb)、高(H G P,3000 mg/kgmb)剂量组,每组10 只。开始实验时纪录各组小鼠体质量,并采用断指(趾)标记法对小鼠进行标号,实验期间记录小鼠体质量变化及饮食、精神状态等情况。MCS组食用MCS饲料,灌胃生理盐水;MCD、LGP、MGP、HGP组食用MCD饲料,分别灌胃生理盐水,低、中、高浓度大蒜多糖,连续实验28 d。
1.3.3 样本采集
第29天,各组小鼠严格禁食不禁水12 h,期间禁止灌胃大蒜多糖。然后在戊巴比妥钠麻醉下处死小鼠,记录体质量和肝脏质量,处死前从腔静脉采集血样,然后离心血清样本并保存在-80 ℃。一部分浸泡在生理盐水中的肝脏组织样本用4%的多聚甲醛溶液固定,然后嵌入石蜡块中,用于染色镜检。第二部分肝脏组织用于在冰水中制备肝匀浆(肝∶生理盐水=1∶9,g/mL),以供后续生理生化指标分析。剩余的肝脏组织在液氮中快速冷冻用于后续mRNA检测。
1.3.4 肝组织病理形态染色镜检
经过石蜡封存的肝脏组织分别采用苏木精-伊红(haematoxylin-eosin,H&E)染色和油红O染色两种方法处理,用光学显微镜观察组织学变化,以评估肝脂肪变性和炎症。
1.3.5 生化指标测定
甘油三酯(triglycerides,TG)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malonic dialdehyde,MDA)的水平采用南京建成生物工程研究所的试剂盒测量。
1.3.6 逆转录定量聚合酶链式反应
使用EasyPure®RNA纯化试剂盒提取-80 ℃保存的肝脏组织总RNA,并作为模板利用EasyScript®逆转录酶将其逆转录为cDNA。最后,通过使用TransStart Top GreenPCR试剂盒分析各种关键功能基因Hmox1、Cat、Gpx1、Tnf、Ccl2、Cxcl2、Cxcl10、IL-1a、IL-1b、Fasn、Cd36、Apob、Acaca、Fabp1、Mttp、Ppara、Ppard、Pparg、Cpt1a、Acox和Gapdh的mRNA表达。引物序列如表1所示。在以下条件下进行40 个循环的逆转录实时荧光定量PCR(reverse transcription quantitative real-time PCR,RT-qPCR):94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火并延伸30 s。目标基因的表达以Gapdh的表达作为内参标准,并使用2-ΔΔCt法进行mRNA水平的相对定量。

表1 用于RT-qPCR分析的引物序列Table 1 Primer sequences used for RT-qPCR
1.4 数据统计与分析
2 结果与分析
2.1 大蒜多糖的红外吸收色谱分析
分子结构鉴定是红外吸收光谱技术的基本应用之一,它主要利用了复杂分子的化学基团在分子被激发后所产生的特征振动。常见的化学基团在4000~670 cm-1范围内有特征基团频率,大概范围是:1)X—H伸缩振动区,4000~2500 cm-1,X可以是O、N、C和S原子;2)三键和累计双键区,2500~2000 cm-1;3)双键伸缩振动区,2000~1500 cm-1,主要包括C=C、C=O、C=N等;4)X—Y伸缩振动及X—H变形振动区,1500~400 cm-1[10]。大蒜多糖的红外吸收光谱如图1所示,特征吸收峰有:3375.0 cm-1处为—OH伸缩振动峰,2935.3 cm-1处为—CH2伸缩振动峰,1647.0 cm-1处为—CHO中的C=O伸缩振动峰,1456.1 cm-1处为—CH2变形振动峰,1132.1 cm-1和1026.0 cm-1处为吡喃糖环的C—O—C伸缩振动峰,933.4 cm-1处为呋喃果糖环的对称伸缩振动峰,817.7 cm-1处为呋喃果糖亚甲基(C—H)剪切振动峰[11-13]。根据上述红外光谱数据推测本研究所用的大蒜多糖为类菊粉结构的果聚糖。

图1 大蒜多糖红外吸收光谱图Fig.1 Infrared absorption spectrum of garlic polysaccharides
2.2 大蒜多糖对小鼠肝脏病理形态的影响
各组肝脏组织切片经H&E染色和油红O染色后(图2),在100 倍显微镜下观察可见MCS组小鼠肝脏组织形态结构正常,无脂肪变性,血管周围无炎症细胞浸润,无气球样变和纤维化改变。而MCD组小鼠肝组织中的肝小叶结构紊乱,肝束排列欠佳,出现大量脂肪变性,在镜检视野内可见大量混合型脂滴空泡充满胞质;透过变性脂肪,可见显著的胞浆肿胀、细胞核大浓染、肝细胞坏死的气球样变,以及出现肝纤维化;肝小叶及汇管区周围出现炎症细胞浸润的炎性灶。LGP组小鼠肝组织中的肝小叶结构紊乱,肝束排列欠佳,可见脂肪变性和胞质内大量脂滴空泡,相对于MCD组有所减少;胞浆肿胀、细胞核大且浓染、肝细胞坏死的气球样变,以及出现肝纤维化略有改善,但炎性灶依然较多。MGP组小鼠肝细胞中的肝小叶结构和肝束排列基本恢复正常,仍可见脂肪变性和胞质内脂滴空泡,相对于LGP组显著减少;胞浆肿胀、细胞核大且浓染、肝细胞坏死的气球样变,以及出现肝纤维化进一步减轻,炎性灶几乎不可见。HGP组小鼠肝细胞中的肝小叶结构和肝束排列基本回复正常,可见少量脂肪变性和胞质内脂滴空泡,相对于MGP组显著减少,胞浆肿胀、细胞核大且浓染、肝细胞坏死的气球样变、肝纤维化、炎性灶等无明显存在。
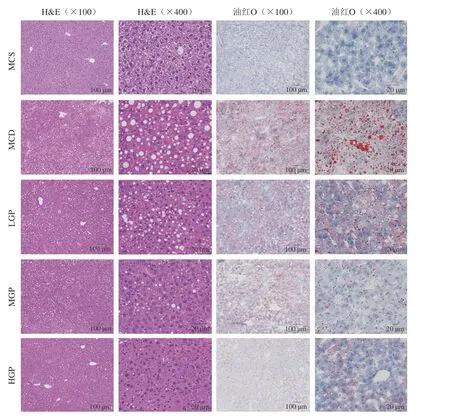
图2 小鼠肝组织H&E和油红O染色Fig.2 H&E and oil red O staining of liver sections
2.3 大蒜多糖对小鼠生化指标的影响
各组小鼠生化指标受大蒜多糖的影响见图3。相对于MCS组,MCD组的肝组织TG含量显著升高,而血清TG含量显著下降(P<0.05);LGP、MGP、HGP组的肝组织TG逐渐降低,MGP和HGP组相对于MCD组显著降低(P<0.05),未降低到MCS组水平;LGP、MGP、HGP组的血清TG逐渐升高,MGP和HGP组相对于MCD组显著升高(P<0.05),均达到MCS组水平。相对于MCS组,MCD组血清ALT和AST含量均显著升高(P<0.05),而大蒜多糖的作用又使得LGP、MGP、HGP组血清ALT和AST均显著下降(P<0.05),但均未下降到MCS组水平。肝组织MDA的含量在MCD组中相对于MCS组显著升高(P<0.05),在大蒜多糖干预后,MGP、HGP组显著降低(P<0.05),趋近于MCS组水平;肝组织SOD的含量在MCD组中相对于MCS组显著降低(P<0.05),在大蒜多糖干预后,LGP、MGP、HGP各组显著升高(P<0.05),均达到MCS组水平。

图3 大蒜多糖对小鼠生化指标的影响Fig.3 Effect of garlic polysaccharides on biochemical indexes in mice
2.4 大蒜多糖对肝脏氧化应激相关基因mRNA表达的影响
大蒜多糖对肝脏氧化应激相关基因(包括Hmox1、Cat和Gpx1)mRNA相对表达量的影响如图4所示。相对于MCS组,MCD组Hmox1基因表达量显著升高,而Cat和Gpx1基因的表达量则显著降低(P<0.05)。与MCD组相比,大蒜多糖的干预缓解了Hmox1和Cat基因的表达量受MCD饮食诱导的影响;随着大蒜多糖饲喂量的增加,Hmox1基因表达量在LGP组中变化不显著(P>0.05),在MGP、HGP组中逐渐降低;Cat基因表达量只在MGP和HGP组中有所提高。与MCD组相比,大蒜多糖的干预对Gpx1基因的表达量无显著影响(P>0.05)。

图4 大蒜多糖对肝脏氧化应激相关基因mRNA相对表达量的影响Fig.4 Effect of garlic polysaccharides on relative expression of hepatic oxidative stress-related genes
2.5 大蒜多糖对肝脏炎症反应相关基因mRNA表达的影响
大蒜多糖对肝脏炎症反应相关基因(包括Tnf、Ccl2、Cxcl2、Cxcl10、IL-1a和IL-1b)mRNA相对表达量的影响如图5所示。除了IL-1a和IL-1b外,Tnf、Ccl2、Cxcl2和Cxcl10基因的表达量在MCD饮食诱导和不同饲喂量大蒜多糖干预的情况下,表现出了相似的变化规律,即都在MCD饮食诱导下表达量显著增加,在大蒜多糖干预后表达量显著降低(P<0.05),且饲喂量越大降低越显著,除了LGP组的Ccl2基因出现了表达量的反向波动。这些结果预示着大蒜多糖在消除炎症反应中可能发挥着重要作用,其作用效果和饲喂量存在一定的剂量效应关系。

图5 大蒜多糖对肝脏炎症反应相关基因mRNA相对表达量的影响Fig.5 Effect of garlic polysaccharides on relative expression of hepatic inflammation-related genes
2.6 大蒜多糖对肝脏脂质沉积相关基因mRNA表达的影响
大蒜多糖对肝脏脂质沉积相关基因(包括Fasn、Acaca、Cpt1a、Acox、Cd36、Fabp1、Apob和Mttp)mRNA相对表达量的影响如图6所示。Fasn基因和Mttp基因的表达量在MCD饮食诱导后显著降低(P<0.05),且不受饲喂大蒜多糖的影响。Acaca基因和Apob基因的表达量在MCD饮食诱导后没有发生显著变化(P>0.05)。Cpt1a基因表达量在MCD饮食诱导后显著降低(P<0.05),饲喂大蒜多糖使Cpt1a基因的表达量在LGP和HGP组无显著变化(P>0.05),在MGP组显著升高(P<0.05)。Acox基因表达量在MCD饮食诱导后显著降低(P<0.05),饲喂大蒜多糖使Acox基因的表达量在LGP组有所升高,在MGP和HGP组显著升高(P<0.05)。Cd36基因表达量在MCD饮食诱导后显著升高(P<0.05),且不受饲喂大蒜多糖的影响。Fabp1基因表达量受MCD饮食诱导显著降低(P<0.05),各组大蒜多糖干预并没有对该基因的表达产生显著影响(P>0.05)。

图6 大蒜多糖对肝脏脂质沉积相关基因mRNA相对表达量的影响Fig.6 Effect of garlic polysaccharides on relative expression of hepatic lipid accumulation-related genes
3 讨论
MAFLD作为多系统代谢功能紊乱的肝脏表现,其发病机制、临床表现及病理改变均存在一定异质性[2]。脂肪在肝脏细胞中的非正常沉积是MAFLD形成的初始条件,主要是肝脏脂质代谢紊乱所致,如果脂肪酸的摄取、脂肪酸内部合成、脂肪分解、脂肪酸β-氧化等过程无法维持动态平衡,则会造成紊乱产生脂质沉积[14],随着病变加重,肝细胞功能逐渐丧失,炎症反应起关键作用,贯穿MAFLD的整个过程[15-16]。本研究用MCD饮食诱导的小鼠构建MAFLD模型,通过比较大蒜多糖干预与否情况下的小鼠肝组织病理形态、血清和肝组织生化指标、病理相关功能基因转录水平等,结果表明大蒜多糖对于MCD饮食诱导的MAFLD有着比较明显的缓解作用,其中,MGP组效果比较显著,添加量适中。
经过MCD饮食诱导的小鼠肝脏组织表现出肝损伤、炎症和纤维化,以及大泡性脂肪变性[17-19],其中,肝损伤、炎症和纤维化由蛋氨酸缺失导致,大泡性脂肪变性由胆碱缺失导致。蛋氨酸和胆碱都是肝磷脂酰胆碱(phosphatidylcholine,PC)的基本前体,这种饮食引起的肝脂肪性肝炎可能部分是由于PC合成受损导致的[20]。本实验通过对模型组肝脏组织切片经H&E染色和油红O染色后镜检观察,发现非常明显的肝小叶结构紊乱,肝束排列欠佳,出现大量脂肪变性和混合型脂滴空泡,可见显著的胞浆肿胀、细胞核大且浓染、肝细胞坏死的气球样变,以及出现肝纤维化和炎性灶,表明实验造模成功[21]。随着实验组大蒜多糖灌胃量的增多,小鼠肝组织病理形态分别得到不同程度的改善。在中剂量的大蒜多糖灌胃组中,已经几乎观察不到到炎性灶。在高剂量的大蒜多糖灌胃组中,小鼠肝组织的病理变化基本回复到正常状态。与上述变化最直接的联系,可能是肝组织脂质异常积累导致的氧自由基带来的损伤。
已知以体内活性氧簇(reactive oxygen species,ROS)水平升高为特征的氧化应激是肝损伤的一个确定原因,肝脏即是ROS产生的主要场所,也是ROS攻击的主要靶器官[22]。如H2O2等一些ROS可以发挥信号分子的作用,调节炎症反应过程,进而影响许多病理状态下一些基因的表达[23-24],ROS也可直接或通过某些转录因子(transcription factors,TFs)激活各种凋亡诱导物,进而导致脂质过氧化[25]。本研究的MCD组中,TG在肝组织异常沉积,MDA显著增多,SOD却显著降低(P<0.05)。MDA是细胞膜脂质在ROS的作用下发生过氧化反应的产物,该物质过量积累会导致细胞膜的结构和功能进一步受到损害,所以MDA的含量能够直接反映细胞膜脂质过氧化水平。研究表明,在MAFLD病理状态下,肝细胞、线粒体、微粒体膜的脂质过氧化产物MDA含量明显增高,并且与肝组织酯化、纤维化、炎症及坏死程度相关[26]。SOD可有效治疗或缓解因ROS作用而导致的炎症反应,当SOD缺乏时,机体的抗氧化能力降低,氧化还原稳态失衡,出现氧化应激。SOD基因上游的TATA盒和CCAAT盒构成转录因子结合位点(transcription factor binding sites,TFBSs),能与相应的TFs结合,调控SOD的表达[27]。这些TFs包括:特异性蛋白1(specificity protein 1,Sp1)发挥激活作用[28];激活蛋白1(activator protein 1,AP-1或JUN)可作为阻遏物隔离必需的共激活因子以抑制SOD转录[29];神经元型一氧化氮合酶(neural nitric oxide synthase,nNOS或NOS1)也能直接结合Sp1而抑制Sp1与Sod基因启动子结合[30];肿瘤坏死因子(tumor necrosis factor,Tnf)可激活JNK/AP1通路下调SOD启动子活性[31];CCAAT/增强子结合蛋白α、β(CCAAT/enhancer binding protein α,β,C/EBPα、C/EBPβ)通过结合SOD启动子CCAAT盒直接增强SOD表达[32-33]。本研究在MCD模型中灌胃大蒜多糖后,随着添加剂量的增加,肝组织TG逐步减少,MDA也逐渐回复到接近正常水平,SOD在各个剂量的大蒜多糖添加后均显著回复到正常水平。表明大蒜多糖对于MAFLD模型中肝组织氧化应激的损害作用有可能是依赖于SOD的表达调控。
在ROS对肝组织氧化应激的损害同时,炎症反应也随即发生。本研究中,基因Hmox1、Tnf、Ccl2、Cxcl2、Cxcl10在MCD饮食诱导之后表达量显著升高(P<0.05),在大蒜多糖干预后表达量又得到显著回复(P<0.05)。其中,Hmox1的表达产物为血红素加氧酶1(heme oxygenase 1,HMOX1或HO1),是血红素分解代谢过程限速酶的氧应激诱导型;Tnf的表达产物为肿瘤坏死因子-α,是兼具诱导细胞凋亡、免疫调节、炎症反应等作用的一种促炎细胞因子,在MAFLD发生发展中,肿瘤坏死因子-α主要由肝脏激活的Kupffer细胞产生,并发挥主要炎症因子的作用[14-15,34];Ccl2的表达产物为趋化因子(C-C)配体2(CCL2或MCP-1),主要由单核细胞、巨噬细胞和树突状细胞分泌,可促进免疫细胞到组织损伤或感染引起的炎症位点,参与炎症反应[35-36];Cxcl2的表达产物为趋化因子(C-X-C)配体2(CXCL2或MIP-2),能激活粒细胞,诱导自然杀伤细胞增殖与活化;Cxcl10的表达产物为趋化因子(C-X-C)配体10(CXCL10),主要介导Th型炎症反应,在不同类型肝病中普遍表达降低,且在疾病的发生、发展、治疗和预后过程中发生显著变化[37]。上述基因不仅表达量变化一致,还同时受到核因子κB(nuclear factor kappa-B,NF-κB)信号通路的调控。NF-κB蛋白家族可以选择性地结合在B细胞κ-轻链增强子上,进而调控许多基因的表达。在细胞的炎症反应、免疫应答等过程中NF-κB起到关键性作用。可见,在MAFLD的发生发展过程中,炎症反应的出现及受大蒜多糖干预而恢复,可能是通过NF-κB信号通路进行调节的。
本研究对影响肝脏脂质代谢主要基因的转录水平进行了定量研究,包括脂肪酸合成酶基因(Fasn)和乙酰辅酶A羧化酶1基因(Acaca)可转录表达肝脏脂质合成的关键酶,肉碱脂酰转移酶1α基因(Cpt1a)和酰基辅酶A氧化酶基因(Acox)分别可转录表达肝脏线粒体β-氧化关键酶和过氧化物酶体β-氧化关键酶,肝脏脂肪转运蛋白基因(Cd36)和肝脏脂肪酸结合蛋白基因(Fabp1)可转录表达肝脏摄取游离脂肪酸功能的关键蛋白,载脂蛋白B基因(ApoB)和微粒体甘油三酯转运蛋白基因(Mttp)可转录表达参与肝脏脂分泌代谢的关键蛋白。本研究结果显示,MCD饮食诱导后,Fasn、Cpt1a、Acox、Fabp1和Mttp的表达量显著降低(P<0.05),Cd36的表达量大幅度提高(P<0.05),但在大蒜多糖干预之后只有Cpt1a和Acox两个基因的变化得到显著回复(P<0.05),表明在MCD饮食诱导后,肝组织摄入的脂肪量大幅增加且不受大蒜多糖影响,大蒜多糖对肝组织脂质沉积的改善可能是由于对肝脏脂肪酸β-氧化的促进作用。
总体来讲,MCD饮食诱导后,小鼠肝细胞在缺失蛋氨酸和胆碱的情况下无法合成肝磷脂酰胆碱,胞内脂质不足的错误信号导致大量表达Cd36,进而大幅提高了脂质摄入量,从而出现了脂质在肝细胞的异常沉积。肝脏脂质沉积后代谢主要发生在肝细胞线粒体中,而在线粒体氧化磷酸化过程中,O2的不完全还原则会产生大量ROS,在对肝细胞产生氧化应激损害的同时,部分ROS发挥TFs作用与NF-κB抑制蛋白相结合,激活了NF-κB信号通路,调控下游Hmox1、Tnf、Ccl2、Cxcl2、Cxcl10等基因表达及启动细胞凋亡进程,包括抑制肝细胞Cpt1a、Acox基因的表达及脂质β-氧化、抑制SOD表达等作用,大蒜多糖的干预逆转了上述进程。
4 结论
综上所述,大蒜多糖的干预减少或基本消除了MCD饮食导致的肝损伤,MGP组效果比较显著且添加量适中。具体作用机制可能是通过NF-κB信号通路调控脂质代谢和炎性基因表达,激活了肝细胞脂质β-氧化,减少脂质沉积,提高了SOD表达量,减少了肝细胞脂质过氧化。这些结论为大蒜多糖在MALFD病情发展中发挥改善作用提供了一种潜在的机制解释,并表明大蒜多糖作为一种替代功能成分在食品加工领域具有巨大的应用潜力。
