牛HSPA6蛋白特性分析及蛋白互作网络构建
2024-03-10胡丽筠马旭华李亚蕾罗瑞明
胡丽筠,马旭华,李亚蕾,罗瑞明
(宁夏大学食品科学与工程学院,宁夏 银川 750000)
热休克蛋白(heat shock proteins,HSPs)是分子质量为10~110 ku的一种多基因超家族,是细胞内最主要的分子伴侣,它与其他蛋白可逆地相互作用,避免非特异性蛋白的聚集,帮助细胞蛋白获得其天然结构以维持细胞稳态,并协助这些蛋白的形成、折叠和跨膜运输[1]。在众多HSPs中,对HSP60/70/90家族的研究最多。HSP70作为一种保守的分子伴侣蛋白,在原核生物和真核生物中普遍表达,具有保守的结构特征,在蛋白质质量控制和蛋白质折叠中充当管家,以防止蛋白质积累和修复错误折叠的蛋白质[2]。多年来,有关HSP70的研究多集中在人和鼠的疾病方面,而在家畜中的研究尚不充分。杨莉等[3]采用实时荧光定量聚合酶链式反应和酶联免疫吸附测定方法检测发现冷应激后湖羊肝脏、肺脏、脾脏、淋巴结组织中HSP70mRNA表达量显著增加。最近研究发现HSP70家族的蛋白质与肉嫩度有关。Sugimoto等[4]在荷斯坦-弗里西亚牛的膈肌中发现,HSP70的缺乏导致能量相关的蛋白质发生错误折叠,可能引起蛋白质聚集和肌肉纤维变性。此外,Crawford等[5]的研究表明,热休克伴侣蛋白HSP90和HSP70是肌原纤维各个组装步骤中所必需的。Thakur等[6]的研究表明HSP70等热休克蛋白通过帮助维持蛋白质正常的结构和功能对肌肉蛋白质稳态起重要作用。这些研究表明HSP70有利于维持骨骼肌的结构、超微结构和功能特性。
牛HSPA6作为HSP70家族中一个特征不佳的成员,是哺乳动物中部分保守的可诱导蛋白,在严重的细胞应激后被诱导,其中热应激不仅不利于动物的生产和繁殖,而且严重损害畜种的健康。HSPA6作为一种不同于其他基因的新型HSP70基因,在许多生物体中都有表达[7]。HSPA6的同源基因已在棉头狨猴、猪、牛和人类中发现[8-10],并且已经确定牛和山羊的HSPA6在热应激条件下具有更高的表达[7-8],这可能是因为严重的压力条件导致HSPA6进化为维持生物基本功能的基因[11]。因此,研究HSPs相关基因、提高热应激稳定性是畜产品发展亟待解决的问题。
牛作为我国畜牧业重要的家畜,其肉营养丰富,蛋白含量高。嫩度和颜色作为两个重要的牛肉品质特征,与消费者满意度直接相关。HSPs具有抗凋亡的功能,影响宰后肉的品质,其表达量的差异与肉的质量特征如嫩度、颜色和持水能力有重要关系[12]。HSPA6作为HSP70家族成员之一,与宰后贮藏期间肉品质的具体作用机制尚不明确,且其与牛肉品质相关性的研究较少。本研究利用多重生物信息学方法,研究牛HSPA6蛋白结构和功能特性对宰后肉品质的影响,旨在进一步为其功能机制提供思路和依据。
1 方法
1.1 牛HSPA6蛋白序列的获得与系统进化树构建
使用牛HSPA6蛋白登录号信息(F1MWU9)是通过使用关键词“HSPA6+Bos taurus”搜索UniProt(https://www.uniprot.org/)蛋白质数据库获得的。以该蛋白序列搜索不同生物的同源蛋白序列。山羊(A0A452G2N5)、长江江豚(A0A341C0G7)、马(A0A3Q2HF81)、羊驼(A0A6I9IS04)、人(P17066)、北方白颊长臂猿(G1SBW1)、棉顶罗望子(Q9N1U2)、豚鼠(A0A286XYQ5)、猪(Q04967)、三行地松鼠(I3ND33)、黑鳕鱼(A0A6I9N6M6)、犬蛔虫(A0A0B2VDJ4)的基因组库,并获得不同物种中HSPA6的同源蛋白质序列。使用Mega 11.0软件中的Meighbor-Joining(NJ)方法构建系统进化树,并将Bootstrap分析重复数设置为1000。
1.2 牛HSPA6理化性质分析方法
利用ExPASy数据分析系统的ProtParam工具(http://www.expasy.org/tools/protparam)对HSPA6的分子式、分子质量、酸碱性、理论等电点、带负电荷的残基总数(Asp+Glu)、带正电荷的残基总数(Arg+Lys)、亲水性总平均值(grand average of hydropathicity,GRAVY)、不稳定性指数(II)及脂肪族指数等理化性质进行分析。牛HSPA6蛋白氨基酸序列从NCBI中获得。
1.3 牛HSPA6蛋白亲疏水区域、蛋白质跨膜域及信号肽分析方法
通过ProtScale(https://web.expasy.org/protscale/)分析牛HSPA6亲疏水性;通过TMHMM Server 2.0(https://services.healthtech.dtu.dk/service.php? TMHMM-2.0)分析H S PA 6 是否存在跨膜现象及其区域;通过SignalP 5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)分析HSPA6信号肽及切割位点。
1.4 牛HSPA6结构域、磷酸化位点及糖基化位点分析方法
通过NCBI网站中的Consered Domains工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析预测牛HSPA6蛋白保守域;通过NetPhos3.1 Server(http://www.geneinfinity.org/sp/sp_proteinptmodifs.html)分析牛HSPA6表达时是否可能发生磷酸化修饰;通过NetNGlyc(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)预测牛HSPA6蛋白的N-糖基化位点。
1.5 牛HSPA6亚细胞定位预测
使用PSORTII软件(https://wolfpsort.hgc.jp/)预测牛HSPA6的亚细胞定位。
1.6 牛HSPA6蛋白高级结构预测
通过SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测牛HSPA6蛋白的二级结构。通过SWISS-MODEL(https://swissmodel.expasy.org)预测牛HSPA6蛋白的三级结构。
1.7 牛HSPA6蛋白互作网络预测
通过STRING数据库(https://cn.string-db.org/),最低要求互动分数设置为高置信度值,即0.700,要显示的最大交互蛋白数量控制在10 个以内,构建牛HSPA6的互作蛋白网络。
2 结果与分析
2.1 牛HSPA6蛋白进化关系分析
构建牛、山羊、长江江豚、马、羊驼、人、北方白颊长臂猿、豚鼠、猪等多种生物的HSPA6蛋白的同源序列的系统进化树如图1所示。由图1可知,牛与羊、长江江豚等哺乳动物处于同一分支,它们的HSPA6蛋白的氨基酸序列有很大的相似性。

图1 牛HSPA6蛋白与其他物种同源蛋白质序列比对系统进化树Fig.1 Phylogenetic tree of Bos taurus and other species based on sequence homology of HSPA6 protein
2.2 牛HSPA6蛋白理化性质分析
通过EXPASY在线软件对HSPA6的理化性质进行预测分析。牛HSPA6蛋白理化性质如表1所示。该蛋白分子质量为70570.64 u,理论等电点为5.66,表明该蛋白质是酸性蛋白。

表1 HSPA6蛋白理化性质Table 1 Physicochemical properties of HSPA6 protein
2.3 牛HSPA6蛋白亲疏水区域、蛋白质跨膜域及信号肽分析
分析牛HSPA6蛋白氨基酸序列的亲水、疏水区域,其中正值表示该蛋白为疏水性蛋白,值越大疏水性越强;负值表示钙蛋白为亲水性蛋白,数字越大亲水性越强,双性氨基酸范围为0.5~-0.5。由图2可得,牛HSPA6蛋白的亲水性最强位点位于第591位谷氨酸(Glu)、疏水性最强位点位于第393位天冬氨酸(Asp),分值分别为-3.422、2.211;同时HSPA6蛋白质序列中大多数氨基酸的分值为负,则可知亲水性区域多于疏水性区域,亲水性预测分析进一步证实GRAVY值分析。

图2 牛HSPA6亲水性分析Fig.2 Hydrophilicity analysis of bovine HSPA6 protein
马旭华等[13]研究发现秦川牛背最长肌在宰后成熟初期,HSPA6蛋白仅发生少量降解,致使系水力增强。且有研究发现在更嫩的肉样中,HSP70含量较高[14]。HSPA6蛋白作为HSP70的一种,由于其为亲水性蛋白,自身含量的增加会导致水分含量增加,从而对牛肉嫩度产生影响。已有发现指出肉的品质特征如嫩度、颜色和持水能力与HSPs表达量的差异有关[12]。这些研究都进一步说明了牛HSPA6蛋白作为亲水性蛋白,对牛肉嫩度产生影响。
通过TMHMM Server 2.0针对牛HSPA6进行跨膜域预测,如图3所示。预测结果显示,HSPA6未含有跨膜信号,不存在由胞外向胞内的跨膜段,皆呈膜外螺旋状,故不属于跨膜蛋白。通过SignalP 5.0对牛HSPA6蛋白进行预测,结果如图4所示。预测结果显示,Sec/SPI(SP)概率<0.003,数值较低,未观察到信号肽区域。由于信号肽是一种蛋白质分泌的标记,这与Pockley等[15]报道的HSP60和HSP70在细胞外环境中存在这一结果不一致,推测是牛HSPA6蛋白可能主要在细胞内发挥作用,在细胞外环境分泌较少,信号肽含量过低,故未观察到信号肽区域。
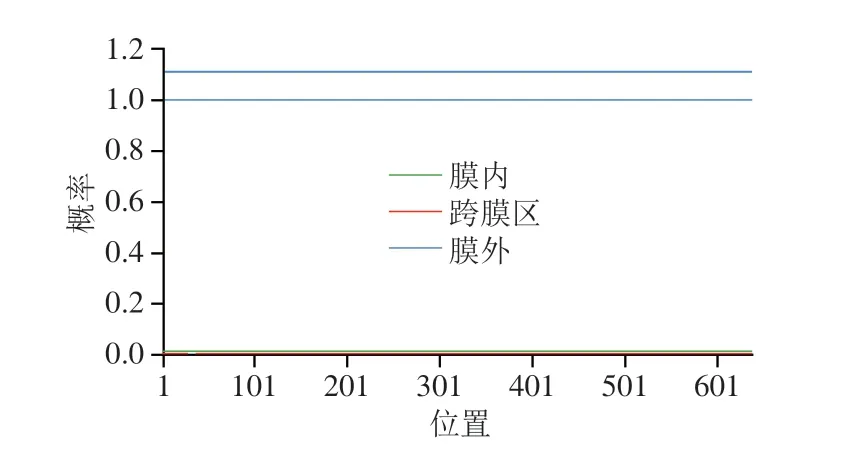
图3 牛HSPA6跨膜结构预测Fig.3 Transmembrane structure prediction of bovine HSPA6 protein

图4 牛HSPA6信号肽预测Fig.4 Signal peptide prediction of bovine HSPA6 protein
2.4 牛HSPA6蛋白结构域、磷酸化位点及糖基化位点分析
牛HSPA6蛋白包含N-端核苷酸结合域(nucleotide binding domain,NBD)和C-端底物结合域(substratebinding domain,SBD)两个重要且独立的结构域。NBD又称为ATP酶结构域,约44 kDa,可以结合并水解ATP;SBD称为肽结合域,约28 kDa,具有蛋白酶敏感位点的中间域和结合延伸的多肽。牛HSPA6蛋白的两个结构域可以进行变构耦合,NBD和SBD之间有一个灵活的含结构域的蛋白酶敏感位点,在变构通讯中发挥着重要作用[16-17]。HSPA6经历ATP水解和核苷酸交换循环,使底物结合和释放,与此同时HSPA6保持并发挥其一系列生理功能[18]。SBD与其伴侣蛋白的结合能力比NBD结合ATP的能力薄弱;但当二磷酸腺苷(adenosine diphosphate,ADP)与NBD相结合时,其构象的变化可以提高SBD与其伴侣蛋白的亲和力[19]。通过NCBI中Consered Domains对预测的HSPA6蛋白质保守域进行分析,由图5可知,其氨基酸序列具有HSP70家族特有的结构,即NBD与SBD。
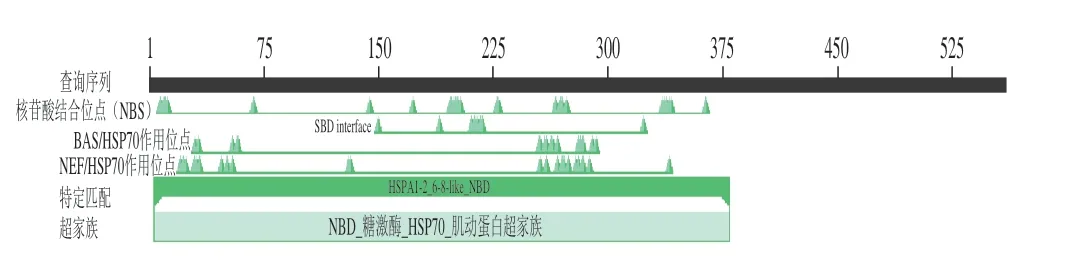
图5 牛HSPA6蛋白结构域预测Fig.5 Domain prediction of bovine HSPA6 protein
马旭华等[13]研究发现宰后成熟期间秦川牛背最长肌中HSPA6表达量呈显著下降趋势,并与ATP、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)含量呈显著正相关,结果表明HSPA6可能通过利用自身结构域具有ATP-ADP转换活性机制,执行了宰后成熟期间秦川牛肉蛋白的翻译后修饰,蛋白质翻译后修饰促使组织中各种生化反应利用能量导致ATP的降解,且降解产物ADP、一磷酸腺苷(adenosine monophosphate,AMP)含量均随成熟时间延长呈显著下降趋势,同时,反映组织细胞中氧化还原和能量变化状态的NADH含量呈下降趋势,发生了与活体不同的变化。这一研究说明HSPA6蛋白的NBD和SBD结构域通过影响宰后肉品中能量物质,进而影响宰后肉品品质。
为了对牛HSPA6的作用机制作进一步分析,通过NetPhos3.1 Server分析HSPA6磷酸化位点,如图6所示,可以看出蛋白质序列中存在多个可能发生磷酸化的位点。从预测位点中筛选出11 个得分>0.900的位点,且主要分布在NBD及SBD结构域,如表2所示(预测得分在0.000~1.000,>0.500表示可能发生磷酸化,越接近1,就越可能发生磷酸化)。根据NetPhos3.1预测结果结果可知,牛HSPA6蛋白发生磷酸化最多的氨基酸为丝氨酸(Ser)。Ser通过蛋白质的异构途径进行磷酸化,激活蛋白质的酶活性;除了激活蛋白质的酶活性外,酪氨酸还有一个重要的作用,就是通过形成多个蛋白的复合体,构成细胞信号传递和转导的根源性机制[20]。

表2 HSPA6多肽链中可能的磷酸化位点Table 2 Potential phosphorylation sites in HSPA6 peptide chains
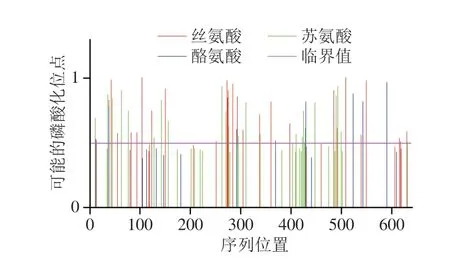
图6 牛HSPA6蛋白磷酸化位点预测Fig.6 Phosphorylation site prediction of bovine HSPA6 protein
越来越多的证据表明,HSP70受大量翻译后修饰调节,也称为伴侣代码,包括乙酰化、磷酸化和ADP-核糖基化等[21-22]。通过磷酸化位点预测,表明HSPA6蛋白也进行磷酸化修饰,这有助于更加深入了解HSPA6的磷酸化水平及其在机体中的作用机理。Beltrao等[23]已经鉴定出11 个物种的HSP70亚型上的磷酸位点共313 个,富集发现这些位点大多数位于NBD和SBD结构域附近,这与本研究结果一致。通过磷酸化位点预测发现HSPA6能够催化磷酸基团从磷酸供体向磷酸供体迁移,进而调整和控制蛋白质的活力与功能等各个环节。因此,HSPA6可能通过宰后牛肉中所发生的蛋白质翻译后修饰进一步调控蛋白质结构、功能活性及蛋白质间的相互作用,这些变化又进一步影响并导致细胞凋亡和蛋白水解等变化,最终影响嫩度、持水性等肉品质[24]。已有研究发现HSPA6可以通过抑制相关信号通路的磷酸化和丝裂原活化蛋白激酶途径发挥作用[25]。
牛HSPA6蛋白的N-糖基化位点预测结果如图7所示。结果显示,该蛋白存在4 个可能的N-糖基化位点,最有可能发生N-糖基化的位点位于第33位残基上,概率为0.6172。蛋白质N-糖基化修饰在蛋白质翻译后修饰中具有关键作用[26]。基于对保守结构域、可能磷酸化位点及N-糖基化预测的综合分析,发现发挥生物学作用的结构域位于4~379位碱基中,而磷酸化位点及N-糖基化激活位点分布的后端碱基可能是蛋白质进行修饰的主要部分。
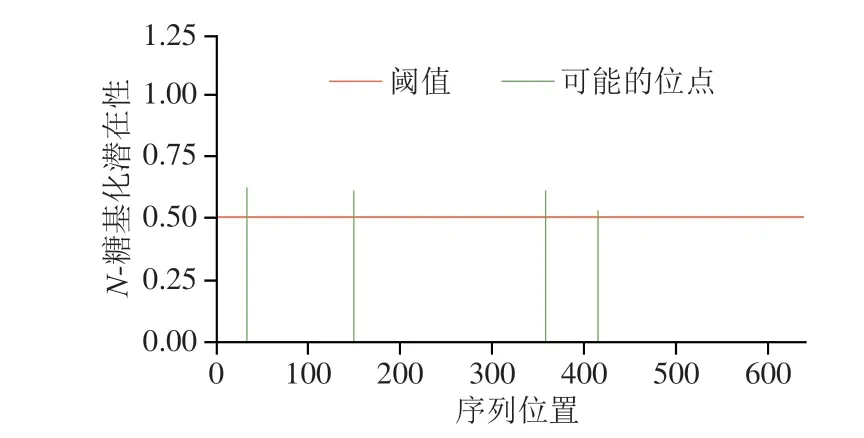
图7 牛HSPA6蛋白N-糖基化修饰位点预测Fig.7 Prediction of N-glycosylation sites of bovine HSPA6 protein
2.5 牛HSPA6蛋白亚细胞定位预测分析
通过PSORT II Prediction分析牛HSPA6亚细胞定位。结果显示,HSPA 6 蛋白最有可能为细胞质蛋白(14.5%),其次可能为细胞质和细胞核蛋白(12.5%)。说明HSPA6在细胞质中具有重要生理功能。同时通过其序列发现,HSPA6的C-末端具有特征构象EEVD,该特征构象用于进行细胞质定位。两者预测结果可以说明HSPA6最有可能是胞质蛋白,且主要在细胞质中发挥生物作用。且已有数据表明HSPA6蛋白的细胞定位主要在胞质溶胶和胞外外泌体中[19]。此外,也有报道指出其他位置如中心粒,以及COP9信号体和血液微粒共定位的含核蛋白复合物中都有HSPA6[27]。马旭华等[13]利用4D-非标定量蛋白质组学技术对筛选出的秦川牛HSPA6蛋白及其相关蛋白作基因本体论(Gene Ontology,GO)分析研究发现,此类相关蛋白主要在细胞质中发挥生物作用。以上发现都说明牛HSPA6蛋白最有可能在细胞质中发挥作用。
2.6 牛HSPA6蛋白的高级结构预测分析
通过在线软件SOPMA分析牛HSPA6蛋白的二级结构,如图8所示,该蛋白二级结构主要由40.38%的α-螺旋、7.20%的β-转角、33.65%的无规卷曲和18.78%延伸链构成。该蛋白质中α-螺旋及β-转角总比例为47.58%,说明蛋白质的二级结构较稳定,其中α-螺旋及无规卷曲占比最大。模型构建的结果用Ramachandran plot表示,如图9所示。结果显示,通过模型构建所得蛋白的三维结构中,92.77%的Φ角和Ψ角均处于Ramachandran plot中的合理区域,确保了其三维结构的正确性。图10为通过SWISS-MODEL采用同源建模法预测的蛋白牛HSPA6的三级结构及相关参数。该蛋白质三级结构符合HSP70家族特征,NBD及SBD均被折叠为球状结构,其间由任意的卷曲链进行连接。并且预测的结果表明GMQE为0.73,QMEAN为-1.07,覆盖率82.92%,序列相似性55.0%,显示该模型预测结果合理。
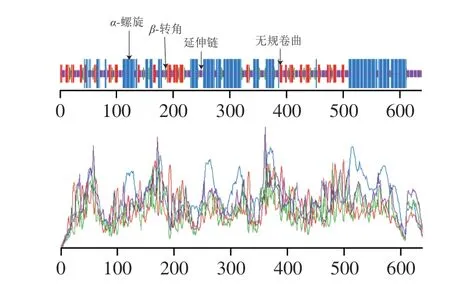
图8 牛HSPA6蛋白二级结构预测Fig.8 Secondary structure analysis of bovine HSPA6 protein

图9 牛HSPA6蛋白三级结构Ramachandran plots图Fig.9 Ramachandran plots of tertiary structure of bovine HSPA6 protein

图10 牛HSPA6蛋白三级结构预测Fig.10 Tertiary structure analysis of bovine HSPA6 protein
通过高级结构预测表明牛HSPA6蛋白是一种结构相对稳定的蛋白质。结合理化特性预测结果,都说明HSPA6为稳定性蛋白质。Hageman等[28]发现HSPA6可能已经进化出在极端压力条件下维持稳定的关键功能。Picard等[29]表明HSP70是在正常细胞生长期间以及在病理生理条件下维持细胞完整性的最重要的HSPs之一。马旭华等[13]研究发现宰后成熟初期HSPA6仅发生少量降解,这可能与其自身结构和功能具有稳定性有关,因而能够在宰后初期较好地执行其生理功能,抑制细胞凋亡,对肌肉结构蛋白降解程度起反向调控作用。这些研究中HSPA6蛋白在非正常环境条件下仍保持其生理功能,这与其自身结构和功能的稳定性密不可分。
2.7 牛HSPA6蛋白质互作网络分析
通过STRING对牛HSPA6蛋白进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建,以获取其潜在蛋白质的交互作用,如图11所示。表3为牛HSPA6蛋白相互作用的蛋白质及可能性预测得分。结果显示,聚类系数:0.814;PPI富集P值:1.29×10-11;HSPA6蛋白可能与BAG1、DNAJA4、DNAJB1、DNAJC2等蛋白相互作用。GO富集分析表明,牛HSPA6互作基因主要参与腺苷酸交换因子活性、ATP酶调节活性、伴侣绑定等分子功能;京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析可以看出,HSPA6主要参与内质网中的蛋白质加工。参与的反应组途径有HSF1介导的热休克反应的调节、类固醇激素受体的HSP90伴侣循环及细胞对压力的反应等。

表3 与牛HSPA6蛋白相互作用的蛋白质及可能性预测得分Table 3 Proteins interacting with bovine HSPA6 protein and predicted likelihood scores

图11 牛HSPA6蛋白相互作用预测Fig.11 Putative interaction network of bovine HSPA6 protein
分析牛HSPA6蛋白互作网络,发现DNAJB1、DNAJC2及DNAJC7都属于HSP40家族成员。HSP40通过HSP70的NBD和SBD的C端部分与HSP70相互作用,与HSP70/HSP90组织蛋白(HSP70-HSP90 organizing factor,HOP)竞争,且HSP70上的磷酸化位点可以促进其与HSP40相互作用,并帮助这种伴侣蛋白达到适合HOP结合的构象,之后被共同伴侣蛋白取代[30-31]。除此之外,还发现了HSP110家族成员HSPH1,有报道显示,HSP110同样可以和HSP70相互作用[32]。通过蛋白互作网络发现的HSP40及HSP110家族成员,表明HSPA6在参与牛的热应激反应过程中,可能会与这些成员以聚合体的形式存在,其上的磷酸化等位点在该过程中发挥重要作用。通过进一步的GO富集发现,牛HSPA6互作基因主要参与腺苷酸交换因子活性、ATP酶调节活性、伴侣绑定等分子功能,通过影响ATP等能量物质合成过程,导致肌细胞中能量物质的改变,进而改变肉的品质[33]。KEGG通路分析预测基因主要参与内质网中的蛋白质加工,这与牛HSPA6亚细胞定位预测以及含有EEVD的结果相吻合,结果都说明该蛋白主要在细胞质中发挥生物作用。HSPA6互作蛋白网络为深入探讨宰后应激及分子机制对肉品质的影响提供了可靠的线索。
3 结论
本实验通过构建牛HSPA6蛋白系统进化树以及进行多重生物信息学分析,得到牛HSPA6蛋白的结构特征和功能特性。牛HSPA6蛋白是一种结构和功能特性稳定的酸性亲水性蛋白,这使得它能够在应激反应过程中保持并发挥其生物学功能以及对牛肉品质(尤其是嫩度)起作用;并且含有NBD和SBD两个与ATP-ADP活性转化有关的结构域,GO富集到的互作基因也主要参与腺苷酸交换因子活性、ATP酶调节活性等分子功能,说明该蛋白通过调节ATP等能量物质的合成,影响宰后肉品的蛋白质翻译后修饰,进而影响肉的品质。蛋白功能预测表明该蛋白含有磷酸化位点,大多数位于NBD和SBD结构域附近,结合蛋白互作网络进行分析,其上的磷酸化位点促进HSPA6蛋白的聚合,使其与互作蛋白形成聚合体,可能参与调节牛温度应激反应过程,并且以上这些反应主要在细胞质中进行。本研究对牛HSPA6蛋白结构特征和功能特性进行分析,为深入研究牛应激反应及牛肉品质变化机制提供理论基础。
