浒苔多糖对脂多糖诱导小鼠肠道屏障功能及肠道微生物组成的影响
2024-03-10张玉梅谢春艳
张玉梅,谢春艳,吴 信,3
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125;2.天津市农业科学院畜牧兽医研究所,天津 300381;3.中国科学院天津工业生物技术研究所,天津 300308)
炎症是一种抵抗伤害、感染和压力的先天防御机制,适当的炎症刺激对宿主而言是有利的,但是炎症过度则导致组织损伤[1]。肠道作为机体重要的免疫防线,会在炎症刺激下引起紧密连接屏障的破坏,进而引发肠道炎症和疾病的发生[2-3]。饮食和环境中的致炎因子是炎症的重要介质,近年来已在疾病的预防和治疗中得到普及,目前,在没有切实有效的方法完全消除饮食或环境中致炎因子的情况下,通过补充功能性物质,如植物多糖缓解肠道屏障损伤造成的影响显得尤为重要。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌外膜的组成成分,可透过肠壁引发机体的细菌移位,增加胃肠黏膜上皮紧密连接屏障的通透性,破坏其完整性,使得内毒素进入肠内,从而引起细胞因子的失控性表达,加剧肠道炎症[4-5]。体内LPS免疫学挑战模型是目前较为常见的肠黏膜损伤免疫应激模型[6]。研究表明,给小鼠按照0.5 mg/kgmb注射LPS,24 h后即可引起肠黏膜损伤,进而诱导活化细胞表面Toll样受体4(Toll-like receptors 4,TLR4),激活下游丝裂原活化蛋白激酶/核因子κB(nuclear factor kappa-B,NF-κB)信号通路,合成释放炎性细胞因子,加剧肠道损伤,降低细胞增殖,促进细胞凋亡[7-8]。同时,LPS刺激可上调肠上皮细胞一氧化氮合酶(nitric oxide synthase,iNOS)的表达进而产生一氧化氮和活性氧。
浒苔(Enteromorpha prolifera)是一种药食兼用的藻类植物,浒苔多糖(E.proliferapolysaccharide,EP)是浒苔的关键活性成分,其从天然绿藻浒苔粉中经酶解提取、纯化、浓缩、喷雾干燥而成,主要由鼠李糖、木糖和葡萄糖等组成,具有降血脂、抗氧化及免疫调节的功能[9-13]。研究表明,EP可促进肠道中产乙酸的有益菌嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)[14-15]、双歧杆菌(Bifidobacteriumspp.)和乳杆菌(Lactobacillusspp.)的生长[15-16]。Kim等[10]通过小鼠体内实验证实,硫酸化EP可以增加小鼠干扰素-α(interferon α,IFN-α)和白细胞介素(interleukin,IL)-2的分泌,促进细胞增殖,但其预防或缓解肠道炎症损伤的作用机制还不明确。因此,本实验旨在探究EP对LPS诱导肠道炎症的预防或抑制作用,阐明其调控肠道炎症损伤的机制,为EP缓解肠道损伤及其在食品行业的应用提供参考。
1 材料与方法
1.1 动物、材料与试剂
8 周龄C57BL/6J雄性小鼠(生产许可证号:SCXK(湘)2019-0004)湖南斯莱克景达实验动物有限公司。
EP由青岛海大生物集团有限公司提供,其多糖质量分数≥90%;小鼠饲料 湖南斯莱克景达实验动物有限公司。
生理盐水 桂林普兰德生物科技有限公司;LPS(O55∶B5)美国Sigma公司;4%多聚甲醛 武汉塞维尔生物科技有限公司;血清髓过氧化物酶(myeloperoxidase,MPO)和二胺氧化酶(diamine oxidase,DAO)试剂盒 上海茁彩生物科技有限公司;RNA提取试剂盒、RNA反转录试剂盒、SYBR Green Mix 日本TaKaRa公司;RIPA裂解液、磷酸化酶抑制剂、BCA试剂盒 上海碧云天生物技术有限公司;TLR4抗体 美国Cell Signaling Technology公司;E.Z.N.A.®DNA试剂盒 美国BioTek公司;DNA凝胶提取试剂盒 美国Axygen Biosciences公司;核酸染料 北京天根生化科技有限公司。
1.2 仪器与设备
Wes全自动蛋白表达分析系统 美国ProteinSimple公司;LightCycler®480II实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)仪瑞士Roche公司;MiSeq高通量测序平台 美国Illumina公司;离心机 德国Eppendorf公司;冰箱 青岛海尔股份有限公司;EM UC7切片机 德国Leica公司;光学显微镜 德国Zeiss集团。
1.3 方法
1.3.1 动物模型的建立
本研究涉及的所有程序和实验设计均按照《中国科学院实验动物伦理委员会指南》进行,并经中国科学院亚热带农业生态研究所动物保护与利用委员会批准(编号:ISA-2020-18)。所有小鼠饲养于中国科学院亚热带农业生态研究所动物房内,环境温度(22±2)℃,相对湿度(50±5)%,12 h/12 h昼夜循环。
C57BL/6J小鼠适应性饲养1 周后随机分为4 组,每组12 只,分别为空白对照(Ctrl)组、LPS组、EP组、EP+LPS组。其中Ctrl和LPS组饲喂基础日粮,EP和EP+LPS处理组饲喂600 mg/kg EP日粮(每千克基础日粮中添加600 mg EP)。实验期间所有小鼠自由采食和饮水。实验第28天,LPS和EP+LPS组小鼠按0.5 mg/kgmb剂量腹腔注射200 μL LPS(LPS溶解在无菌的生理盐水中),Ctrl组和EP组小鼠腹腔注射相同剂量的生理盐水。
1.3.2 样品采集与处理
实验第28天用生理盐水/LPS处理小鼠24 h后,称量小鼠体质量,眼眶采血于1.5 mL离心管中,静置4 h,3500 r/min离心10 min,取上清液并于-80 ℃保存,用于血清炎症因子的分析。解剖后,分离肝脏和脾脏,记录脏器质量,统计脏器指数(脏器指数=脏器质量/体质量)。分离肠道,截取结肠中段约5 mm固定于4%多聚甲醛中,用于评定肠壁厚度。另用生理盐水洗涤除去黏液和消化物后截取结肠约10 g,迅速放入液氮中,并在-80 ℃保存,用于分子生物学实验。采集结肠内容物于1.5 mL离心管中,用于测定肠道菌群组成。
1.3.3 血液生化分析
根据试剂盒说明书测定血清中的MPO和DAO。
1.3.4 肠道形态学检测
结肠组织用4%多聚甲醛固定后,经脱水、包埋、切片和苏木精-伊红(hematoxylin and eosin,H&E)染色处理,利用光学显微镜拍照。
1.3.5 相关基因mRNA相对表达量分析
结肠总RNA提取按照试剂盒说明书进行,之后使用反转录试剂盒将RNA合成为cDNA。通过使用国家生物技术信息中心提供的Primer-BLAST设计引物,引物由工生物工程(上海)股份有限公司合成,序列见表1。real-time PCR体系为10 μL:SYBR Green mix 5 μL、上下游引物各0.4 μL、ddH2O 2.2 μL、cDNA样品2 μL。反应条件为:1)95 ℃预变性30 s,循环一次;2)95 ℃变性5 s,循环40 次;3)60 ℃退火20 s,循环40 次;4)72 ℃延伸1 min。real-time PCR在Roche LightCycler®480II仪器上进行,以β-actin为内参基因,采用2-ΔΔCt法计算目的基因的相对表达量。

表1 本研究引物序列Table 1 Primer sequences used in this study
1.3.6 TLR4蛋白相对定量分析
使用含有1%磷酸化酶抑制剂的RIPA裂解液提取结肠总蛋白,4 ℃、12000×g离心15 min后取上清液,采用BCA试剂盒测定总蛋白浓度。采用Wes全自动蛋白表达分析系统定量蛋白,样品用0.1×sample buffer稀释,与抗体孵育1 h,以GAPDH作为内参。
1.3.7 微生物分析
结肠内容物基因组 DNA 使用E.Z.N.A.®DNA 试剂盒提取,用上游引物338 F(5’-ACTCCTACGGGAGGCAGCAG-3’)和反向引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)对细菌16S rRNA基因V3~V4区进行real-time PCR扩增。扩增程序包括:1)95 ℃预变性3 min;2)95 ℃变性30 s,循环35 次;3)55 ℃退火30 s,循环35 次;4)72 ℃延伸90 s,循环35 次;5)最后72 ℃延伸5 min。终产物用2%琼脂糖凝胶电泳检验扩增产物,再采用DNA凝胶提取试剂盒纯化,利用Quantus™荧光计进行检测定量。测序和文库构建在上海美吉生物医药科技有限公司的Illumina MiSeq平台进行。使用FLASH对原始测序序列进行拼接,根据97%的相似度对序列进行操作分类单元(operational taxonomic unit,OTU)聚类,α多样性以Chao指数、Shannon指数、ACE指数和Simpson指数表征,以主成分分析(principal component analysis,PCA)法分析群落组成,此外,分析属水平上优势菌的相对丰度。
1.4 数据处理与分析
数据用统计学软件SPSS 18.0进行统计分析,使用单因素方差分析进行显著性分析,所有结果以表示。
2 结果与分析
2.1 EP对LPS诱导小鼠脏器指数的影响
LPS处理24 h后可显著降低小鼠肝脏质量(图1A,P<0.05),极显著升高小鼠脾脏质量(图1 C,P<0.01)和脾脏指数(图1D,P<0.01)。EP处理4 周后,对LPS诱导的小鼠肝脏损伤和脾脏肿大均没有显著影响(P>0.05)。

图1 EP对LPS诱导小鼠脏器指数的影响Fig.1 Effect of EP on organ indexes of mice induced by LPS
2.2 EP对LPS诱导小鼠血清MPO和DAO的影响
由图2可知,与Ctrl组相比,LPS处理24 h后未引起血清MPO和DAO含量的升高。EP处理可显著降低LPS诱导小鼠血清中MPO(图2A,P<0.05)和DAO(图2B,P<0.01)的活力。

图2 EP对LPS诱导小鼠血清MPO(A)和DAO(B)活力的影响Fig.2 Effect of EP on serum MPO (A) and DAO (B) activity of mice induced by LPS
2.3 EP对LPS诱导小鼠结肠形态的影响
如图3所示,与Ctrl组相比,经LPS处理的小鼠结肠肠壁厚度变薄,而EP+LPS处理组小鼠的肠壁恢复至与Ctrl组和EP组基本一致。
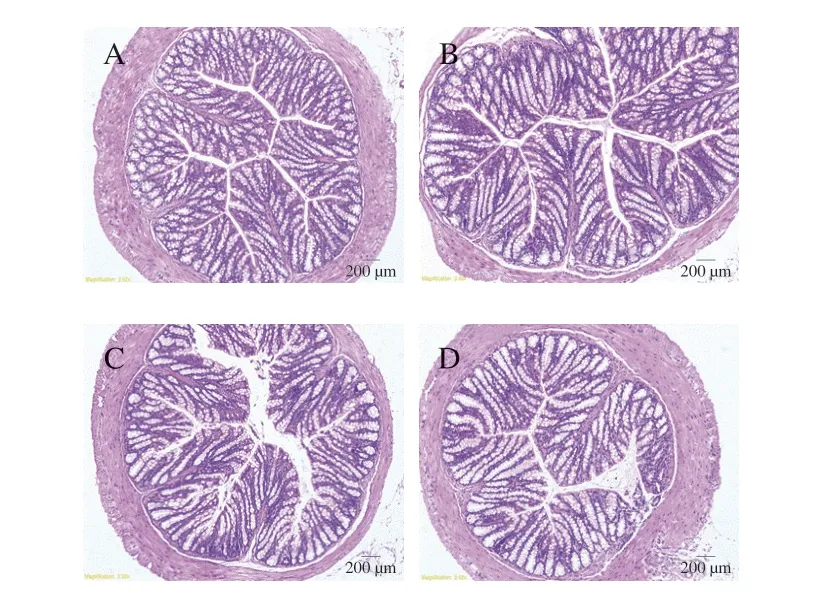
图3 EP对LPS诱导小鼠结肠形态的影响Fig.3 Effect of EP on colonic histomorphology of mice induced by LPS
2.4 EP对LPS诱导小鼠结肠TLR4信号通路关键基因表达的影响
如图4所示,与Ctrl组相比,LPS处理24 h后TLR4、MyD88、NF-κB、ERK、TNF-α、IL-1β和iNOS的表达显著升高。EP处理显著升高LPS诱导小鼠结肠IL-1β的表达,显著降低iNOS的表达(P<0.05)。

图4 EP对LPS诱导小鼠结肠TLR4信号通路关键基因表达的影响Fig.4 Effect of EP on the colonic expression of key genes associated with the TLR4 signaling pathway in mice induced by LPS
2.5 EP对LPS诱导小鼠结肠TLR4蛋白表达的影响
与Ctrl组相比,LPS处理24 h后TLR4的蛋白表达显著升高(P<0.05),EP 处理使其显著降低(P<0.05)(图5)。

图5 EP对LPS诱导小鼠结肠TLR4蛋白表达的影响Fig.5 Effect of EP on relative protein expression of TLR4 in the colon of mice induced by LPS
2.6 EP对小鼠肠道微生物丰富度和多样性的影响
为研究EP对小鼠肠道微生物丰富度和多样性的影响,采用16S rRNA高通量测序分析结肠内容物,测序结果如图6所示。采用Shannon指数、Simpson指数、ACE指数和Chao指数衡量微生物群落的多样性和丰富度(图6A~D),由Shannon指数和Simpson指数指示的微生物群落多样性中,EP+LPS组Simpson指数极显著低于EP组(P<0.01)。由ACE指数和Chao指数指示的微生物群落丰富度中,EP组极显著低于EP+LPS组(P<0.01),且EP组Chao指数极显著低于Ctrl组(P<0.01)。为进一步分析微生物的结构组成,进行了OTU水平上的PCA聚类分析(图6E),结果表明,LPS处理前后菌群结构显著区分,聚成不同类群,EP对微生物菌群结构具有一定影响。

图6 EP对小鼠肠道微生物α多样性和β多样性的影响Fig.6 Effect of EP on α-diversity and β-diversity of intestinal microbiota in mice
2.7 EP对LPS诱导小鼠肠道微生物门水平上物种组成的影响
如图7 A 所示,通过微生物物种组成丰度分析可得,在门水平上,Bacteroidota、Firmicutes、Campilobacterota、Verrucomicrobiota、Actinobacteria、Desulfobacterota和Proteobacteria为优势菌。与Ctrl组相比,LPS 处理极显著降低了Firmicutes 的丰度(P<0.05);EP 极显著提高了LPS 诱导小鼠Verrucomicrobiota的丰度(P<0.01)(图7B~D)。

图7 EP对小鼠肠道微生物门水平上物种组成的影响Fig.7 Effect of EP on phylum-level composition of intestinal microbiota in mice
2.8 EP对LPS诱导小鼠肠道微生物属水平上物种组成的影响
如图8A所示,通过微生物物种组成丰度分析可得,在属水平上,norank_f__Muribaculaceae、Lactobacillus、Alloprevotella、Bacteroides和Lachnospiraceae_NK4A136_group为优势菌。利用Kruskal-Wallis秩和检验对属水平排名前15的菌种进行微生物菌群组成的差异性分析(图8B)。结果显示,与Ctrl组相比,LPS处理显著提升了Alloprevotella、Bacteroides、unclassified_o__Bacteroidales和Parabacteroides的丰度,极显著降低了Lachnospiraceae_NK4A136_group的丰度(P<0.01)。EP处理显著降低了LPS诱导小鼠Alloprevotella、Bacteroides和unclassified_o__Bacteroidales的丰度(P<0.05),提高了Lachnospiraceae_NK4A136_group、Anaerostipes和Akkermansia的丰度(P<0.05)。

图8 EP对小鼠肠道微生物属水平上物种组成的影响Fig.8 Effect of EP on genus-level composition of intestinal microbiota in mice
3 讨论
LPS刺激可引起许多病理变化,包括引起脾脏和肝脏肿大,破坏肠道黏膜的完整性,增加黏膜的通透性,引起肠道炎症等[17-18]。植物多糖具有潜在的抗炎活性,可抑制LPS诱导的巨噬细胞分泌炎症细胞因子[19]。在本研究中,LPS处理24 h可以显著降低小鼠的体质量以及肝脏质量,提高小鼠的脾脏质量及脾脏指数,而EP处理对LPS诱导引起的肝脏和脾脏指数变化没有显著性影响,说明肝脏和脾脏可能不是炎症状态下EP作用的主要靶向器官。
MPO是一种与炎症状态下组织损伤有关的酶[20]。DAO位于小肠黏膜的上部绒毛中,血清DAO水平可以反映肠道的通透性和完整性[21]。当肠道黏膜被破坏时,MPO和DAO这两种分子都被释放到血液中[22]。注射LPS未引起小鼠血清MPO和DAO活性增加,而用EP处理可降低LPS组小鼠血清MPO和DAO的活性,这表明EP可预防炎症状态下的肠道黏膜损伤,维持肠道屏障功能。
NF-κB通过合成和释放促炎症细胞因子(TNF-α和IL-1β)在肠道炎症的发展中起着关键的作用。据报道,LPS能与TLR4结合并激活依赖于MyD88的NF-κB途径,产生TNF-α、IL-1β和iNOS等炎性细胞因子,引起炎症反应[4,23],LPS处理的小鼠过度释放炎症细胞因子可能是引起慢性炎症的主要原因之一[17]。本研究中,LPS处理24 h可以上调结肠TLR4蛋白的表达,进而促进NF-κB信号通路下游炎症相关因子TNF-α、IL-1β和iNOS的转录上调,说明LPS处理成功诱导了小鼠的炎症反应。而在EP处理的LPS组小鼠中,TLR4的蛋白表达和iNOS的基因表达明显下调,说明EP通过抑制LPS与TLR4的结合缓解了LPS诱导的炎症反应,而IL-1β却在EP+LPS组小鼠中显著上调,可能是由于多糖激活了免疫应答[24],LPS处理进一步强化了免疫刺激作用所致。
多糖具有调节肠道菌群的作用,且能通过增加有益菌的丰富度、抑制有害菌的繁殖达到促进肠道微生态区系平衡的作用[15,25-26]。肠道菌群可通过促进代谢物及致病菌成分对肠上皮模式识别受体的刺激,激活信号传导,调节宿主免疫防御和耐受,指导先天性及适应性免疫功能成熟,维持肠道稳态[27]。肠道免疫细胞可以直接或间接地影响肠道菌群,通过免疫反应调节肠道菌群组成、多样性和转移[28]。本研究中观察到LPS处理小鼠的微生物群落多样性更低,而群落丰富度更高,说明LPS刺激具有调节肠道菌群丰度的作用。Bacteroidota和Firmicutes是门水平上丰度最高的两个菌群,这与之前的研究[7,15]一致。Bacteroidota以其降解多种复杂碳水化合物的能力而闻名,通过改变相关酶的基因表达和蛋白质分泌,快速在固体表面移动,精确感知附近多糖进而降解多糖[29]。研究表明,LPS处理可降低Firmicutes的丰度,Firmicutes的降低与克罗恩病相关[30]。EP不影响LPS刺激小鼠Firmicutes的丰度,说明EP缓解肠道炎症的作用不是通过改变Firmicutes的组成而起作用。A.muciniphila作为唯一一种在哺乳动物中发现的属于Verrucomicrobia的潜在益生菌,与炎症水平呈负相关[31]。文献报道EP可促进雌性C57BL/6J小鼠肠道中产乙酸的有益菌A.muciniphila、Bifidobacteriumspp.和Lactobacillusspp.的生长[15-16]。本研究表明,在正常生理状态下,EP不改变Akkermansia菌的丰度,但LPS刺激后,EP显著升高Akkermansia的丰度,说明在LPS刺激的炎症状态下,Akkermansia在EP缓解肠道炎症过程中发挥重要作用。Anaerostipes是属于Lachnospiraceae的厌氧菌,可将一些无法被消化的植物多糖在结肠中发酵代谢产生丁酸盐,进而为细胞提供能量,有助于维持细胞的稳态[32]。本研究结果显示,LPS刺激后,EP显著升高Anaerostipes的丰度,表明其在EP缓解肠道炎症过程中同样具有重要作用,由此说明,EP主要通过调节Akkermansia及Anaerostipes的丰度缓解炎症,推测其可能是通过发酵多糖产乙酸和丁酸盐,进而与肠上皮模式识别受体结合,调节机体免疫防御。以上结果表明肠道菌群在EP缓解肠道炎症的过程中具有重要作用,但具体作用机制还待进一步研究。
4 结论
EP可以预防LPS刺激引起的肠道屏障功能受损,通过调节TLR4信号通路相关基因的表达和肠道微生物的组成缓解LPS刺激引起的肠道黏膜受损,进而缓解炎症,调节机体的免疫防御。作为一种药食兼用的藻类植物,浒苔具有广阔的应用前景,未来课题组将采用粪菌移植,结合代谢组学等技术,进一步分析肠道菌群在EP缓解肠道炎症的过程中发挥功能的作用机制。
