皖浙花猪干腌火腿源血糖调节肽的分离纯化、鉴定及量子化学表征
2024-03-10黄晶晶周迎芹刘振东程秀峰谢宁宁
黄晶晶,周迎芹,罗 章,刘振东,程秀峰,谢宁宁,*
(1.安徽省农业科学院农产品加工研究所,安徽 合肥 230001;2.安徽省食品微生物发酵与功能应用工程实验室,安徽 合肥 230031;3.西藏农牧学院食品科学学院,西藏 林芝 860000)
糖尿病是全球最严重的慢性疾病之一,2021年20~79 岁人群的患病率约10.5%(5.366亿 人),支出约9660亿 美元[1]。目前无法治愈糖尿病,常用治疗手段有口服药物、注射胰岛素等,亟需通过饮食预防、干预、调控血糖代谢紊乱。某些食物源活性肽具有维持血糖生理稳态的潜力,其结构简单、活性多样,可持续性、安全性、生物利用度高,免疫原性和毒性低[2]。其中部分肽类可以抑制α-淀粉酶和α-葡萄糖苷酶等消化酶活性,阻碍碳水化合物转换化为葡萄糖进入体循环,帮助改善受损的胰岛β细胞功能[3]。这类肽的活性与分子质量、疏水性、氨基酸组成等密切相关,但不是氨基酸活性的简单叠加。而肽分子内的相互作用会影响立体效应和结构,很难获得准确的活性作用位点和电子转移路径,仍未明晰其体内降糖机制[4]。
分子对接、定量构效关系、量子化学等多种生物信息学手段已被用于筛选、设计食源性降糖肽并预测其活性,推动了序列鉴定和产品研发。量子化学方法可以输出非经验性的精确能量参数和几何结构,描述酶活性位点运动和电子转移机制。已从药物设计扩展应用到了食品科学,但是尚不多见活性物质的构效关系研究。目前已通过前线分子轨道分析甲硫氨酸和酪氨酸的抗氧化机制[5];定位多种肽的活性位点,包括水产源鲜味肽[6-7],酪蛋白源睡眠增强肽YPVEPF[8],桑黄抗癌肽[9],抗氧化肽PMRGGGGYHY[10],DDDY和DYDD[11]、EAAY[12]、FSEY等[13];并通过密度泛函理论描述了猪肉源二肽基肽酶(dipeptidyl peptidase-IV,DPP-IV)抑制二肽的电子特性,发现疏水性氨基酸(尤其是苯丙氨酸和酪氨酸)的重要作用[14]。然而,尚鲜见α-淀粉酶和α-葡萄糖苷酶抑制肽的量子化学研究。
干腌火腿等猪肉产品是降糖小肽的优秀蛋白来源,其蛋白质经过内源酶和微生物共同作用生成多种肽和游离氨基酸[15]。伊比利亚干腌火腿中具有α-葡萄糖苷酶抑制肽[16]和DPP-IV抑制肽[17]。皖浙花猪是制作火腿的优质品种,原产于安徽黄山地区和浙江淳安县[18]。目前,相关研究集中在遗传资源和养殖,营养价值未被开发。因此,本研究从皖浙花猪干腌火腿中制备降糖小肽,分离纯化并鉴定、筛选序列后,计算量子化学结构/能量参数,探究氨基酸组成、立体构象、前线轨道分布、电荷、键长等对活性的影响,预测活性位点,揭示降糖机理,以期为进一步开发、改造、合成肽类产品,克服产业化挑战奠定理论和科学基础。
1 材料与方法
1.1 材料与试剂
皖浙花猪干腌火腿,购自安徽黄山市乌金园养猪专业合作社。随机采样多支后熟期火腿样品,真空包装后于(-18±2)℃储存备用。
对硝基苯-α-D-葡萄糖吡喃苷、碘、二甲基亚砜上海阿拉丁生化科技股份有限公司;阿卡波糖、α-淀粉酶(≥800 FAU/g)、α-葡萄糖苷酶(≥10 U/mg)美国Sigma-Aldrich公司;胃蛋白酶(≥2500 U/mg)、胰蛋白酶(>3000 U/mg)上海麦克林生化科技有限公司;盐酸、氢氧化钠、无水乙醇、碳酸钠、氯化钾、磷酸氢二钠、磷酸二氢钠、磷酸二氢钾(均为分析纯)国药集团化学试剂有限公司;马铃薯淀粉 晋城市古陵山食品有限公司;蛋白定量/浓度测定(二奎啉甲酸(bicinchoninic acid,BCA))试剂盒 大连美仑生物技术有限公司;Sephadex G-25凝胶填料 美国GE Healthcare公司;ODS-AQ-HG填料 日本YMC公司;合成肽 合肥科生景肽生物科技有限公司。
1.2 仪器与设备
Y55-40M高速分散乳化仪 上海约迪机械设备有限公司;H1750R离心机 湖南湘仪实验室仪器开发有限公司;N1300旋转蒸发仪 上海爱朗仪器有限公司;FD-1A-50真空冷冻干燥机 上海继谱电子科技有限公司;Infinite E PLEX酶标仪 瑞士Tecan公司;PHS-3CB型pH计 上海越平科学仪器有限公司;HL-2D恒流泵、HD-5电脑紫外检测仪、BSZ-100自动部分收集器上海沪西分析仪器厂有限公司;HC-0210-10中压层析柱15 mm×100 cm 上海华美实验仪器厂;RP-C18柱(0.15 mm×150 mm)美国Column技术公司;Mastersizer 2000激光粒度仪 英国Malvern公司;Easy nLC耦合Q Exactive质谱仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 多肽的提取
体外模拟胃肠消化:参考Wang Wenli等[19]的方法并修改。在均质机中加入100 g搅碎的火腿肌肉和400 mL磷酸盐缓冲液(phosphate buffer saline,PBS)(0.01 mol/L,pH 7.0)中,4 ℃、10000 r/min均质30 s/次,共循环8 次。调节pH值至2.0,添加质量分数2.5%的胃蛋白酶,37 ℃搅拌消化2 h后调节pH值至7.0灭酶。向胃产物中添加胰蛋白酶至最终质量分数为4%,37 ℃搅拌消化2 h后在95 ℃加热5 min灭酶。加入300 mL无水乙醇,4 ℃静置12 h沉淀未消化蛋白质。在4 ℃、10000×g离心20 min,取上清液进行旋蒸,冻干样品并冷冻保存。
水溶提取法:参考Mora等[17]的方法并修改。在均质机中加入100 g搅碎的火腿肌肉和400 mL 0.01 mol/L的HCl溶液,4 ℃、10000 r/min均质8 min,所得匀浆4 ℃、12000×g离心20 min,玻璃棉过滤后取液体。添加3 倍体积无水乙醇,4 ℃静置20 h沉淀蛋白质。将样品在上述条件下再次离心,取上清液进行旋蒸,冻干样品并冷冻保存。
1.3.2 消化率、提取率和可溶性肽含量测定
消化率是被消化的蛋白质占总蛋白质的比例。用BCA蛋白定量试剂盒检测样品消化前后的蛋白质含量[19],按式(1)计算消化率:
式中:W0和WD分别为样品消化前和消化后的蛋白质含量。
肽提取率是提取产物中蛋白质量与所用原料初始质量的比值,按式(2)计算[20]:
可溶性肽含量用于衡量可溶解的蛋白质占初始样品的质量百分比,是各组分溶液中的蛋白质量浓度与配制时样品质量浓度的比值,可溶性肽质量分数按式(3)计算:
式中:ρ1为各组分溶液中的蛋白质量浓度/(mg/mL);ρ0为配制时样品质量浓度/(mg/mL)。
1.3.3 葡聚糖凝胶分离纯化
将多肽样品复溶于超纯水中,制备成200 mg/mL溶液,通过0.45 μm水系膜过滤。取1.5 mL滤液上样于Sephadex G-25凝胶的中压层析柱(15 mm×100 cm)。以去离子水洗脱,流速1.0 mL/min,每管收集2.0 mL,检测波长220 nm。采用HD-A色谱处理系统记录图谱,同时收集各组分[21]。
1.3.4α-淀粉酶抑制活性测定
参考Hľasová等[22]的方法并修改。将100 mg马铃薯淀粉溶解于5 mL PBS(0.1 mol/L,pH 7.0)中煮沸5 min,冷却至室温作为底物。在96 微孔板中加入溶解于二甲基亚砜的2 μL质量浓度5 mg/mL样品、50 μL底物和30 μL上述PBS,37 ℃孵育5 min。添加20 μL、5 μg/mL的α-淀粉酶溶液,37 ℃孵育15 min。加入50 μL 1 mol/L HCl溶液终止反应。最后加入50 μL 0.01 mol/L碘溶液,测量650 nm波长处吸光度。以阿卡波糖作为阳性对照。α-淀粉酶抑制率计算公式如下:
式中:A1为含有样品、底物、酶的溶液吸光度;A2为含有样品和底物的溶液吸光度;A3为含有底物和酶的溶液吸光度;A4为仅含有底物的溶液吸光度。
1.3.5α-葡萄糖苷酶抑制活性测定
参照Wang Rongchun等[23]的方法并修改。在96 微孔板中加入25 μL PBS(0.2 mol/L,pH 6.8)、25 μL质量浓度1 mg/mL的对硝基苯-α-D-葡萄糖吡喃苷溶液和25 μL、10 mg/mL样品,混合后37 ℃孵育5 min。随后添加缓冲液配制的5 μL浓度0.2 U/mL的α-葡萄糖苷酶溶液,37 ℃孵育30 min。最后添加40 μL浓度1 mol/mL Na2CO3溶液终止反应,立即测量405 nm波长处光密度。以阿卡波糖作为阳性对照。α-葡萄糖苷酶抑制率按式(5)计算:
式中:ODS为样品和酶反应后的光密度;ODA为样品换为等量缓冲液的光密度;ODB为样品和酶都换为等量缓冲液的光密度。
1.3.6 粒度测定
利用Mastersizer 2000激光粒度仪测量上清液粒度[24]。设置如下:非球形颗粒,相对折射率为1.54,吸收率为0.001,密度为1 g/cm3,水作为分散剂。采用湿法检测,取0.1 g的样品分散于2 mL去离子水中,超声处理5 min使悬浮液均匀。随后滴加到样品池内,调至合适的遮光度。分析其平均粒径,测试3 次取平均值。
1.3.7 序列鉴定
参考钟玉旺等[25]的方法。液相色谱条件:A液为0.1%甲酸-水溶液,B液为0.1%甲酸-乙腈水溶液(乙腈为84%)。色谱柱为RP-C18柱(0.15 mm×150 mm),以95%的A液进行平衡,洗脱时间60 min。质谱鉴定:样品经毛细管高效液相色谱分离后进行质谱分析,时长:60 min,扫描范围:m/z300~1800,检测方式:正离子。多肽和多肽碎片的质荷比按照每次全扫描后采集10 个碎片图谱。原始文件用软件MaxQuant 1.5.5.1处理,根据UniProt_cameidae_89471_20201019(包含89471 个序列,于2020年10月19日下载)搜索,得到鉴定及定量分析结果。
1.3.8 序列筛选
利用PeptideRanker程序(http://distilldeep.ucd.ie/PeptideRanker/)对序列评分,评分高于0.7为备选序列[26];利用Expasy-PeptideCutter(https://web.expasy.org/peptide_cutter/)对序列进行虚拟水解;在BIOPEP-UWM数据库(https://biochemia.uwm.edu.pl/)中检索可能存在的降糖序列[27];利用PepDraw(http://www2.tulane.edu/~biochem/WW/PepDraw/)在线预测序列的等电点、净电荷和疏水性[28];采用ToxinPred(https://webs.iiitd.edu.in/raghava/toxinpred/design.php)和Pepcalc程序(https://pepcalc.com/)分析毒性和水溶性[29]。
1.3.9 量子化学计算
参考Wen Chaoting等[30]的方法,使用Gaussview 5.0软件构建分子结构,在Gaussian 09软件中选择B3LYP/6-31G(d)基组进行全分子几何构型优化,直到振动频率无负值,虚频为零。计算肽分子的能量参数(分子总能量、分子前线轨道分布与能级)和结构参数(原子Mulliken电荷分布、键长)等。
1.3.10 肽的固相合成
采用体外固相法合成筛选出的肽序列,并利用液相色谱和质谱分析其纯度和分子质量,得到纯度>95.00%、分子质量准确的肽组分。
1.4 统计分析
使用Microsoft Excel、SPSS Statistics 26.0和Origin 2018进行数据处理与分析;所有实验重复3 次,结果表示为。
2 结果与分析
2.1 多肽消化率、提取率和可溶性肽含量
牛血清白蛋白标准曲线方程为y=0.2478x+0.0095(R2=0.9981),线性良好。根据样品的吸光度,换算得到样品的蛋白质量浓度/(mg/mL)。计算出胃蛋白酶对多肽的消化率为(46.41±1.23)%,再经胰蛋白酶消化后显著增加至(79.11±1.85)%(P<0.05),类似1~3 a成熟期中国干腌火腿(金华、如高和宣威)的体外消化率[19]。如表1所示,水溶法对肽的提取率为(3.81±0.07)%,符合已有研究[20]。而胃胰酶消化法的肽提取率是水溶法的10 倍以上,其产物的可溶性肽含量也显著较高(P<0.05)。可见胃胰酶消化法的提取效率更高。

表1 两种方法的肽提取率及产物的可溶性肽含量Table 1 Extraction rates of peptides and soluble peptide contents of the water extract and the gastropancreatic digest of dry-cured ham
2.2 葡聚糖凝胶分离纯化结果
葡聚糖凝胶常用于对干腌火腿中不同分子质量的肽进行分级。图1a是胃胰酶消化产物的葡聚糖凝胶Sephadex G-25分离图谱,总洗脱时间为170 min,主要分为WY-I(40~90 min)、WY-II(95~125 min)和WY-III(125~160 min)3 个组分。图1b是水提物的分离图谱,总洗脱时间为220 min,主要分为S-I(50~140 min)和S-II(140~220 min)2 个组分。根据分离原理,出峰越晚,分子质量越小,各组分的分子质量依次为:WY-I>WY-II>WY-III和S-1>S-II。西式干腌火腿小肽有类似的分离图谱,活性最高组分中所含肽的分子质量为400~2500 Da[17]。

图1 胃胰酶消化产物(a)和水提物(b)的Sephadex G-25分离图谱Fig.1 Sephadex G-25 gel filtration chromatograms of the gastropancreatic digest (a) and the aqueous extract (b)
如图2所示,各组分均对两种酶表现了一定的抑制活性,而胃胰酶消化产物及组分的活性远高于水溶提取肽及组分。可能是由于酶对蛋白的切割作用。α-淀粉酶抑制率排序为:WY-I>WY-II>WY>WY-III>S-II>S-I>S,而α-葡萄糖苷酶抑制率为:WY-II>WY>WY-I>S-II>WY-III>S>S-I。降糖活性肽大多为小分子[31],且只有WY-II组分的两种抑制率均高于60%,分别为(66.66±1.2)%和(68.28±2.73)%,因此选择它进行后续研究。
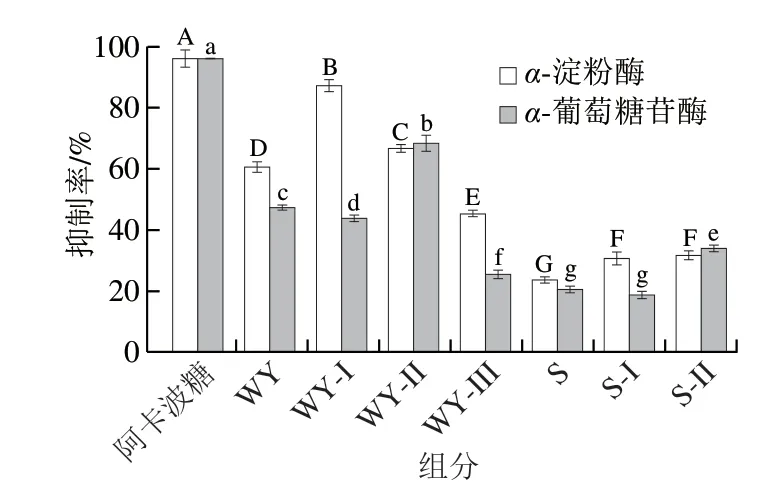
图2 胃胰酶消化产物和水提物及其分离组分的α-淀粉酶抑制率和α-葡萄糖苷酶抑制率Fig.2 α-Amylase and α-glucosidase inhibitory activities of the gastropancreatic digest and the aqueous extract as well as their separated fractions
2.3 粒径分析
颗粒大小反映了蛋白质经过消化或均质后的降解程度,影响其体内吸收能力。表2为火腿肌肉粗蛋白、两种提取物及其分离组分上清液的粒径。分离前,粗蛋白的D4,3和D3,2均最大。分离后不同组分的粒径存在显著差异(P<0.05)。消化肽的3 个组分中WY-I的粒径最大,而WY-II和WY-III的D4,3和D3,2无显著差异,说明二者的粒径分布相对相似。水溶物两个组分S-I和S-II的粒径均显著大于消化肽组分。说明火腿肌肉经过蛋白酶降解,颗粒尺寸显著减小,符合现有研究[19,24]。

表2 胃胰酶消化产物和水提物及其分离组分的粒径Table 2 Particle sizes of the gastropancreatic digest and the aqueous extract as well as their separated fractions μm
2.4 序列鉴定和筛选
鉴定高活性组分WY-II中的小肽,获得了104 条长度8~24 个氨基酸的序列。主要蛋白来源有平滑肌肌动蛋白α2、肌球蛋白-4、I型胶原蛋白α1链、肌酸激酶、肌球蛋白轻链1等。利用多种生物信息学工具进行筛选,获得了5 条PeptideRanker评分高于0.7的备选序列,长度9~14 肽,分子质量854~1252 Da。小分子肽活性高可能是与酶活性中心残基形成了氢键。而氨基酸性质和排列也有重要影响,尤其是疏水性。表3中序列含有大量疏水性脯氨酸(N端第二位及中间),N端存在甘氨酸,C端含有碱性氨基酸(精氨酸、赖氨酸)。序列包含支链氨基酸[32],N端的甘氨酸[33]和亮氨酸[34],或PP、GP等特定二肽[33]更易结合α-淀粉酶。此外,含有疏水性亮氨酸、脯氨酸[23],以及胰蛋白酶水解后末端具有精氨酸或赖氨酸的肽都会抑制α-葡萄糖苷酶[35]。肽的等电点和静电荷与活性之间具有强相关性[14],5 条序列的理论等电点为9.80~11.13,净电荷为1,疏水性为13.37~16.00 kcal/mol,均无毒性,其中4 条水溶性良好。因此,筛选这5 条序列进行量子化学计算。

表3 组分WY-II中的肽序列及其理化性质Table 3 Physicochemical properties of peptide sequences in WY-II
2.5 分子构型优化
图3为量子化学优化后5 条备选序列的分子构型。序列的长度较长,增加了形成分子内氢键的可能性,也有利于形成在蛋白质二级结构中占主导的α-螺旋。螺旋结构的稳定性是多种综合性质(构象熵、空间位阻、疏水性和静电性等)平衡的结果,其中氢键网络具有重要作用[36]。5 条序列均具有脯氨酸,其侧链的吡咯环结构具有特殊构象刚性,分子结构出现明显转角。P2、P3的空间结构较为收缩,P3分子形状卷曲复杂,可能是脯氨酸出现次数多,分子内相互作用力较大。除P3外均含有精氨酸,其中P2精氨酸侧链胍基与N2位脯氨酸吡咯环相互作用,促使结构更为紧凑。P4和P5空间结构较为伸展,可能因为分子内相互作用力较小。

图3 5 条血糖调节肽的最优空间构象Fig.3 Optimal spatial conformations of five blood glucose-regulating peptides
2.6 前线分子轨道分布
分子前线轨道理论认为分子轨道是分子体系的波函数,分子里也存在活跃的“前线分子轨道”,即能量最高的电子占有轨道(highest occupied molecular orbital,HOMO)和能量最低的电子未占轨道(lowest unoccupied molecular orbital,LUMO),分别表示供电子和接收电子区域。化学反应只和前线分子轨道有关,且HOMO轨道具有特殊地位[37]。
图4是5 条序列的前线分子轨道分布,这些位点与酶的反应活性可能有显著差异。P1~P5分别有687、651、1119、914、834 条分子轨道及能级。其中,P1、P2和P5的HOMO轨道都主要分布在精氨酸的胍基上。胍基释放出活泼氢后,存在超共轭及共轭现象,结构稳定。P3的HOMO轨道主要分布在C端赖氨酸的侧链,P4的HOMO轨道主要分布在N端亮氨酸。而P1的LUMO轨道主要分布在C4位甘氨酸残基、C3位脯氨酸、C2位精氨酸的肽键,P2~P5的LUMO轨道都分布在C端氨基酸的羧基。可见,氨基酸和种类和不同排列都会影响HOMO的分布[11],HOMO轨道多分布在精氨酸的胍基及靠近氨基端的活性基团,而LUMO轨道则主要分布在末端羧基及靠近羧基端的基团。

图4 5 条血糖调节肽的前线分子轨道分布Fig.4 HOMO and LUMO orbit distribution of five blood glucoseregulating peptides
分子总能量越小,结构越稳定[38]。表4中5 条序列的总能量排序:P1>P2>P5>P4>P3。最高占有轨道能级值(EHOMO)和最低未占有轨道能级(ELUMO)分别反应分子的供电子和接受电子能力。EHOMO越大供电子能力越强,易发生亲核反应[39]。表4中EHOMO排序:P3>P2>P5>P4>P1,说明P3和P2供电子能力较强。而ELUMO越低接受电子能力越强,ELUMO排序为:P2<P4<P1<P5<P3。ELUMO与EHOMO的差值ΔEL-H表示电子从基础态跃迁到激发态所需的能量。能级差越小,π-电子从低能区到高能区的激发增加,分子反应活性越强;而能级差越大则分子刚性更强、更稳定,电子跌迁能力越弱[40]。由表4可见,ΔEL-H值随着EHOMO的增加有下降的趋势,与Kęska等[14]研究相似。其排序是:P2<P4<P3<P5<P1,故P2、P4、P3的活性可能相对较高。

表4 5 条血糖调节肽的偶极矩、总能量和前线分子轨道能量Fig.4 Dipole moment,total energy,and molecular orbital energy of five blood glucose-regulating peptides
2.7 电荷分布、键长与活性位点
降糖肽分子的电荷分布和键长对活性有重要影响,主要在前线分子轨道中能级相近的位置上与受体分子发生相互作用。活性部位最有可能是对前线轨道贡献较大的原子,如HOMO轨道。由库仑公式可知:两原子之间的静电荷差值越小,或距离越远(键长越长),则库伦作用力越小,键越弱,越易断裂,血糖调节能力越强。
5 条序列的电荷分布规律相似,负电荷主要分布在N和O原子上,正电荷主要分布在与H及与O相连的C原子上(数值未列出)。由图4和表5可知,P1的HOMO主要分布在精氨酸的胍基,是反应活性部位所在。在97~114号原子之间,静电荷差值最小的两原子是C100(-0.2443 e)与H103(0.1431 e)、C104(-0.1015 e)与H105(0.1285 e),对应键长为C100H103(1.5384 Å)和C104H105(1.3609 Å),根据库仑定律计算得C104H105两原子间的库仑作用力最小,因此,P1活性位点位于精氨酸的C104H105。同理可证,P2~P5的活性位点分别位于精氨酸的C106H108、赖氨酸的C176H177、亮氨酸的C10H12、精氨酸胍基的C35H37。可见,5 条序列的活性位点都位于C—H键。这与抗氧化肽的结果有所不同。四肽DYDD和DDDY的活性位点都位于O58-H59和N10-H12[11],且肽的活性也可能来自多种不同活性位点[10]。

表5 P1序列GPAGPQGPRG的Mulliken电荷分布及键长Table 5 Mulliken charge distribution and bond length of sequence P1-GPAGPQGPRG
2.8 活性验证
为验证推断的准确性,采用固相法合成上述5 条肽序列,再实测其体外α-淀粉酶抑制率和α-葡萄糖苷酶抑制率。如表6所示,两种降糖活性的排序依次为:P2>P4>P3>P5>P1和P2>P3>P4>P5>P1。综合分析量子化学参数及体外活性,发现活性与前线轨道能级差ΔEL-H有较明显的相关性,可能因为ΔEL-H越小,电子的跃迁能力越强,分子在化学反应中的活性越强。针对抗氧化肽的研究也有类似结论[41]。

表6 5 条肽序列的α-淀粉酶抑制率和α-葡萄糖苷酶抑制率Table 6 α-Amylase and α-glucosidase inhibition rates of five synthetic peptides
3 结论
从皖浙花猪干腌火腿胃胰酶消化产物的高降糖活性组分中鉴定出104 条肽,筛选出5 条备选序列,量子化学计算发现HOMO轨道多分布在精氨酸的胍基及靠近氨基端的活性集团上,而LUMO轨道则多分布在末端羧基及靠近羧基端的基团上;能级差较小、活性可能较高的序列为GPMGPSGPR、LGFGGPSGPNAGR、APAPAPAPAPAPPK;根据电荷分布和键长推测5 条序列的活性位点都位于C—H键;体外活性验证了降糖活性可能与能级差有关。下一步考虑利用体外模型验证序列的活性与位点。
